《化学必修2》实验汇编
实验一:化学反应与能量Ba(OH)2·8H2O与NH4Cl的反应。观察现象。
现象与解释:刺激性气味气体产生,烧杯壁变凉,玻璃片粘在烧杯底部。说明该反应是吸热反应。化学方程式:
实验二:催化剂对化学反应速率的影响。(注意对比实验的设计方法)
H2O2溶液,分别加入少量MnO2粉末、1~2滴1mol/L的FeCl3溶液。
化学方程式:
许多过渡金属的氧化物或盐类对H2O2的分解有催化作用。
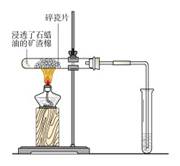
实验三:石蜡油的分解实验
1.导管口有气泡冒出,KMnO4溶液红色褪去
2.溴的四氯化碳溶液的橙红色褪去
3.收集到的气体能够在空气中燃烧
【科学探究】实验装置也可以改为右图所示装置;在试管①中加入石蜡油和 ;试管②放在冷水中;试管③中加入KMnO4溶液或溴水。

实验要点:(1)石棉要尽量多吸收石蜡油。
(2)石蜡油分解反应的温度要在500 ℃以上。
(3)实验中要注意防止倒吸;
实验中,碎瓷片和氧化铝的作用是:氧化铝起催化剂的作用,碎瓷片除了催化作用还起到间接加热的作用。
实验四:苯的性质(掌握探究有机物结构的简单实验方法)

结论:苯分子虽然不饱和程度较大,但分子中并没有C=C,不能与溴发生加成反应,也不能被酸性KMnO4溶液氧化。
实验五:苯与溴的反应
(1)反应原料:苯、纯溴、铁
(2)反应原理: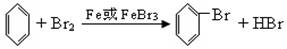
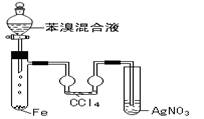
(3)反应装置:S + l  g (具支试管、(或锥形瓶、广口瓶、烧瓶、大试管等)、分液漏斗等)
g (具支试管、(或锥形瓶、广口瓶、烧瓶、大试管等)、分液漏斗等)
(4)尾气处理:吸收法(用碱液吸收,一般用NaOH溶液)
(5)几点说明:
①将反应混合物倒入水中,呈褐色不溶于水的液体,是因为未反应的溴溶解在溴苯中的缘故,可用碱溶液(NaOH溶液)反复洗涤再分液。
②不能用甲苯的方法来除去溴苯中溶解的溴,因为苯也能溶解溴苯。
③AgNO3溶液中有浅黄色沉淀生成,说明有HBr气体生成该反应应为取代饭应。
④若无吸收管,则AgNO3溶液中有浅黄色沉淀生成,不能说明该反应为取代
反应,因为Br2(g)溶于水形成溴水也能使AgNO3溶液中产生浅黄色沉淀。
⑤吸收管中CCl4的作用是吸收Br2(g),防止对HBr检验的干扰。
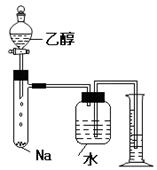
实验六:乙醇的性质:
1.乙醇与金属钠的反应
(1)反应原料:乙醇、钠
(2)反应原理:2CH3CH2OH +2Na  2CH3CH2ONa + H2↑
2CH3CH2ONa + H2↑
(3)发生装置:S + l  g(试管、(或锥形瓶、烧瓶等)、分液漏斗等)
g(试管、(或锥形瓶、烧瓶等)、分液漏斗等)
(4)气体体积的测定:排水法(排出水的体积即为气体的体积)
(5)注意事项:
① 防止因气体受热膨胀,使得测得的体积偏大,应冷却至室温后读数。读数时多功能瓶与量筒的液面要齐平(等高)。
②为防止冷却后,量筒中水倒流一部分进入中间的试剂瓶中,而使测得的体积偏大,应将量筒中的导管插入水面以下。
③读数时导管内水的体积不考虑在内,会影响测定结果。
★乙醇与金属钠的反应,常作为定量实验的出题知识点,也可以通过测定一定质量的有机物与足量Na反应生成的气体判断有机物的结构。
练习1.现有质量为m g的乙醚和乙醇的混合物试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量。可供选用的反应物和试剂为:新制的生石灰、浓H2SO4、蒸馏水、金属钠、碱石灰、无水硫酸铜。

(1)写出在实验中乙醇发生反应的化学方程式 ;
(2)应选用的装置是 (填序号);
(3)所用装置的连接顺序应是(填各接口字母,连接胶管省略):
(4)乙醚在医疗上是一种全身麻醉剂。普通乙醚中含有少量水和乙醇。要检验乙醚中含少量水应选用何种试剂?有什么现象?(试剂在题中所给试剂中选)
(5)若测量出量筒中水的体积为VmL(标况下),则乙醇的质量分数的计算式为 。
2.乙醇的催化氧化

1)反应原料:乙醇、空气、铜丝
(2)反应原理:
(3)注意事项:
①该反应中Cu为催化剂,CuO为中间物质。②该反应放热,放出的热量足以维持反应继续进行。
实验七:乙酸的酯化反应:
(1)反应原料:乙醇、乙酸、浓H2SO4、饱和Na2CO3溶液
(2)反应原理:
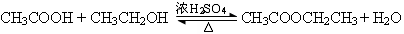
(3)反应装置:试管、烧杯、酒精灯
(4)注意事项:
①浓H2SO4在反应中起催化剂、吸水剂的作用。
②饱和Na2CO3溶液的作用:
a、中和挥发出来的乙酸,生成醋酸钠以便于文乙酸乙酯的气味;
b、溶解挥发出来的乙醇;
c、冷凝酯蒸汽且减小酯在水中的溶解度,以便于分层析出,分液。
③不能用NaOH溶液代替饱和Na2CO3溶液,因为乙酸乙酯在强碱NaOH存在下水解较彻底,几乎得不到乙酸乙酯。导管未插入液面以下,是为了防倒吸。
④酯的分离:酯在试管中的上层,用分液漏斗分液取。。
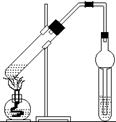
本实验是有机化学中最重要的实验之一,是高考有机实验的热点。考查内容可以是对该实验的注意事项进行考查,如练习8;也可稍改进后的实验进行考查,如右图,对接收装置进行改装。
练习2.可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序用操作是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)实验中加热试管a的目的是:
① ;② 。
(4)试管b中加有饱和Na2CO3溶液,其作用是 。
实验八:金属的冶炼――铝热反应
★铝热反应的操作和运用往往容易被忽视,但近几年高考题中出现的频率较高,大部分是穿插在推断题中。要掌握铝热反应的操作,知道是固+固冶炼金属的方法,铝和CuO、Cr2O3、MnO2、WO3都能发生置换反应。
练习3.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol· 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 ,产物中的单质B是 。
(2)②中所发生的各反应的化学方程式是 。(3)③中所发生的各反应的离子方程式是 。
实验九:海水资源的开发利用:
1.海水中提取溴:
步骤:①海水浓缩酸化→②用氯气置换出溴单质→③通空气吹出溴蒸气→④用SO2(水)吸收→HBr
请写出有关步骤的离子方程式:
② ④
2.海带中提取碘:写出碘化钾与稀硫酸、双氧水的反应方程式
离子方程式
练习4.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
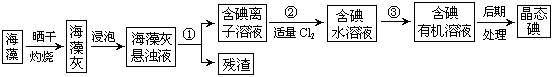
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;过程②中有关反应的离子方程式为 。
(2)提取碘的过程中,可供选择的有机试剂是
A 甲苯、酒精 B 四氯化碳、苯 C 汽油、乙酸 D 汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有 、 。
(4)从含碘的有机溶液中提取碘和回收有
机溶剂,还须经过蒸馏,指出右面实
验装置图中的错误之处:
① ;
② ;
③ 。
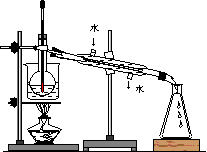
(5)进行上述蒸馏操作时,使用水浴加热的原因是 ,最后晶态碘在 里聚集。
