㈠物质结构 元素周期律
周期 同一横行 周期序数=电子层数
类别 周期序数 起止元素 包括元素种数 核外电子层数
短周期 1、 H—He 2 1; 2、 Li—Ne 8 2; 3、 Na—Ar 8 3;
长周期 4、 K—Kr 18 4; 5、 Rb—Xe 18 5; 6、 Cs—Rn 32 6;
7、不完全 Fr—112号(118) 26(32) 7
第七周期 原子序数 113 114 115 116 117 118
个位数=最外层电子数 ⅢA ⅣA ⅤA ⅥA ⅦA 0族
主族元素的族序数=元素原子的最外层电子数(或:主族序数=最外层电子数)
18个纵行(7个主族;7个副族;一个零族;一个Ⅷ族(8、9、10三个纵行))
主族 A 7个 由短周期元素和长周期元素共同构成
副族 B 7个 完全由长周期元素构成 第Ⅷ族和全部副族通称过渡金属元素
Ⅷ族 1个有3个纵行
零族 1个 稀有气体元素 非常不活泼
㈡碱金属 锂、钠、钾、铷、铯、钫(Li、Na、K、Rb、Cs、Fr)
结构 因最外层都只有一个电子,易失去电子,显+1价,
物理性质 密度 逐渐增大 熔沸点 逐渐降低 (反常)
化学性质 原子核外电子层数增加,最外层电子离核越远,
失电子能力逐渐增强,金属性逐渐增强,金属越活泼
㈢卤素 氟、氯、溴、碘、砹(F、Cl、Br、I、At)
结构 因最外层都有7个电子,易得到电子,显-1价,
物理性质 密度 逐渐增大
熔沸点 逐渐升高 (正常)
颜色状态 颜色逐渐加深 浅黄绿色—黄绿色—深红棕色—紫黑色 气态~液态~固态
溶解性 逐渐减小
化学性质 原子核外电子层数增加,最外层电子离核越远,
得电子能力逐渐减弱,非金属性逐渐减弱,金属越不活泼
与氢气反应 剧烈程度:F2>Cl2>Br2>I2
氢化物稳定性 HF>HCl>HBr>HI
氢化物水溶液酸性 HF<HCl<HBr<HI(HF为弱酸,一弱三强) 氢化物越稳定,在水中越难电离,酸性越弱
㈣核素
原子质量主要由质子和中子的质量决定。
质量数 质量数(A)=质子数(Z)+十中子数(N)
核素 把一定数目的质子和一定数目的中子的一种原子称核素
同位素 质子数相同而中子数不同的同一元素的不同原子互称同位素
“同位”是指质子数相同,周期表中位置相同,核素是指单个原子而言,而同位素则是指核素之间关系 。特性 同一元素的各种同位素化学性质几乎相同,物理性质不同
在天然存在的某种元素中,不论是游离态,还是化合态,各种同位素所占的丰度(原子百分比)一般是不变的
㈤原子核外电子的排步

离核远近 由近到远
能量 由低到高
各层最多容纳的电子数 2×12=2、 2×22=8、 2×32=18、 2×42=32、 2×52=50、 2×62=72、 2×72=98 (2×n2,n≥1的整数)
㈥非金属性与金属性(一般规律):
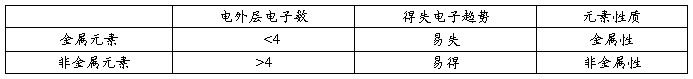

㈦元素周期律:
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫做元素周期律
⑴ A、越左越下,金属越活泼,原子半径越大,最外层离核越远,还原性越强。
越易和水(或酸)反应放H2越剧烈,最高价氧化物的水化物的碱性越强
B、越右越上,非金属越活泼,原子半径越小,最外层离核越近,氧化性越强。
越易和H2化合越剧烈,最高价氧化物的水化物的酸性越强
⑵ 推断短周期的元素的方法(第二、第三周期)
框框图:
A 第二周期 若A的质子数为n时
C B D 第三周期 若A的最外层电子数为a
n 2+a
n+7 n+8 n+9 9+a 10+a 11+a
第一章 物质结构 元素周期律
1. 原子结构:如: 的质子数与质量数,中子数,电子数之间的关系
2. 元素周期表和周期律
(1)元素周期表的结构
A. 周期序数=电子层数
B. 原子序数=质子数
C. 主族序数=最外层电子数=元素的最高正价数
D. 主族非金属元素的负化合价数=8-主族序数
E. 周期表结构
(2)元素周期律(重点)
A. 元素的金属性和非金属性强弱的比较(难点)
a. 单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性
b. 最高价氧化物的水化物的碱性或酸性强弱
c. 单质的还原性或氧化性的强弱
(注意:单质与相应离子的性质的变化规律相反)
B. 元素性质随周期和族的变化规律
a. 同一周期,从左到右,元素的金属性逐渐变弱
b. 同一周期,从左到右,元素的非金属性逐渐增强
c. 同一主族,从上到下,元素的金属性逐渐增强
d. 同一主族,从上到下,元素的非金属性逐渐减弱
C. 第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)
D. 微粒半径大小的比较规律:
a. 原子与原子 b. 原子与其离子 c. 电子层结构相同的离子
(3)元素周期律的应用(重难点)
A. “位,构,性”三者之间的关系
a. 原子结构决定元素在元素周期表中的位置
b. 原子结构决定元素的化学性质
c. 以位置推测原子结构和元素性质
B. 预测新元素及其性质
3. 化学键(重点)
(1)离子键:
A. 相关概念:
B. 离子化合物:大多数盐、强碱、典型金属氧化物
C. 离子化合物形成过程的电子式的表示(难点) (AB, A2B,AB2, NaOH,Na2O2,NH4Cl,O22-,NH4+)
(2)共价键:
A. 相关概念:
B. 共价化合物:只有非金属的化合物(除了铵盐)
C. 共价化合物形成过程的电子式的表示(难点) (NH3,CH4,CO2,HClO,H2O2)
D 极性键与非极性键
(3)化学键的概念和化学反应的本质:
第二章 化学反应与能量
1. 化学能与热能
(1)化学反应中能量变化的主要原因:化学键的断裂和形成
(2)化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小
a. 吸热反应: 反应物的总能量小于生成物的总能量
b. 放热反应: 反应物的总能量大于生成物的总能量
(3)化学反应的一大特征:化学反应的过程中总是伴随着能量变化,通常表现为热量变化
(4)常见的放热反应:
A. 所有燃烧反应; B. 中和反应; C. 大多数化合反应; D. 活泼金属跟水或酸反应;
E. 物质的缓慢氧化
(5)常见的吸热反应:
A. 大多数分解反应;
氯化铵与八水合氢氧化钡的反应。
(6)中和热:(重点)
A. 概念:稀的强酸与强碱发生中和反应生成1mol H2O(液态)时所释放的热量。
2. 化学能与电能
(1)原电池(重点)
A. 概念:
B. 工作原理:
a. 负极:失电子(化合价升高),发生氧化反应
b. 正极:得电子(化合价降低),发生还原反应
C. 原电池的构成条件 :
关键是能自发进行的氧化还原反应能形成原电池
a. 有两种活泼性不同的金属或金属与非金属导体作电极
b. 电极均插入同一电解质溶液
c. 两电极相连(直接或间接)形成闭合回路
D. 原电池正、负极的判断:
a. 负极:电子流出的电极(较活泼的金属),金属化合价升高
b. 正极:电子流入的电极(较不活泼的金属、石墨等):元素化合价降低
E. 金属活泼性的判断:
a. 金属活动性顺序表
b. 原电池的负极(电子流出的电极,质量减少的电极)的金属更活泼 ;
c. 原电池的正极(电子流入的电极,质量不变或增加的电极,冒气泡的电极)为较不活泼金属
F. 原电池的电极反应:(难点)
a. 负极反应:X-ne=Xn-
b. 正极反应:溶液中的阳离子得电子的还原反应
(2)原电池的设计:(难点)
根据电池反应设计原电池:(三部分+导线)
A. 负极为失电子的金属(即化合价升高的物质)
B. 正极为比负极不活泼的金属或石墨
C. 电解质溶液含有反应中得电子的阳离子(即化合价降低的物质)
(3)金属的电化学腐蚀
A. 不纯的金属(或合金)在电解质溶液中的腐蚀,关键形成了原电池,加速了金属腐蚀
B. 金属腐蚀的防护:
a. 改变金属内部组成结构,可以增强金属耐腐蚀的能力。如:不锈钢。
b. 在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果。(油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜)
c. 电化学保护法:
牺牲活泼金属保护法,外加电流保护法
(4)发展中的化学电源
A. 干电池(锌锰电池)
a. 负极:Zn -2e - = Zn 2+
b. 参与正极反应的是MnO2和NH4+
B. 充电电池
a. 铅蓄电池:
铅蓄电池充电和放电的总化学方程式
放电时电极反应:
负极:Pb + SO42--2e-=PbSO4
正极:PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O
b. 氢氧燃料电池:它是一种高效、不污染环境的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
总反应:2H2 + O2=2H2O
电极反应为(电解质溶液为KOH溶液)
负极:2H2 + 4OH- - 4e- → 4H2O
正极:O2 + 2H2O + 4e- → 4OH-
3. 化学反应速率与限度
(1)化学反应速率
A. 化学反应速率的概念:
B. 计算(重点)
a. 简单计算
b. 已知物质的量n的变化或者质量m的变化,转化成物质的量浓度c的变化后再求反应速率v
c. 化学反应速率之比 = 化学计量数之比,据此计算:
已知反应方程和某物质表示的反应速率,求另一物质表示的反应速率;
已知反应中各物质表示的反应速率之比或△C之比,求反应方程。
d. 比较不同条件下同一反应的反应速率
关键:找同一参照物,比较同一物质表示的速率(即把其他的物质表示的反应速率转化成同一物质表示的反应速率)
(2)影响化学反应速率的因素(重点)
A. 决定化学反应速率的主要因素:反应物自身的性质(内因)
B. 外因:
a. 浓度越大,反应速率越快
b. 升高温度(任何反应,无论吸热还是放热),加快反应速率 c. 催化剂一般加快反应速率
d. 有气体参加的反应,增大压强,反应速率加快
e. 固体表面积越大,反应速率越快 f. 光、反应物的状态、溶剂等
(3)化学反应的限度
A. 可逆反应的概念和特点
B. 绝大多数化学反应都有可逆性,只是不同的化学反应的限度不同;相同的化学反应,不同的条件下其限度也可能不同
a. 化学反应限度的概念:
一定条件下, 当一个可逆反应进行到正反应和逆反应的速率相等,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这种状态称为化学平衡状态,简称化学平衡,这就是可逆反应所能达到的限度。
b. 化学平衡的曲线:
c. 可逆反应达到平衡状态的标志:
反应混合物中各组分浓度保持不变
↓
正反应速率=逆反应速率
↓
消耗A的速率=生成A的速率
d. 怎样判断一个反应是否达到平衡:
(1)正反应速率与逆反应速率相等; (2)反应物与生成物浓度不再改变;
(3)混合体系中各组分的质量分数 不再发生变化;
(4)条件变,反应所能达到的限度发生变化。
化学平衡的特点:逆、等、动、定、变、同。
第三章复习纲要(要求自己填写空白处)
(一)甲烷
一、甲烷的元素组成与分子结构
CH4 正四面体
二、甲烷的物理性质
三、甲烷的化学性质
1、甲烷的氧化反应
实验现象:
反应的化学方程式:
2、甲烷的取代反应
甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代反应能生成一系列甲烷的氯取代物和氯化氢。
有机化合物分子中的某些原子(或原子团)被另一种原子(或原子团)所替代的反应,叫做取代反应。
3、甲烷受热分解:
(二)烷烃
烷烃的概念: 叫做饱和链烃,或称烷烃。
1、 烷烃的通式:____________________
2、 烷烃物理性质:
(1) 状态:一般情况下,1—4个碳原子烷烃为___________,
5—16个碳原子为__________,16个碳原子以上为_____________。
(2) 溶解性:烷烃________溶于水,_________溶(填“易”、“难”)于有机溶剂。
(3) 熔沸点:随着碳原子数的递增,熔沸点逐渐_____________。
(4) 密度:随着碳原子数的递增,密度逐渐___________。
3、 烷烃的化学性质
(1)一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都______反应。
(2)取代反应:在光照条件下能跟卤素发生取代反应。__________________________
(3)氧化反应:在点燃条件下,烷烃能燃烧______________________________
(三)同系物
同系物的概念:_______________________________________________
掌握概念的三个关键:(1)通式相同;(2)结构相似;(3)组成上相差n个(n≥1)
CH2原子团。
(四)同分异构现象和同分异构物体
1、 同分异构现象:化合物具有相同的________,但具有不同_________的现象。
2、 同分异构体:化合物具有相同的_________,不同________的物质互称为同分异构体。
3、 同分异构体的特点:________相同,________不同,性质也不相同。
〔知识拓展〕
烷烃的系统命名法:
选主链——碳原子最多的碳链为主链;
编号位——定支链,要求取代基所在的碳原子的编号代数和为最小;
写名称——支链名称在前,母体名称在后;先写简单取代基,后写复杂取代基;相
同的取代基合并起来,用二、三等数字表示。
(五)烯烃
一、乙烯的组成和分子结构
1、组成: 分子式: 含碳量比甲烷高。
2、分子结构:含有碳碳双键。双键的键长比单键的键长要短些。
二、乙烯的氧化反应
1、燃烧反应(请书写燃烧的化学方程式)
化学方程式
2、与酸性高锰酸钾溶液的作用——被氧化,高锰酸钾被还原而退色,这是由于乙烯分子中含有碳碳双键的缘故。(乙烯被氧化生成二氧化碳)
三、乙烯的加成反应
1、与溴的加成反应(乙烯气体可使溴的四氯化碳溶液退色)
CH2═CH2+Br-Br→CH2Br-CH2Br 1,2-二溴乙烷(无色)
2、与水的加成反应
CH2═CH2+H-OH→CH3—CH2OH 乙醇(酒精)
书写乙烯与氢气、氯气、溴化氢的加成反应。
乙烯与氢气反应
乙烯与氯气反应
乙烯与溴化氢反应
[知识拓展]
四、乙烯的加聚反应: nCH2═CH2 → [CH2-CH2] n
(六)苯、芳香烃
一、苯的组成与结构
1、分子式 C6H6
2、结构特点
二、苯的物理性质:
三、苯的主要化学性质
1、苯的氧化反应
苯的可燃性,苯完全燃烧生成二氧化碳和水,在空气中燃烧冒浓烟。
2C6H6+15O2 12CO2+6H2O
[思考]你能解释苯在空气中燃烧冒黑烟的原因吗?
注意:苯不能被酸性高锰酸钾溶液氧化。
2、苯的取代反应
在一定条件下苯能够发生取代反应
书写苯与液溴、硝酸发生取代反应的化学方程式。
苯 与液溴反应 与硝酸反应
反应条件
化学反应方程式
注意事项
[知识拓展] 苯的磺化反应
化学方程式:
3、在特殊条件下,苯能与氢气、氯气发生加成反应
反应的化学方程式: 、
(七)烃的衍生物
一、乙醇的物理性质:
二、乙醇的分子结构
结构式:
结构简式:
三、乙醇的化学性质
1、乙醇能与金属钠(活泼的金属)反应:
2、乙醇的氧化反应
(1) 乙醇燃烧
化学反应方程式:
(2) 乙醇的催化氧化
化学反应方程式:
(3)乙醇还可以与酸性高锰酸钾溶液或酸性重铬酸钾溶液反应,被直接氧化成乙酸。
〔知识拓展〕
1、 乙醇的脱水反应
(1)分子内脱水,生成乙烯
化学反应方程式:
(2)分子间脱水,生成乙醚
化学反应方程式:
四、乙酸
乙酸的物理性质:
写出乙酸的结构式、结构简式。
酯化反应:酸跟醇作用而生成酯和水的反应,叫做酯化反应。
反应现象:
反应化学方程式:
1、在酯化反应中,乙酸最终变成乙酸乙酯。这时乙酸的分子结构发生什么变化?
2、酯化反应在常温下反应极慢,一般15年才能达到平衡。怎样能使反应加快呢?
3、酯化反应的实验时加热、加入浓硫酸。浓硫酸在这里起什么作用?
4为什么用来吸收反应生成物的试管里要装饱和碳酸钠溶液?不用饱和碳酸钠溶液而改用水来吸收酯化反应的生成物,会有什么不同的结果?
5为什么出气导管口不能插入碳酸钠液面下?
五、基本营养物质
1、糖类、油脂、蛋白质主要含有 元素,分子的组成比较复杂。
2、葡萄糖和果糖,蔗糖和麦芽糖分别互称为 ,由于结构决定性质,因此它们具有 性质。
1、有一个糖尿病患者去医院检验病情,如果你是一名医生,你将用什么化学原理去确定其病情的轻重?
2、已知方志敏同志在监狱中写给鲁迅的信是用米汤写的,鲁迅的是如何看到信的内容的?
3、如是否有过这样的经历,在使用浓硝酸时不慎溅到皮肤上,皮肤会有什么变化?为什么?
第四章化学与可持续发展
化学研究和应用的目标:用已有的化学知识开发利用自然界的物质资源和能量资源,同时创造新物质(主要是高分子)使人类的生活更方便、舒适。在开发利用资源的同时要注意保护环境、维护生态平衡,走可持续发展的道路;建立“绿色化学”理念:创建源头治理环境污染的生产工艺。(又称“环境无害化学”)
目的:满足当代人的需要又不损害后代发展的需求!
一、金属矿物的开发利用
1、常见金属的冶炼:
①加热分解法:
②加热还原法:
③电解法:
2、金属活动顺序与金属冶炼的关系:
金属活动性序表中,位置越靠后,越容易被还原,用一般的还原方法就能使金属还原;金属的位置越靠前,越难被还原,最活泼金属只能用最强的还原手段来还原。(离子)
二、海水资源的开发利用
1、海水的组成:含八十多种元素。
其中,H、O、Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等总量占99%以上,其余为微量元素;特点是总储量大而浓度小,以无机物或有机物的形式溶解或悬浮在海水中。
总矿物储量约5亿亿吨,有“液体矿山”之称。堆积在陆地上可使地面平均上升153米。
如:金元素的总储量约为5×107吨,而浓度仅为4×10-6g/吨。
另有金属结核约3万亿吨,海底石油1350亿吨,天然气140万亿米3。
2、海水资源的利用:
(1)海水淡化: ①蒸馏法;②电渗析法; ③离子交换法; ④反渗透法等。
(2)海水制盐:利用浓缩、沉淀、过滤、结晶、重结晶等分离方法制备得到各种盐。
三、环境保护与绿色化学
1.环境:
2.环境污染:
环境污染的分类:
? 按环境要素:分大气污染、水体污染、土壤污染
? 按人类活动分:工业环境污染、城市环境污染、农业环境污染
? 按造成污染的性质、来源分:化学污染、生物污染、物理污染(噪声、放射性、热、电磁波等)、固体废物污染、能源污染
3.绿色化学理念(预防优于治理)
核心:利用化学原理从源头上减少和消除工业生产对环境造成的污染。又称为“环境无害化学”、“环境友好化学”、“清洁化学”。
从学科观点看:是化学基础内容的更新。(改变反应历程)
从环境观点看:强调从源头上消除污染。(从一开始就避免污染物的产生)
从经济观点看:它提倡合理利用资源和能源,降低生产成本。(尽可能提高原子利用率)
热点:原子经济性——反应物原子全部转化为最终的期望产物,原子利用率为100%
