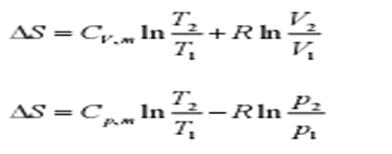第三章 热力学第二定律总结
核心内容:
不可逆或自发
 可逆或平衡
可逆或平衡
不可能
对于恒T、V、Wˊ=0过程:
不可逆或自发
 可逆或平衡
可逆或平衡
反向自发
对于恒T、p、Wˊ=0过程:
不可逆或自发
 可逆或平衡
可逆或平衡
反向自发
主要内容:三种过程(单纯pVT变化、相变、化学反应)W、Q、ΔU、ΔH、△S、△A、△G的计算及过程方向的判断。
一、内容提要
1、热力学第二定律的数学形式
不可逆或自发
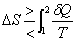 可逆或平衡
可逆或平衡
不可能
上式是判断过程方向的一般熵判据。将系统与环境一起考虑,构成隔离系统则上式变为:
不可逆或自发
 可逆或平衡
可逆或平衡
不可能
上式称为实用熵判据。在应用此判据判断过程的方向时,需同时考虑系统和环境的熵变。
将上式应用于恒T、V、Wˊ=0或恒T、p、Wˊ=0过程有:
不可逆或自发
 可逆或平衡
可逆或平衡
反向自发
此式称为亥姆霍兹函数判据。
不可逆或自发
 可逆或平衡
可逆或平衡
反向自发
此式称为吉布斯函数判据。
熵判据需同时考虑系统和环境,而亥姆霍兹函数判据和吉布斯函数判据只需考虑系统本身。熵判据是万能判据,而亥姆霍兹函数判据和吉布斯函数判据则是条件判据(只有满足下角标条件时才能应用)。
此外,关于亥姆霍兹函数和吉布斯函数,还有如下关系:
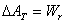
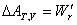

即恒温可逆过程系统的亥姆霍兹函数变化等于过程的可逆功;恒温恒容可逆过程系统的亥姆霍兹函数变化等于过程的可逆非体积功;恒温恒压可逆过程系统的吉布斯函数变化等于过程的可逆非体积功。
下面将△S、△A和△G的计算就三种常见的过程进行展开。
2、三种过程(物质三态pVT变化、相变、化学反应)△S、△A和△G的计算
(1)物质三态(g、l或s态)pVT变化(无相变、无化学反应)
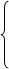
 恒容时:
恒容时: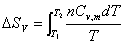
只有当
恒压时: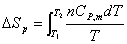
对于凝聚态物质的任意过程,由于熵随压力或体积的变化率很小,因此有:
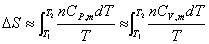
对于气态物质的任意过程,由于熵随压力或体积的变化率不可忽略,而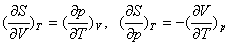 (麦克斯韦关系式),因此有:
(麦克斯韦关系式),因此有:

或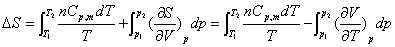
其中 及
及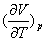 可由气体的实际状态方程或实验数据求得。
可由气体的实际状态方程或实验数据求得。
对于理想气体的任意过程,可以通过可逆途径计算其△S:
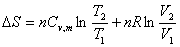

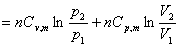
这就是计算理想气体任意过程△S的万能公式。当过程恒容,恒压或恒温时,公式相应有更为简单的形式。
对于任意物态,△A和△G可根据A和G的定义式进行计算
△A=△U-△(TS) △G=△H-△(TS)
亦可根据A和G的热力学基本方程进行计算
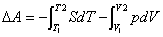
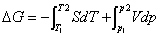
(2)相变
相变分为可逆相变和不可逆相变两大类。由于熵变只等于可逆过程的热温熵,因此对于可逆相变,熵变可以通过相变过程的热温商直接进行计算。而对于不可逆相变。熵变必须通过设计可逆途径进行计算,即利用可逆相变数据以及熵是状态函数的性质进行计算。这也就是第一章中曾提到的状态函数法。
①可逆相变:在两相平衡温度和压力下的相变为可逆相变。相变一般为恒温恒压过程,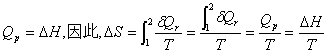
②不可逆相变:不是在两相平衡温度或压力下的相变为不可逆相变。为了计算不可逆相变过程的熵变,通常设计一条包含有可逆相变步骤在内的可逆途径,而在具体设计可逆途径时,又分为如下两种情形:
a、 改变相变温度:
 T2,p下的相变:
T2,p下的相变:

 ΔS(T
2)
ΔS(T
2)
ΔS2
T1,p下的相变:
ΔS(T1)
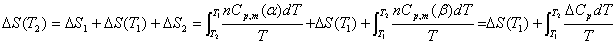
其中
b、改变相变压力:
 T,p2下的相变:
T,p2下的相变:

 ΔS(p
2)
ΔS(p
2)
ΔS2
T,p1下的相变: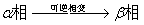
ΔS(p1)
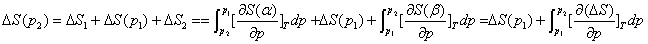 其中
其中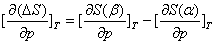
由麦克斯韦关系式可知, 。对于凝聚态物质,由于
。对于凝聚态物质,由于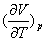 很小,可以忽略不计,因此
很小,可以忽略不计,因此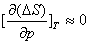 。而对于气态物质,
。而对于气态物质,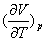 较为可观。对于理想气体,
较为可观。对于理想气体,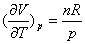 。对于实际气体,可由实际气体的状态方程或实验数据求得
。对于实际气体,可由实际气体的状态方程或实验数据求得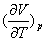 。
。
在实际计算不可逆相变过程的熵变时,究竟选择以上a、b两种方法中的何者,应视题给已知条件进行决定。
相变过程的△A和△G仍利用A和G的定义式进行计算,但不可利用热力学基本方程进行计算,因为后者只适用于单纯pVT变化,而不适用于相变和化学反应。
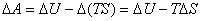
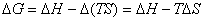
(3)化学反应
对于化学反应aA+bB=lL+mM或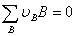 ,可以通过反应物和产物的标准摩尔熵计算其标准摩尔反应熵:
,可以通过反应物和产物的标准摩尔熵计算其标准摩尔反应熵:
又由反应物和产物的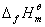 或
或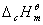 求得反应的
求得反应的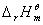 (T),则反应的
(T),则反应的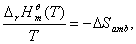 所以
所以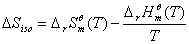 。
。
标准摩尔反应熵随反应温度的变化关系为:
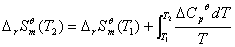
其中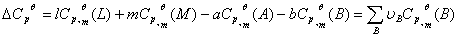
化学反应过程△A和△G的计算公式如下:
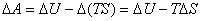
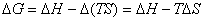
此外,化学反应过程的△G还可由反应物和产物的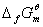 或电池电动势E求得。
或电池电动势E求得。
3、热力学基本方程
对于封闭系统的单纯pVT变化过程:
dU=TdS-pdV dH=TdS+Vdp dA=-SdT-pdV dG=-SdT+Vdp
以上四式称为热力学基本方程。
4、热力学状态函数间的重要关系式及吉布斯——亥姆霍兹方程
从热力学基本方程出发,应用数学原理可以得出热力学状态函数之间的重要关系式:
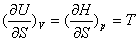

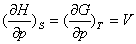
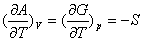
吉布斯——亥姆霍兹方程:
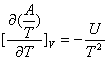 ,
, 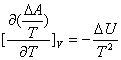
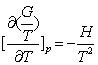 ,
, 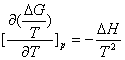
5、麦克斯韦关系式
数学上,若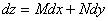 ,则
,则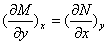 。对比热力学基本方程,有:
。对比热力学基本方程,有: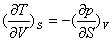
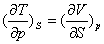
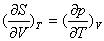

以上四式称为麦克斯韦关系式。
6、其它重要关系式
(1) 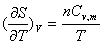
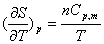
(2)对于任意三个其中两两彼此独立的状态函数x、y、z, 都有如下循环关系:
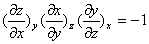
(3)设有状态函数x、y、z, z=z(x,y), 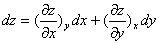 ,则有:
,则有:
①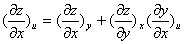 ,其中u为第四个状态函数
,其中u为第四个状态函数
②
③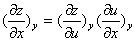 其中u为第四个状态函数
其中u为第四个状态函数
④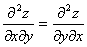 即
即 (尤拉关系式),麦克斯韦关系式即是此式的具体形式。
(尤拉关系式),麦克斯韦关系式即是此式的具体形式。
以上这此关系式,在热力学演绎(公式证明)中经常用到。
7、克拉佩龙方程和克劳修斯——克拉佩龙方程
应用热力学基本方程和热力学原理,可导出纯物质两相平衡时压力和温度之间的函数关系。
(1)克拉佩龙方程
纯物质任意两相平衡时: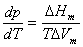 ,式中
,式中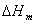 为摩尔相变焓,
为摩尔相变焓,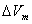 为摩尔相变体积差。
为摩尔相变体积差。
积分得: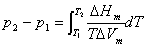
(2)克劳修斯——克拉佩龙方程
纯物质有气相存在两相平衡时: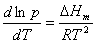
积分得: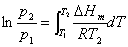
第二篇:物理化学热力学第二定律总结
热力学第二定律
1.热力学第二定律:通过热功转换的限制来研究过程进行的方向和限度。
2.热力学第二定律文字表述:第二类永动机是不可能造成的。(从单一热源吸热使之完全变为功而不留下任何影响。)
3.热力学第二定律的本质:一切自发过程,总的结果都是向混乱度增加的方向进行(a.热与功转换的不可逆性; b.气体混合过程的不可逆性; c.热传导过程的不可逆性)
4.热力学第二定律的数学表达式:Clausius 不等式
5.卡诺循环→热机效率(即:热转化为功的限度有多大?)→卡诺定理(所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆机的效率最大。)→从卡诺循环得到结论:热效应与温度商值的加和等于零。→任意可逆循环热温商的加和等于零→熵的引出→熵的变化值可用可逆过程的热温商值来衡量→Clausius 不等式: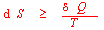 →熵增加原理(熵增加原理)→把与体系密切相关的环境也包括在一起,用来判断过程的自发性(?Siso=?S(体系)+?S(环境)≥0):“>” 号为自发过程;“=” 号为可逆过程)
→熵增加原理(熵增加原理)→把与体系密切相关的环境也包括在一起,用来判断过程的自发性(?Siso=?S(体系)+?S(环境)≥0):“>” 号为自发过程;“=” 号为可逆过程)
 6.等温过程的熵变:(1)理想气体等温变化:?S=nRln(V2/V1)=nRln(P1/P2);(2)等温等压可逆相变(若是不可逆相变,应设计可逆过程): ?S(相变)=?H(相变)/T(相变);(3)理想气体(或理想溶液)的等温混合过程:?S=-R∑nBlnxB
6.等温过程的熵变:(1)理想气体等温变化:?S=nRln(V2/V1)=nRln(P1/P2);(2)等温等压可逆相变(若是不可逆相变,应设计可逆过程): ?S(相变)=?H(相变)/T(相变);(3)理想气体(或理想溶液)的等温混合过程:?S=-R∑nBlnxB
7.变温过程的熵变:(1)等容变温:
 (2)等压变温:
(2)等压变温:
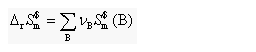
 (3)化学过程的熵变:
(3)化学过程的熵变:
8.标准压力下,求反应温度T时的熵变值:
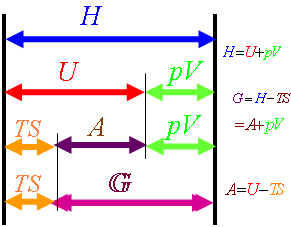
9.用熵作为判据时,体系必须是孤立体系,也就是说必须同时考虑体系和环境的熵变,这很不方便→有必要引入新的热力学函数,利用体系自身状态函数的变化,来判断自发变化的方向和限度。因此引入新的函数:亥姆霍兹函数A=U-TS与吉布斯函数G=H-TS。
10.等温、可逆过程中,体系对外所作的最大功等于体系亥姆霍兹函数的减少值;自发变化总是朝着亥姆霍兹函数减少的方向进行。
等温、等压、可逆过程中,体系对外所作的最大非膨胀功等于体系吉布斯函数的减少值;自发变化总是朝着吉布斯函数减少的方向进行。
11.牢记:几个函数的定义式
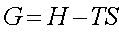
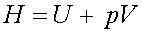

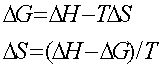
12.四个基本公式:




13.从基本公式导出的关系式:
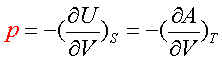
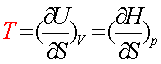
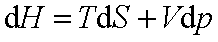
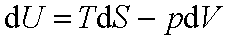
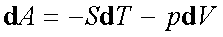
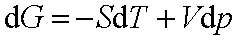

14.Maxwell 关系式:

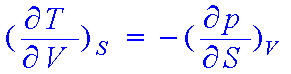
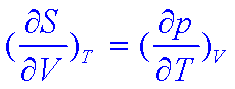
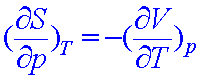
15.Maxwell 关系式的应用
求U随V的变化关系;如:证明理想气体的热力学能只是温度的函数。
求H 随 p 的变化关系;如:证明理想气体的焓只是温度的函数。
 16.DG的计算: (1)等温、等压可逆相变的DG=0;(2)等温下,体系从P1,V1改变到P2,V2,设Wf=0,
16.DG的计算: (1)等温、等压可逆相变的DG=0;(2)等温下,体系从P1,V1改变到P2,V2,设Wf=0,
适用于任何物质
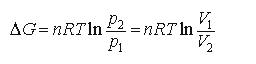
对理想气体:
对一等温等压下的化学反应:DG=DH-DS,因此可由DH和DS求算DG.
17.Gibbs-Helmholtz方程:表示?rG和?rA与温度的关系式都称为Gibbs-Helmholtz方程,用来从一个反应温度的?rG(T1)(或?rA(T1))求另一反应温度时的?rG (T2) (或?rA(T2))。它们有多种表示形式。
习题
1 定温下水与NaCl水溶液混合,此过程是一个不可逆过程,如何将此过程变为可逆过程?
2 1 mol 单原子理想气体始态为 273 K,101325 Pa,分别经历下列可逆变化
(1) 定温下压力加倍。
(2) 定压下体积加倍。
(3) 定容下压力加倍。
(4) 绝热可逆膨胀至压力减少一半。
(5) 绝热不可逆反抗恒外压 0.5×101325 Pa 膨胀至平衡。
试计算上述各过程的 Q,W,△U,△H,△S,△G,△A(已知 273 K,101325 Pa 下
该气体的摩尔熵为 100 J/mol ·K 。)
3 试证明 1 mol 理想气体在任意过程中的熵变均可用下列公式计算