 仲恺农业工程学院
仲恺农业工程学院

论文题目: 热力学的第二定律的认识和思考
论文作者: 钟家业
作者学号:
所在院系: 机电工程学院
专业班级:
指导老师:
摘要 热力学第二定律是热力学的基本定律之一,是指热永远都只能由热处转到冷处(在自然状态下)。它是关于在有限空间和时间内,一切和热运动有关的物理、化学过程具有不可逆性的经验总结。广义生命演化意义上的熵,体现了生命系统衰落的过程。
关键词 热力学第二定律,第二类永动机,熵,时间,生活
1. 热力学第二定律及发展
1.1、热力学第二定律建立的历史过程
19世纪初,人们对蒸汽机的理论研究还是非常缺乏的。热力学第二定律就是在研究如何提高热机效率问题的推动下,逐步被发现的,并用于解决与热现象有关的过程进行方向的问题。1824年,法国陆军工程师卡诺在他发表的论文“论火的动力”中提出了著名的“卡诺定理”,找到了提高热机效率的根本途径。从1840年到1847年间,在迈尔、焦耳、亥姆霍兹等人的努力下,热力学第一定律以及更普遍的能量守恒定律建立起来了。1848年,开尔文爵士(威廉·汤姆生)根据卡诺定理,建立了热力学温标(绝对温标)。这些为热力学第二定律的建立准备了条件。 1850年,克劳修斯从“热动说”出发重新审查了卡诺的工作,考虑到热传导总是自发地将热量从高温物体传给低温物体这一事实,得出了热力学第二定律的初次表述。后来历经多次简练和修改,逐渐演变为现行物理教科书中公认的“克劳修斯表述”。与此同时,开尔文也独立地从卡诺的工作中得出了热力学第二定律的另一种表述,后来演变为更精炼的现行物理教科书中公认的“开尔文表述”。上述对热力学第二定律的两种表述是等价的,由一种表述的正确性完全可以推导出另一种表述的正确性。他们都是指明了自然界宏观过程的方向性,或不可逆性。克劳修斯的说法是从热传递方向上说的,即热量只能自发地从高温物体传向低温物体,而不可能从低温物体传向高温物体而不引起其他变化。利用致冷机就可以把热量从低温物体传向高温物体,但是外界必须做功。开尔文的说法则是从热功转化方面去说的。功完全转化为热,即机械能完全转化为内能可以的,在水平地面上运动的木块由于摩擦生热而最终停不来就是一个例子。但反过来,从单一热源吸取热量完全转化成有用功而不引起其他影响则是不可能的。[1]
1.2、热力学第二定律的表述
1.2.1、热力学第二定律的开尔文表述

不可能从单一热源吸取热量, 使之完全变为有用的功而不产生其他影响。这是按照机械能与内能转化过程的方向性来表述的。表述中的“单一热源”是指温度均匀并且恒定不变的热源。若热源不是单一热源,则工作物质就可以从热源中温度较高的一部分吸热而向热源中温度较低的另一部分放热, 这实际上相当于两个热源。“其他影响”是指除了单一热源所吸收的热用来作功以外的任何其他变化. 当有其他影响产生时 ,把由单一热源吸来的热量全部用来对外作功是可能的。开尔文表述还可表达为:第二种永动机是不可能造成的。所谓第二种永动机就是一种违反开尔文表述的机器,它能从单一热源吸收热量,使之完全变为有用的功而不产生其他影响, 但这种机器不违反能量转化与守恒定律。如果这种热机能够制成,那么就可以利用空气或海洋作为热源,从它们那里不断吸取热量而做功。果真如此,令人头痛的能源问题也就解决了,因为海洋的内能几乎是取之不尽的。
1.2.2 热力学第二定律的克劳修斯表述
不可能把热量从低温物体传到高温物体而不引起其他变化。这是按照热传导的方向性表述的。可以证明, 热力学第二定律的开尔文表述和克劳修斯表述是等效的。热力学第二定律是总结概括了大量事实而提出的,由热力学第二定律作出的推论都与实验结果符合,从而证明了这一定律的正确性。经验告诉我们, 功可以完全转变为热,而热力学第二定律指出,要把热完全变为功而不产生其他影响则是不可能的。但这一结论由热力学第一定律是得不到的,因为无论功变热或热变功都不违反热力学第一定律。经验还告诉我们 ,当两个温度不同的物体互相接触时,热量由高温物体向低温物体传递。但是热力学第二定律的克劳修斯表述指出,热量不可能自发地由低温向高温传递。而这一结论也是不能从热力学第一定律得到的,因为这个过程也不违反热力学第一定律。由此看出 ,热力学第二定律是独立于热力学第一定律的新规律 ,是一个能够反映过程进行方向的规律。热力学第二定律说明物体的内能不能完全地(在不产生其他影响下)转变为功,相反,功却可以完全地转变为物体的内能。因此,功转化为内能的过程带有单向性,是不可逆的。在自然界中存在着大量的不可逆现象,例如,热量从高温物体自发地传向低温物体 ,气体自发地向真空膨胀, 两种气体自发混合( 互扩散) 等 . 显然热力学第二定律隐含地指出了其他不可逆过程的单向性。所以 ,热力学第二定律是所有单向变化过程的一般规律。
下面我们从反面来说明这两种说法的确是等价的:
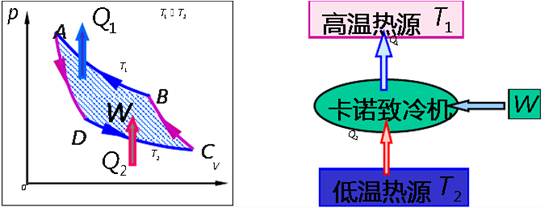
①如果我们否定克劳修斯的说法,认为热量可以自发地从低温物体B传向高温物体A,见图4-1(a)的示意图,设这个热量为Q,我们再设想有一个卡诺热机,从高温热源A吸取热量Q,一部分转化为有用功W,另一部分Q′传给了低温热源B,这样的整个过程中,高温热源A没有发生变化,相当于只从低温热源B吸收了(Q-Q′)的热量而全部转化为有用功,而不产生其他影响,从而开尔文的说法也就被否定了。
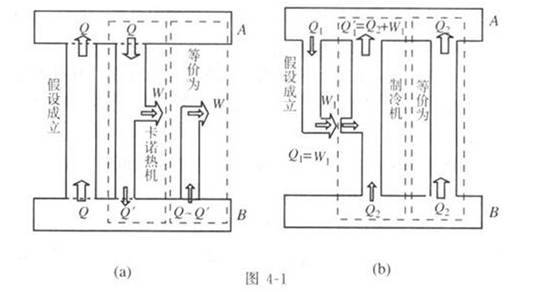
②反过来,如果我们否定了开尔文的说法,认为可以从单一热源A吸取热量,全部转化为有用功而不产生其他影响,见图4-1(b)的示意图,设这部分热量为Q1,做的有用功为W1(Q1-W1),我们再设想这部分有用功是带动一个理想的致冷机工作,它从另一个低温热源B处吸收热量Q2,向热源A放出热量Q1′,则满足Q1′=Q2+W1,而Q1=W1,所以Q1′=Q2+Q1。这样,总的效果相当于从低温热源B处吸收了热量Q。,向高温热源A放出的热量Q1′,在补偿了Q1以后,正好也是Q2,这就等于热量Q。自发地从低温热源B传向了高温热源地并没有发生其他变化,这就否定了克劳修斯的说法。
1.2.3 热力学第二定律的普遍表述
1865年,克劳修斯引进“熵”的概念来反映这种运动变化的过程和方向, 从而可以从数学上严格地表述热力学第二定律。“熵”一词来源于希腊语 entropia, 原意是转换 ,中文意思是热量被绝对温度除所得的商。克劳修斯指出,在一个孤立系统(或叫封闭系统)内, 熵的变化总是大于或等于零, 也就是说,孤立系统的运动变化总是要沿着使熵增大的方向进行, 最后的平衡状态则对应于熵的最大可能值。于是热力学第二定律的最普遍表述为:可以找到这样一个态函数——熵 ,它在可逆过程中的变化等于系统所吸收的热量与热源的绝对温度之比;在不可逆过程中, 这个比值小于熵的变化。即对于无穷小的过程 ,有
 (1)
(1)
结合热力学第一定律得
 ( 2)
( 2)
在( 2) 式中 , 等号对应于可逆过程, 不等号对应于不可逆过程。这个式子是热力学理论的基本方程。假设过程是绝热的, 即 dQ=0,则由( 1) 式得到
 ( 3)
( 3)
由此可见, 在绝热过程中, 系统的熵永不减少。对于可逆绝热过程, 系统的熵不变; 对于不可逆绝热过程,系统的熵总是增加,这个结论叫做熵增加原理。根据熵增加原理 ,任何自发的不可逆过程 ,只能向熵增加的方向进行,于是熵函数给予了判断不可逆方向的共同准则. 既然从非平衡态到平衡态的过程中,熵总是增加,那么系统越接近平衡态,其熵值就越大,所以熵的数值就表征系统接近稳定平衡态的程度。
1.3、热力学第二定律的适用范围
1.3.1 经典热力学第二定律及其适用范围
热力学第二定律是十九世纪中叶由W·汤坶孙(开尔文爵士)和克劳修斯在研究卡诺的热机理论和热功转换问题时提出来的。他们分别提出了自己的表述,并证明了这两种表述是等价的。后来,普朗克等人还提出了一些表述,同样也进行了等价性证明。热力学第二定律的这种表述的多样性与物理学的有些定律不一样。它是以一个实际过程的不可逆性来表述一个普遍的自然规律。即自然界的一切实际过程自发进行都沿一定的方向(具有单向性)。或者说一切实际过程都具有不可逆性。
两种经典表述都提到的“不产生其它影响”的条件及前面所说的“自发进行”意眯着:所研究的实际过程是在孤立系中进行的,孤立系中这些过程具有单向性。克劳修斯经过十多年的努力,终于找到了热力学第二定律的数学表述,这就是著名的熵增原理 :孤立系的熵永不减少。(若Q=0,刚△s≥0 )
由于孤立系的熵只能增加,即系统只能沿退化的方向进行。这与自然界和人类社会的实
际演化过程相矛盾。因而热力学第二定律自然不适用于生命现象和社会现象这样一些不断进化的领域 。
克劳修斯等人将热力学第二定律外推到宇宙,得出了 “宇宙的熵趋于一个极大值”的命题。这就是著名的“热寂说”,即全宇宙最终将达到热平衡。长期以来,人们一直认为字宙是静态的,在时间上无始无终,似乎早该处于热寂了。而实际情况正好相反。这自然遭到了当时许多著名的科学家和哲学家的批判。其中一个重要的论点是:热力学第二定律是在有限的宏现系统中得出的规律,不能外推到无限宇宙。因而,长期以来都认为热力学第二定律不适用于宇观系统。这一论点现在还在大多数教科书与文献中出现。
1.3.2 “宇宙膨胀”模型与“热寂”佯谬的消除
“ 热寂说 ”以及对它的批判,都是建立在当时人们对宇宙的认识基础上的。对它的批判总使人感到说服力不强。例如有限条件下得到的结论,就同样有外推成功的先例。热力学第一定律的外推,得出的宇宙的能量守恒就被认为是正确的。上世纪二十年代,以美国天文学家哈勃观察到的星系红移现象为基础而建立起来的大爆炸宇宙学使我们认识到,我们所能观察到的宇宙并不是静态的,而是在不断膨胀。在此基础上,七十年代以后,人们又重新对热寂说进行了考察,发现随着宇宙的膨胀,由于粒子与辐射的温度随膨胀的线度的变化规律不同,即使宇宙最初处于温度均匀的热平衡状态,也会随着膨胀而出现温差,从无序向有序变化,而不会热寂。另一方面,如果宇宙是静态的,则对每一个静态体系总有一个最大熵。而对膨胀的宇宙 ,每一瞬时对可能达到的最大熵也是不断增加的。只要膨胀得足够快,宇宙实际的熵与最大熵的差异就会越来越大,宇宙离热寂也会越来越远。而不管宇宙是否是有限的和孤立的。这样 “热寂佯谬”就以这出入意料的方式迎刃而解了。人们这才发现,“热寂说”的问题是出在人类对宇宙的认识上,而不是出在热力学第二定律的外推上。这样一来,热力学第二定律不适用于宇观系统的限制也就自然解除了。1972年霍金证明黑洞过程的不可逆性和贝肯斯坦引入黑洞熵, 建立黑洞热力学,正是热力学第二定律在宇观系统成功运用的范例。
1.3.3 微观系统同样存在不可逆性
如前所述,我们知道热力学第二定律是研究不可逆这一自然现象的科学规律。经典热力学研究的是固体、液体、气体等由大量微观独子(原子、分子、离子) 组成的宏观系统的性质及其变化规律的学问。而不可逆性正是这些系统的共性,是大量粒子的集体行为。但是,自然界是分层次的,宏观和微观也是相对的。在每一个层次上的系统都可以认为是由下一个层次的大量子系统所组成。因而不可逆性不应该只存在于某一个特殊的层次中。例如,一个生物群体可以看成是由大量的生物个体组成的系统,一个生物个体也可以看成是由大量的细胞组成的系统,而细胞同样可以看成是由大量的生物分子所组成的系统。在这些不同的层次上,不可逆性都同样存在细胞的不断老化;个体的生老病死;群体的演化发展。现在我们都可以用由热二律发展起来的耗散结构理论来对它们进行研究。同样,我们知道:原子、分子等微观粒子也存在着内部的层次和结构。而且我们还知道许多原子存在着放射性衰变现象。1968年美国的菲奇和克罗宁在K介子衰变实验中也发现了时间对称性的破坏。 大统一理论还预言,像质子这样的基本粒子也可能是不稳定的,只不过其衰变周期非常长而已。这些都表明:不可逆性同样也存在于微观领域。所以,笔者认为,热力学第二定律既然是用来描写不可逆性这一广泛存在的自然现象的统一规律,就应该可以用来研究微观领域的不可逆性。当然,将热力学第二定律向微观领域的拓展还有待人们的进一步努力。
2热力学第二定律的一些应用
2.1 对时间的理解
我们知道, 热力学第二定律是所有单向变化过程的一般规律,而时间的变化是一个单向的不可逆过程,因此可以说:时间的方向,就是熵增加的方向。这样,热力学第二定律就给出了时间箭头。进一步研究表明,能量守恒与时间的均匀性有关,这就是说,热力学第一定律告诉我们,时间是均匀流逝的。这两条定律合在一起告诉我们:时间在向着特定的方向均匀地流逝着。
2.2黑洞热辐射的发现
1972年,英国物理学家霍金( S. Hawking ,1942-) ,提出了黑洞的“面积定理”。证明了黑洞的面积随时间的变化只能增加,不能减少,即δA≥0(式中A为黑洞面积)。这不由使人想起热力学中的“熵”。但黑洞面积与熵是风马牛不相及的两个概念, 把它们联系起来是不是太荒唐了呢?几乎与此同时, 物理学家贝根斯坦和斯马尔 ,各自独立地得出了关于黑洞的一个重要公式。即
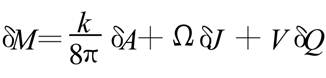
式中 M 、J 、Q 分别是黑洞的总质量、总角动量 、总电荷; A 、Ψ、V 分别是黑洞的表面积、转动角速度和表面上的静电势,k称为黑洞的表面重力加速度。此式与热
力学第一定律表达式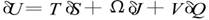 非常相似。式中U、T、S分别是系统的内能、温度和熵 ; Ω、J 、V、Q 等物理意义与前式类似。不难看出, 黑洞面积A确实像熵S ,而黑洞的表面重力加速度k非常像温度T。难道黑洞真的有温度吗?为此人们进行了热烈的争论。1973年霍金、巴丁、卡特等卓有成就的黑洞专家联名发表了一篇论文 ,声称:可以模仿热力学定律给出黑洞力学的定律,但黑洞的温度不能看作真实温度,因为黑洞没有辐射(不可能有任何物质跑出黑洞!)。但是,几个月后霍金就宣称 ,他已证明 ,黑洞有热辐射 ,黑洞的温度是真实的, 其值为
非常相似。式中U、T、S分别是系统的内能、温度和熵 ; Ω、J 、V、Q 等物理意义与前式类似。不难看出, 黑洞面积A确实像熵S ,而黑洞的表面重力加速度k非常像温度T。难道黑洞真的有温度吗?为此人们进行了热烈的争论。1973年霍金、巴丁、卡特等卓有成就的黑洞专家联名发表了一篇论文 ,声称:可以模仿热力学定律给出黑洞力学的定律,但黑洞的温度不能看作真实温度,因为黑洞没有辐射(不可能有任何物质跑出黑洞!)。但是,几个月后霍金就宣称 ,他已证明 ,黑洞有热辐射 ,黑洞的温度是真实的, 其值为
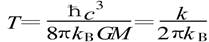
式中 kB是玻尔兹曼常数。对于一个 M =M s(太阳质量)的黑洞, T = 6×10 -8 K ,可以忽略不计;而对于一个质量为 10亿吨的小黑洞, 温度可达 10 12 K。黑洞热辐射的发现 ,是黑洞研究的重大突破,也是时空理论的重大突破。
2. 3 耗散结构理论的形成
比利时著名物理学家普利高津( I . Prigogine , 1917- )认为热力学第二定律是自然界的一条基本规律。他在不违背热力学第二定律的条件下, 找到了开放系统由无序状态变为新的有序状态的途径。他指出 ,开放系统的熵变为dS =dS i + dSe ,其中 dSi为熵产生,由系统内部不可逆过程产生;dSe为熵流, 由系统与外界交换能量或物质所引起。熵产生dSi永远不可能为负值 ,而熵流dSe则可正可负还可为零。由于外界有负熵流入,系统的总熵可以保持不变乃至减小, 系统保持稳定或者达到有序,形成“耗散结构”。他认为,宇宙是一个无限发展的开放系统, 自然界不会变得越来越无序, 而会变得越来越丰富多采 ,会形成各种新的有序结构, 宇宙不可能处于“热寂”。从目前天文观测的事实来看, 宇宙确实不是向着热寂发展, 而是离开热平衡态越来越远。
3 热力学第二定律的统计意义[3]
3.1 系统的宏观态与微观态
宏观态---热力学状态
宏观: 微观粒子不可分辨,以分子数目来区分状态
.微观态---大量分子系统的力学运动状态(ri,vi)
微观: 可区分具体的分子.
·宏观态与微观态是系统同一状态的两种描述方法
. ·宏观概率/热力学概率Ω: 每一宏观态所包含的可实现的微观态的数目
例: abcd四个分子在容器的分布

3.2自由膨胀
(N: 总分子数)
N=1:
退回到左边的概率是1/2
N=2: a,b 两个分子

退回到左边的概率是1/4
N=3: a,b,c三个分子

退回到左边的概率是1/8
N=4: a,b,c,d 四个分子

退回到左边的概率是1/16
N ~NA=6.02×1023 ,退回到左边的概率是
概率太小, 不可能实现.
微观状态: 按具体分子来分
宏观状态: 按分子个数来分
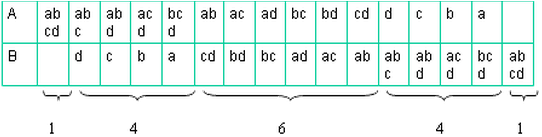
微观状态数: 16
宏观状态数: 5
l 随着分子数N的增加,分子在A、B两室平均分配的宏观状态所包含的微观状态数目越来越多 ?
l 当N ~NA=6.02×1023时,分子在AB两室平均分配的宏观状态所包含的
微观状态数目/总的微观状态数目~100% [2]
3.3 热力学第二定律的统计表述
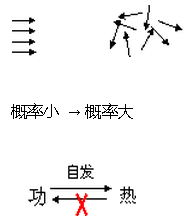
自由膨胀的方向: 概率小的宏观状态 →概率大的宏观状态
包含微观状态数目少的宏观状态→包含微观状态数目多的宏观状态
热力学第二定律的统计意义: 一个不受外界影响的封闭系统, 其内部发生的过程总是由概率小的宏观状态向概率大的宏观状态进行, 由包含微观状态数目少的宏观状态向包含微观状态数目多的宏观状态进行
. 热功转换:
功 → 热
分子有规则定向运动 → 分子无规则运动
适用范围
:
(1) 只适用于包含有大量分子的热力学系统, 对少量分子组成的系统是不适用的.
(2) 只适用于有限空间的封闭系统.
3.4熵与宏观概率Ω------ 玻耳兹曼公式
S=klnΩ
其中 k---玻耳兹曼常数 Ω---宏观状态所包含的微观状态数目
例.1mol理想气体自由膨胀的熵变
. 
推导:
热力学角度: 非平衡态→平衡态
S小 → S大
统计角度: 概率Ω小→概率Ω大
S = f(Ω)
S=S1+S2=f(Ω1)+ f(Ω2)
S = f(Ω)= f(Ω1·Ω2)
∴f(Ω1·Ω2)=f(Ω1)+ f(Ω2)
数学上可以推出: S = f(Ω)∝lnΩ
S = klnΩ
3.5 与无序度的关系
无序度---混乱程度
无序度低 (有序度高), 则概率小→S 小
无序度高 (有序度低), 则概率大→S 大
自然过程:概率小→概率大 S小 → S大
例: 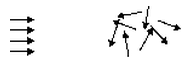
有规则定向运动 → 无规则运动
3.6 熵函数的微观意义(与熵增原理的关系)[4]

(1) 熵与宏观状态所包含的微观状态数目相联系
(2) 熵是(宏观态所对应的大量微观粒子热运动所引起的)无序程度的定量量度.
(3) 熵增的方向即向微观状态数多的宏观状态转变的方向, 使系统更混乱, 更无序
4 热力学第二定律的思考
4.1热力学第二定律与时间反演性
时间T到-T的变换叫做时间反演,这相当于时间倒流,在力学中保守系具有时间反演性,而“耗散系”不具有时间反演性。“耗散”是 一个宏观的概念,几乎所有的微观过程都是可逆的,而从微观过度到宏观过程就可能变为不可逆的过程。在“耗散”系中能量的转变设计热力学过程,相当于从宏观看来具有整体的能量转化为杂乱无章的分子热运动动能和分子势能。而在“保守系”中能量没有转化为杂乱无章的热运动动能和势能,只在动能和势能之间转化。
4.2理解时间的流逝
热力学第二定律是自然界所有单方向变化过程的共同规律,而时间的变化就是一个单向的不可逆的过程,因此可以这样假设:时间的运动方向,就是熵增加的方向。由此,热力学第二定律就给出了一个时间箭头,通过进一步研究表明,能量守恒与时间的均匀性有关,即热力学第一定律告诉我们,时间是均匀流逝的。这两条定律合在一起就是:时间在向着特定的方向均匀地流逝着。
4.3 在信息熵中的应用
人类在长期的电讯通信实践中,不断在力图提高通信的有效性和可靠性。提高有效性就是尽可能用最窄的频带,尽可能快和尽可能降低能耗,即提高通信的经济性;高可靠性,就是要力图消除或减少噪音,以提高通信的质量。随着电子通信发展到一定阶段后,人们在实践中发现,在一定的条件下,要同时实现上述这两个要求,会遇到不可克服的困难:要减少噪音的干扰,信息传输速率就得降低;反之,提高了传输速率就不能有效地避免噪扰,在一定的具体的客观条件下,想要同时提高电讯通信的效率和可靠性的企图总是失败的。于是有人想到在限定的条件下同时提高通信的效率和可靠性的要求可能存在一种理论上的界限。1948年,美国贝尔电讯实验所的工程师申农提出了了一个数学模型,对于信息的产生和传输这些概念从量的方面给以定义,提出了信道和信息量等概念,利用熵的形成导入了信道容量这一新的重要概念,并且确定了信号频带宽度、超扰值和信道传输率三者之间的一般关系。从而,我们可以用信息熵来描述信道上传输信息的容量。这就是热力学第二定律在信息传输技术中的一些应用。[2] [5]
4.4 与生命活动的联系
在生命自然演化的意义上,熵概念的本质是生命系统(机体)创造机能下降,熵增的过程是生命系统自衰落至死亡的老化过程。如果我们以单一的生命体作为一个系统,那它是一个开放系统,与环境既有物质交换,也有能量的流通;基于此,而生命体可以进行众多的生命活动,而这又是为了摄取“负熵”——或者认为是通过外界的能量来减少生命体本身的熵,就如同一个热机与另外的热库进行热交换使这个系统恢复到原始状态。如果这么看似乎无法满足熵增原理中条件“孤立系统”,但是,每个生命体都必须维持自己生命活动的稳定性状态,也就是生命学中的“稳态”,而这个状态则必然与整个环境相不同,因此当我们粗略的看待一个生态系统时,可以将这个生命体当作“孤立系统中的一份子”。
从物质能量流动的角度讲,生命过程是一个物质能量的传输和集中过程,物质能量的集中就是生物的生长。当生物不再生长时,生物的生存过程就是纯粹的物质能量传输过程。从热力学的角度讲,生命过程可以认为是一个符合热力学第二定律的区域性的自发的熵减过程,在包括生命体及其生存环境的总系统中,熵是增加的。熵减过程就是生物的生长过程。当熵减过程结束后,维持已有的负熵值的过程就是生物的生存过程。为了生产负熵,更为了维持已有的负熵值,系统必须始终存在一个熵增的物质能量传输过程。新陈代谢过程中,除了包含有一个熵减的物质能量集中过程外,还包含了一个使生物生长不违反第二定律的熵增的物质能量的传输过程。显然,只有当生命系统是一个与外界有物质和能量交换的开放系统时,符合第二定律的熵减过程才有可能发生。下面我们简单地通过生命体生存发展的几个过程加以阐述:
(一)生 从一个受精卵开始,生命体拥有了一个属于自己的系统,这个系统独立于所生活的自然,而生命的一个必然进程就是“抵抗熵增”——为了避免死亡而摄取“负熵”。
(二)老 薛定谔在他著名的《生命是什么》一书中,认为生命体是“以负熵为生的”。生命体为了维持它的有序结构,必须“吃进负熵”,耗散结构理论的创始人普里高津也认为,系统的熵由系统自身不断产生的正熵和外界流入系统的熵两部分组成。因此,要维持一个有序的、具有负熵值的系统,则必须由外界不断的向系统输入负熵。正是指这个道理,衰老是一个长期的持续性的过程,为了对抗这个过程,吸取负熵是其途径,不同的生命体吸取负熵的方法不同,对于绿色植物则通过光合作用来减少自身的熵,而对于动物(当然包括人类)来说,食物就是负熵,这就是我们需要不断进食的原因所在。之所以食物是负熵,其实更准确的说法是将食物中的能量用于减少生命体自身的熵,类似于一个热机与另外的热库进行热交换使这个系统恢复到原始状态这个过程。实际上,进食摄取能量进而回归机体稳态就是生命的主要意义。 但是摄入负熵的能力会随着时间而减弱,当人类摄入的负熵少到体内的平衡受到破坏时,体内的熵达到了一个限度时人的生命也就要终结了。而这之前“摄入负熵能力下降”的过程就是衰老。
(三)死 生命的结局是什么?对于这个问题,很简单,就是死亡,也可说是同化,尘归尘,土归土,将生命中的物质,能量回归系统,与系统同化,而物理学中指出,这种想对于独立的混合具有更大的混乱度,其所拥有的熵也是最大的,这是整个系统遵循热力学第二定律的必然结果,所以“死亡”、“同化”、“熵增”是必须的,不可违抗的,生命的活动是一个不可逆的过程,因为这个系统必须遵循热力学中熵增的规律。
5 总结
我们把自然生命系统和工程热力系统演化的熵称为“机体熵”或“机能熵”,也可以称为“系统熵”。这是真正意义上的熵,具有广义生命演化意义上的熵,体现了生命系统衰落的过程。通过上述的讨论,我们已经感觉到,生命现象的物理学解释,或者更具体的讲,生命现象的热力学解释,生命现象的物质能量流动解释,已使我们可以在一定程度上理解和把握生命的本质,显然,上述的关于生命现象的物理解释,才仅仅是一个开端,许多问题还没有说明,本文试图从物理学的角度、从物质能量流动的角度对生命现象给出一些解释。但就我目前所掌握的物理学方面的知识而言,还无法就上述所有问题给出明确的解释。因此,本文只能给出一些粗浅的解释,但也是基本的解释,我想,热力学第二定律的意义已经远远超出了热力学的范围,用热力学第二定律解释生命活动的本质则是一个非常有趣的过程,不仅加深了对这条定律的理解,同时也让人看到了科学的美。如果能沿着这样一个思路深入挖掘,必将会对生命体生存发展有更深入的理解,这一议题对于人类社会的发展也将产生非常重要的影响。
参考文献:
1、《物理学史》. 郭奕玲, 沈慧君. 北京: 清华大学出版社, 1993.
2、《改变世界的物理学》. 倪光炯等著. 上海: 复旦大学出版社, 1999
3、《热力学与统计物理学》,龚昌德编,高等教育出版社,1984年版。
4、《热学》李椿、章立源、钱尚武编,人民教育出版社,1982年版。
5、《现代物理知识》,20##年第3期。
