热力学第二定律的发展与应用
On the second law of thermodynamics' development and application
淮阴工学院 数理学院 应用物理1101班 沈梅玲1104105106
The establishment of the particle physics and the application of physics
Huaiyin tech applied physics Shen Mei-ling
摘要:热力学第二定律是热力学的基本定律之一,是指热永远都只能由热处转到冷处。它是关于在有限空间和时间内,一切和热运动有关的物理、化学过程具有不可逆性的经验总结。本文综述了该定律的发现、演变历程、并介绍了它在工农业生产、生活和化学中的应用。
Abstract: Second law of thermodynamics is one of the fundamental laws of thermodynamics is that heat will always be only by heat to a cool place. It is about the limited space and time, and the thermal motion of all the relevant physical and chemical processes are irreversible in the lessons learned. In this paper, the discovery of the law, development process, and introduces its industrial and agricultural production and the application of life.
关键词:热力学第二定律,演变历程,应用
Keywords:second law of thermodynamics,livejournal,application
1 引言
热力学第二定律是人们在生活实践,生产实践和科学实验的经验总结,它们既不涉及物质的微观结构,也不能用数学加以推导和证明,但它的正确性已被无数次的实验结果所证实。有关该定律的发现和演变历程是本文讨论的重点。热力学第二定律是有关热和功等能量形式相互转化的方向与限度的规律,进而推广到有关物质变化过程的方向与限度的普遍规律。由于在生活实践中,自发过程的种类极多,热力学第二定律的应用非常广泛,本文将做相关介绍。
2热力学第二定律及发展
2.1 热力学第二定律建立的历史过程
19世纪初,巴本、纽可门等发明的蒸汽机经过许多人特别是瓦特的重大改进,已广泛应用于工厂、矿山、交通运输,但当时人们对蒸汽机的理论研究还是非常缺乏的。热力学第二定律就是在研究如何提高热机效率问题的推动下,逐步被发现的,并用于解决与热现象有关的过程进行方向的问题。
1824年,法国陆军工程师卡诺在他发表的论文“论火的动力”中提出了著名的“卡诺定理”,找到了提高热机效率的根本途径,但卡诺在当时是采用“热质说”的错误观点来研究问题的。从1840年到1847年间,在迈尔、焦耳、亥姆霍兹等人的努力下,热力学第一定律以及更普遍的能量守恒定律建立起来了。“热动说”的正确观点也普遍为人们所接受。1848年,开尔文爵士根据卡诺定理,建立了热力学温标。它完全不依赖于任何特殊物质的物理特性,从理论上解决了各种经验温标不相一致的缺点。这些为热力学第二定律的建立准备了条件。
1850年,克劳修斯从“热动说”出发重新审查了卡诺的工作,考虑到热传导总是自发地将热量从高温物体传给低温物体这一事实,得出了热力学第二定律的初次表述。后来历经多次简练和修改,逐渐演变为现行物理教科书中公认的“克劳修斯表述”。与此同时,开尔文也独立地从卡诺的工作中得出了热力学第二定律的另一种表述,后来演变为更精炼的现行物理教科书中公认的“开尔文表述”。上述对热力学第二定律的两种表述是等价的,由一种表述的正确性完全可以推导出另一种表述的正确性。
2.2热力学第二定律的实质
2.2.1可逆过程与不可逆过程
一个热力学系统,从某一状态出发,经过某一过程达到另一状态。若存在另一过程,能使系统与外界完全复原,则原来的过程称为“可逆过程”。反之,如果用任何方法都不可能使系统和外界完全复原,则称之为“不可逆过程”。
可逆过程是一种理想化的抽象,严格来讲现实中并不存在。大量事实告诉我们:与热现象有关的实际宏观过程都是不可逆过程。
2.2.2开氏与克氏的两种表述
开尔文从热功转换的角度表述了第二定律:不可能从单一热源吸取热量使之完全转变为功而不产生其它影响。也就是说:自然界中任何形式的能都可以变成热,而热却不能在不产生其他影响的条件下完全变成其他形式的能。德国物理学家克劳修斯从热量传递的方向性角度,提出了热力学第二定律的另一种表述:热量可以自发地从较热物体传递至较冷物体,但不能自发地较冷物体传递至较热物体。在自然条件下这个转变过程是不可逆的,要使热传递方向倒转,只有靠消耗功来实现。
2.3 热力学第二定律的含义
热力学第二定律,热力学基本定律之一,内容为不可能把热从低温物体传到高温物体而不产生其他影响;不可能从单一热源取热使之完全转换为有用的功而不产生其他影响;不可逆热力过程中熵的微增量总是大于零。
热力学第二定律,也可以确定一个新的态函数——熵。可以用熵来对第二定律作定量的表述。第二定律指出在自然界中任何的过程都不可能自动地复原,要使系统从终态回到初态必需借助外界的作用,由此可见,热力学系统所进行的不可逆过程的初态和终态之间有着重大的差异,这种差异决定了过程的方向。在孤立系统内对可逆过程,系统的熵总保持不变;对不可逆过程,系统的熵总是增加的。这个规律叫做熵增加原理。这也是热力学第二定律的又一种表述。
3 热力学第二定律的应用
3.1热力学第二定律的适用范围
(1)热力学第二定律是宏观规律,对少量分子组成的微观系统是不适用的。
(2)热力学第二定律适用于“绝热系统”或“孤立系统”,对于生命体是不适用的。早在1851年开尔文在叙述热力学第二定律时,就曾特别指明动物体并不像一架热机一样工作,热力学第二定律只适用于无生命物质。
(3)热力学第二定律是建筑在有限的空间和时间所观察到的现象上,不能被外推应用于整个宇宙。19世纪后半期,有些科学家错误地把热力学第二定律应用到无限的、开放的宇宙,提出了所谓“热寂说”。
3.2热力学第二定律的一些典型应用
3.2.1对时间的理解
我们已经知道,热力学第二定律事实上是所有单向变化过程的共同规律,而时间的变化就是一个单向的不可逆过程,对每个人都一样,时间一去不复还,因此还可以这样理解:时间的方向,就是熵增加的方向。这样,热力学第二定律就给出了时间箭头。物理学的进一步研究表明,能量守恒与时间的均匀性有关。这就是说,热力学第一定律告诉我们,时间是均匀流逝的。结果我们看到:热力学第一定律指出,时间是均匀的;热力学第二定律指出,时间是有方向的。这两条定律合在一起告诉我们:时间在向着特定的方向均匀地流逝着。
3.2.2 黑洞温度的发现
1972年,30岁的英国青年物理学家霍金,提出了黑洞的“面积定理”。证明了黑洞的面积A随时间变化只能增加,不能减少,即 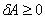 。
。
这个定理认为,物质落入黑洞、两个黑洞相撞等导致黑洞面积增加的过程,是可以发生的。而一个黑洞分裂为两个黑洞的情况,由于会导致黑洞面积减少,因而是不可能发生的。面积定理,不由使人想起热力学中的“熵”。几乎与此同时,青年物理学家贝根斯坦和斯马尔,各自独立得出了关于黑洞的一个重要公式。这个公式把黑洞的一些参量组合成了类似于热力学第一定律的形式
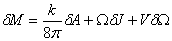
式中M、J、Q分别是黑洞的总质量、总角动量、总电荷;A、Ω、V分别是黑洞的表面积、转动角速度和表面上的静电势。k称为黑洞的表面重力。此公式与普通转动物体的热力学第一定律表达式
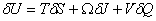
非常相似。式中U、T、S分别是系统的内能、温度和熵;Ω、J、V、Q等物理意义与前式类似。比较这两个公式不难看出,黑洞面积A确实像熵S,而黑洞的表面重力k非常像温度T。
3.2.3热力学第二定律在化学反应中的应用
根据热力学第二定律,一切自发过程都是不可逆过程。而一切不可逆过程的发展总是朝着使系统及有关周围物质的熵的总和趋于增大,只有在理想的可逆过程中两者熵的总和保持不变。即有
dS+dS0≥0
把热力学第二定律应用于化学反应,就是要判断化学反应进行的方向以及确定达到化学平衡的条件。
大多数的化学反应可以按定温-定压反应或定温-定容反应分析。对于这类反应过程,系统的温度一定且与周围环境温度相同,因而有
dS0= /T0=-
/T0=- /T
/T
代入熵增原理的表达式便可得到
TdS- ≥O
≥O
化学反应过程有用功的表达式为
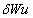 ≤-(dU-TdS)-
≤-(dU-TdS)-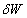
在定温-定压反应中,G=H-TS,状态参数G称为吉布斯自由能,也称为吉布斯函数。把吉布斯自由能引入上述定温-定压反应过程的有用功的关系式,就可得
 ≤-dG
≤-dG
对于可逆的定温-定压反应,反应系统可作出最大的有用功。按式 ≤-dG
≤-dG
(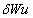 )max=-dG
)max=-dG
即在可逆的定温-定压过程中,系统所作的最大有用功等于系统吉布斯自由能的降低。
对于不可逆定温-定压反应, Wu<G1-G2=(Wu)max
即由于不可逆因素的影响,系统所作的有用功小于最大有用功。
在定温-定容反应过程中,反应系统的容积保持不变,故容积变化功为零。反应系统的有用功可表示为
 ≤-d(U-TS)=-dF
≤-d(U-TS)=-dF
式中F=U-TS为一个状态参数,称为亥姆霍兹自由能,或称为亥姆霍兹函数。该式说明,在可逆的定温定容反应过程中,反应系统所作的最大有用功等于系统亥姆霍兹自由能的降低;而在不可逆的定温-定容反应过程中,系统所作的有用功小于系统亥姆霍兹自由能的降低。
总结
热力学第二定律是关于在有限空间和时间内,一切和热运动有关的物理、化学过程具有不可逆性的经验总结。它对于人类改进蒸汽机、内燃机和开发利用能源具有重要的指导意义。当然现在还存在很多现象需要我们去探索与总结,所以物理探索的步伐永远都不会停止。
参考文献:
[1]《热力学与统计物理学》,龚昌德编,高等教育出版社,1984年版。
[2]《物理学史》,郭奕玲、沈慧君著,清华大学出版社,20##年版。
[3]《热学》,李椿、章立源、钱尚武编,人民教育出版社,1982年版。
[4]《现代物理知识》,20##年第3期。
第二篇:浅论热力学第二定律的应用
浅论热力学第二定律的应用
【摘要】热力学第二定律是热力学的基本定律之一,是指热不可能自发地、不付代价地从低温物体传到高温物体或者说不可能制造出只从一个热源取得热量,使之完全变成机械能而不引起其他变化的循环发动机。它是关于在有限空间和时间内,一切和热运动有关的物理、化学过程具有不可逆性的经验总结。本文综述了该定律的提出、演变历程、并介绍了它在工农业生产和生活中的应用。
【关键词】热力学第二定律,演变历程,应用
【引言】热力学第二定律是人们在生活实践,生产实践和科学实验的经验总结,它们既不涉及物质的微观结构,也不能用数学加以推导和证明。但它的正确性已被无数次的实验结果所证实。热力学第二定律阐述了自发过程进行的方向性和它的不可逆性,以及研究非自发过程必须具备的补充条件,它是有关热和功等能量形式相互转化的方向与限度的规律,进而推广到有关物质变化过程的方向与限度的普遍规律。由于在生活实践中,自发过程的种类极多,热力学第二定律的应用非常广泛,诸如热能与机械能的传递和转换、流体扩散与混合、化学反应、燃烧、辐射、溶解、分离、生态等问题,本文将做相关介绍。
1.热力学第二定律
1.1热力学第二定律的提出及演变
人们对热现象的系统研究是从18世纪开始的。当时由于社会生产对动力机械的需要, 导致了蒸汽机的发明。为了提高热机效率, 促使人们开展了对温度、量热学、热传导、热的本性等问题的实验和理论方面的研究。这些为热力学定律的发展奠定了基础。
1850年, 克劳修斯通过对卡诺关于热机的已有成果的研究发现, 卡诺所说的热机需要有第二个热源和他提出的理论效率公式, 都表述出热机所特有的问题一定要有一个对转换进行补偿的过程即用接触一个低温热源的方法进行冷却的过程, 以便使热机恢复到它初始的力学状态和热学状态。开尔文抓住了该问题的实质, 在1851年提出“ 不可能制造出只从一个热源取得热量,使之完全变成机械能而不引起其他变化的循环发动机。”这就是热力学第二定律的开尔文表述。人们把“ 热不可能自发地、不付代价地从低温物体传到高温物体。”称之为热力学第二定律的克劳休斯表述。热力学第二定律的表述方式虽然形式多样, 但它们都反映了能量转化的方向这一根本特性, 即有序能量可以全部无条件地转化为无序能量, 而无序能量全部转化为有序能量是不可能的或有条件的。
1.2热力学第二定律的两个表述
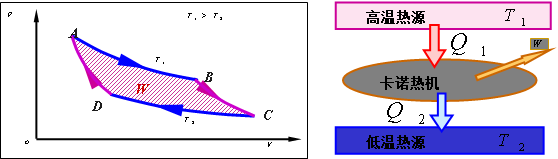
1.2.1 开尔文表述(1851年):不可能制造出只从一个热源取得热量,使之完全变成机械能而不引起其他变化的循环发动机。
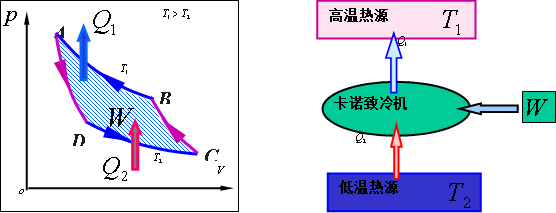
1.2.2 克劳休斯表述:热不可能自发地、不付代价地从低温物体传到高温物体。
2. 热力学第二定律的应用
2.1热力学第二定律的适用范围
(1)热力学第二定律是宏观规律,对少量分子组成的微观系统是不适用的。
(2)热力学第二定律是建筑在有限的空间和时间所观察到的现象上,不能被外推应用于整个宇宙。19世纪后半期,有些科学家错误地把热力学第二定律应用到无限的、开放的宇宙,提出了所谓“热寂说”。他们声称:将来总有一天,全宇宙都是要达到热平衡,一切变化都将停止,从而宇宙也将死亡。要使宇宙从平衡状态重新活动起来,只有靠外力的推动才行。这就会为“上帝创造世界”等唯心主义提供了所谓“科学依据”。
“热寂说”的荒谬,在于把无限的、开放的宇宙当做热力学中所说的“孤立系统”。热力学中的“孤立系统”与无所不包、完全没有外界存在的整个宇宙是根本不同的。事实上,科学后来的发展已经提供了许多事实,证明宇宙演变的过程不遵守热力学第二定律。正如恩格斯在《自然辩证法》中指出了“热寂说”的谬误。他根据物质运动不灭的原理,深刻地指出:“放射到太空中去的热一定有可能通过某种途径——指明这一途径,将是以后自然科学的课题——转变为另一运动形式,在这种运动形式中,它能重新集结和活动起来。”热力学第二定律和热力学第一定律一样,是实践经验的总结,它的正确性是由它的一切推论都为实践所证实而得到肯定。
(3)生命体属于有限范围内的宏观物体。因此热力学的第二定律适用于生命体。按照热力学第二定律, 对生命体来说, 其嫡变△S〉△Q/T 。这说明生命过程伴随着嫡的产生。嫡产生引起的效果是使生命体的有序度降低或使生命体由有序走向无序。但是, 按照达尔文的进化论, 生命现象是朝着由简单到复杂、由低级到高级、由无序向有序的方向发展。正因为是这样, 不少人认为热力学第二定律只适用于死的、无生命的物体。比利时布鲁塞尔自由大学伊· 普利高津教授创立的耗散结构理论解决了这个问题。该理论认为, 对于一个开放系统来说, 嫡的变化可以分为两部分一部分是系统本身由于不可逆过程如热传导、热扩散、某些化学反应等引起的嫡增加, 即嫡产生(diS), 这一项永远是正的另一部分是系统与外界交换物资和能量引起的嫡流(deS), 这一项可正可负。整个系统的嫡的变化是这两项之和。dS=deS+diS。如果deS是负的, 其绝对值又大于diS, 则dS小于零。这表明, 只要从外界流人的负墒流足够大, 就可以抵消系统本身的嫡产生, 使系统的总嫡减少, 逐步从无序向新的有序方向发展, 最终形成一个低嫡的有序结构, 并且通过与外界的物质、能量交换, 维持这种有序结构。生命体是一种远离平衡态的开放系统, 依靠从外界获取物质和能量维持其自身的有序性。生命体从外界获取物质和能量的效果, 相当于从外界获得了负嫡流, 因而可以抵消体内由于不可逆过程引起的嫡增加。普利高津由于在创立耗散结构理论方面的重大贡献, 荣获了1977年诺贝尔化学奖。
2.2热力学第二定律的一些典型应用
2.1.1对时间的理解
我们已经知道,热力学第二定律事实上是所有单向变化过程的共同规律,而时间的变化就是一个单向的不可逆过程,对每个人都一样,时间一去不复还,因此还可以这样理解:时间的方向,就是熵增加的方向。这样,热力学第二定律就给出了时间箭头。物理学的进一步研究表明,能量守恒与时间的均匀性有关。这就是说,热力学第一定律告诉我们,时间是均匀流逝的。结果我们看到:热力学第一定律指出,时间是均匀的;热力学第二定律指出,时间是有方向的。这两条定律合在一起告诉我们:时间在向着特定的方向均匀地流逝着。正如一句古诗描述的情景:“长沟流月去无声”。这使得我们可以从另一新的角度来认识时间。
2.2.2 黑洞温度的发现
1972年,30岁的英国青年物理学家霍金(S.Hawking,1942~),提出了黑洞的“面积定理”。证明了黑洞的面积A随时间变化只能增加,不能减少,即 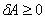 。这个定理认为,物质落入黑洞、两个黑洞相撞等导致黑洞面积增加的过程,是可以发生的。而一个黑洞分裂为两个黑洞的情况,由于会导致黑洞面积减少,因而是不可能发生的。面积定理,不由使人想起热力学中的“熵”。但是黑洞面积与熵是风马牛不相及的两种东西,这样去联想它们,是不是太荒唐了呢?
。这个定理认为,物质落入黑洞、两个黑洞相撞等导致黑洞面积增加的过程,是可以发生的。而一个黑洞分裂为两个黑洞的情况,由于会导致黑洞面积减少,因而是不可能发生的。面积定理,不由使人想起热力学中的“熵”。但是黑洞面积与熵是风马牛不相及的两种东西,这样去联想它们,是不是太荒唐了呢?
几乎与此同时,青年物理学家贝根斯坦和斯马尔,各自独立得出了关于黑洞的一个重要公式。这个公式把黑洞的一些参量组合成了类似于热力学第一定律的形式
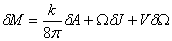
式中M、J、Q分别是黑洞的总质量、总角动量、总电荷;A、Ω、V分别是黑洞的表面积、转动角速度和表面上的静电势。k称为黑洞的表面重力。此公式与普通转动物体的热力学第一定律表达式

非常相似。式中U、T、S分别是系统的内能、温度和熵;Ω、J、V、Q等物理意义与前式类似。比较这两个公式不难看出,黑洞面积A确实像熵S,而黑洞的表面重力k非常像温度T。不久,人们又研究出黑洞的另外两个性质,很像普通热力学的第零定律和第三定律。下表比较了普通热力学四定律与黑洞力学的相应性质:

难道黑洞真的有温度吗?为此人们进行了热烈的争论。1973年霍金、巴丁、卡特等卓有成就的黑洞专家联名发表了一篇论文,声称:可以模仿热力学定律给出黑洞力学的四条定律,但黑洞的温度不能看作真实温度,因为黑洞没有热辐射(不可能有任何物质跑出黑洞!),而有真实温度的物体,应该有热辐射。因此他们把黑洞的四条定律,谨慎地称为“黑洞力学四定律”,而不是“黑洞热力学四定律”。
但是,几个月后(1973年底),霍金就宣称,他已证明,黑洞有热辐射,黑洞的温度是真实的,其值为

式中kB 是玻尔兹曼常数,k是黑洞表面的重力加速度。对于一个M=Ms(太阳质量)的黑洞,T=6×10-8K,可以忽略不计;而对于一个质量为10亿吨的小黑洞,温度可达1012K。随着黑洞质量不断减少,黑洞的温度急剧升高,辐射越来越强,直至黑洞消亡为止。所以,“黑洞不黑,他会蒸发;黑洞不黑,越小越白。”黑洞热辐射的发现,是黑洞研究的重大突破,也是时空理论的重大突破。为了纪念霍金的功绩,人们把黑洞热辐射叫做霍金辐射。
1998年5月,安装在哈勃望远镜上的最新红外线摄象机拍摄的一些照片表明,在距离地球1000万光年的半人马座A射电源的中央,存在一个巨大的黑洞,其质量比10亿个太阳还要大,它正在吞噬由恒星构成的一个螺旋形星系。这些被高速吞噬的物质的温度达数百万开,从而使黑洞中有超热气流喷出,并且发出强大的X射线和射电信号。
3.结束语
通过以上分析我们看到, 热力学第二定律的适用范围是非常广泛的, 不仅适用于无生命的宏观物质系统, 而且适用于生命系统。对于由少数分子、原子组成的系统, 热力学第二定律并不适用。同时也不能把热力学第二定律的适用范围无限外推到整个宇宙, 把无穷的宇宙当作孤立系统来处理。
参考文献:
1、《热工学》,陈黟 吴味隆 等编著,高等教育出版社,20##年第三版(20##年重印)。
2、《基础物理学教程》,陆果著,高等教育出版社,1999年第二版。
3、《现代物理知识》,20##年第3期。
4、《探求上帝的秘密》,赵诤著,科学出版社,20##年版。
5、《热学》,李平,〔北京北京师范大学出版社,1987年版。
6、《热力学与统计物理学》,马本等编著,北京人民教育出版社,1980年版。
