稳定性考察与留样观察
稳定性考察是定期要检验药品各个方面的数据。
留样观察是同一批产品中留下的样品,以备必要时重新进行检测。
加速试验是指在保证不改变产品失效机理的前提下,通过强化试验条件,使受试产品加速失效,以便在较短时间内获得必要信息,来评估产品在正常条件下的可靠性或寿命指标.通过加速试验,可迅速查明产品的失效原因,快速评定产品的可靠性指标。
稳定性研究内容可分为影响因素试验、加速试验和长期试验等,稳定性研究具有阶段性特点,不同阶段具有不同的目的。一般始于药品的临床前研究,贯穿药品研究与开发的全过程,在药品上市后还要继续进行稳定性研究。
(一)样品的批次和规模
影响因素试验可采用一批小试规模样品进行;加速试验和长期试验应采用3批中试以上规模样品进行。
(二)包装及放置条件
加速试验和长期试验所用包装材料和封装条件应与拟上市包装一致。
稳定性试验要求在一定的温度、湿度、光照等条件下进行,这些放置条件的设置应充分考虑到药品在贮存、运输及使用过程中可能遇到的环境因素。
稳定性研究中所用控温、控湿、光照等设备应能较好地对试验要求的环境条件进行控制和监测,如应能控制温度±2℃,相对湿度±5%,照度±500lx等,并能对真实温度、湿度与照度进行监测。
(三)考察时间点
稳定性研究中需要设置多个时间点。考察时间点的设置应基于对药品理化性质的认识、稳定性变化趋势而设置。如长期试验中,总体考察时间应涵盖所预期的有效期,中间取样点的设置要考虑药品的稳定特性和剂型特点。对某些环境因素敏感的药品,应适当增加考察时间点。
(四)考察项目
一般情况下,考察项目可分为物理、化学和生物学等几个方面。
稳定性研究的考察项目(或指标)应根据所含成份和/或制剂特性、质量要求设
置,应选择在药品保存期间易于变化,可能会影响到药品的质量、安全性和有效性的项目,以便客观、全面地评价药品的稳定性。一般以质量标准及中国药典制剂通则中与稳定性相关的指标为考察项目,必要时,应超出质量标准的范围选择稳定性考察指标。
有效成份及其制剂应考察有关物质的变化。
有效部位及其制剂应关注其同类成份中各成份的变化。
复方制剂应注意考察项目的选择,注意试验中信息量的采集和分析。为了确定药物的稳定性,对同批次不同取样时间点及不同批次样品所含成份的一致性进行比较研究,是有意义的
三、稳定性研究实验方法
(一)影响因素试验
影响因素试验一般包括高温、高湿、强光照射试验。将原料置适宜的容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚的薄层进行试验。对于固体制剂产品,采用除去内包装的最小制剂单位,分散为单层置适宜的条件下进行。如试验结果不明确,应加试2个批号的样品。
1.高温试验
供试品置密封洁净容器中,在60℃条件下放置10天,于0、5、10天取样检测。与0天比较,若供试品发生显著变化,则在40℃下同法进行试验。如60℃无显著变化,则不必进行40℃试验。
2.高湿试验
供试品置恒湿设备中,于25℃、RH92.5%±5%条件下放置10天,在0、5、10天取样检测。检测项目应包括吸湿增重等。若吸湿增重在5%以上,则应在25℃、RH75%±5%下同法进行试验;若吸湿增重在5%以下,且其他考察项目符合要求,则不再进行此项试验。
恒湿条件可以通过恒温恒湿箱或在密闭容器中放置饱和盐溶液来实现。根据不同的湿度要求,选择NaCl饱和溶液(15.5-60℃,RH75%±1%)或KNO3饱和溶液(25℃,RH92.5%)。
对水性的液体制剂,可不进行此项试验。
3.强光照射试验
供试品置装有日光灯的光照箱或其它适宜的光照容器内,于照度为4500lx±500lx条件下放置10天,在0、5、10天取样检测。试验中应注意控制温度,与室温保持一致,并注意观察供试品的外观变化。
此外,根据药物的性质必要时应设计其他试验,探讨pH值、氧及其他条件(如冷冻等)对药物稳定性的影响。
(二)加速试验
加速试验一般应在40℃±2℃、RH75%±5%条件下进行试验,在试验期间第0、1、2、3、6个月末取样检测。若供试品经检测不符合质量标准要求或发生显著变化,则应在中间条件下,即在30℃±2℃、RH65%±5%条件下(可用Na2CrO4饱和溶液,30℃,RH64.8%)进行试验。
对采用不可透过性包装的液体制剂,如合剂、乳剂、注射液等的稳定性研究中可不要求相对湿度。对采用半通透性的容器包装的液体制剂,如多层共挤PVC软袋装注射液、塑料瓶装滴眼液、滴鼻液等,加速试验应在40℃±2℃、RH20%±5%的条件下进行。
对膏药、胶剂、软膏剂、凝胶剂、眼膏剂、栓剂、气雾剂等制剂可直接采用30℃±2℃、RH65%±5%的条件进行试验。
对温度敏感药物(需在4-8℃冷藏保存)的加速试验可在25℃±2℃、RH60%±5%条件下同法进行。需要冷冻保存的药品可不进行加速试验。
(三)长期试验
长期试验是在接近药品的实际贮存条件下进行的稳定性试验,建议在25℃±2℃、RH60%±10%条件下,分别于0、3、6、9、12、18个月取样检测,也可在常温条件下进行。对温度特别敏感药物的长期试验可在6℃±2℃条件下进行试验,取样时间点同上。
(四)药品上市后的稳定性考察
药品注册申请单位应在药品获准生产上市后,采用实际生产规模的药品进行留样观察,以考察上市药品的稳定性。根据考察结果,对包装、贮存条件进行进一步的确认或改进,并进一步确定有效期
留样观察一般是指产品一批留样,对药品的有些关键项目进行检验,
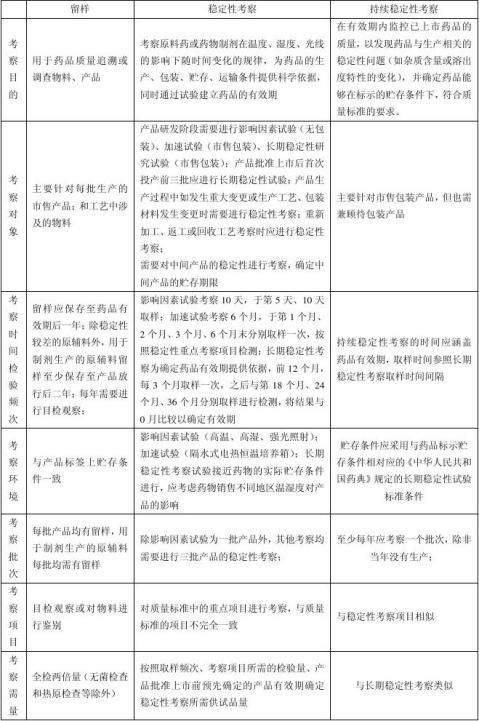
第二篇:留样、稳定性考察、持续稳定性考察区别
留样、稳定性考察、持续稳定性考察区别
**原辅料及中药材、中药饮片的留样根据其留样目的可提高存储条件(如阴凉储存) **稳定性考察与持续稳定性考察用于考察本企业生产的中间产品或成品