解答除杂质一类的题目时,要注意三原则;三步骤;五种常用的方法。
三原则:①不增:提纯过程中不增加新的杂质;②不变:被提纯的物质不能改变;③易分:被提纯的物质与杂质易分离。
三步骤:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
五种初中化学常用除杂方法:初中化学常用除杂方法有:
1、沉淀法:使混合物中的杂质与适当试剂反应,生成沉淀,然后通过过滤而除去。
例题1:下列混合物可用沉淀法除去杂质(括号内的物质是杂质)的是( )
A.KNO3〔BaCl2〕 B.NaCl〔KNO3〕 C.NaNO3 [NaCl] D.Ca(NO3)2 [Mg( NO3)2]
答案:C NaCl+ Ag NO3= AgCl↓+ NaNO3
D Mg(NO3)2+Ca(OH)2= Ca(NO3)2+ Mg(OH)2↓
小结:一般说来,如果杂质中有一种离子与原来的物质中的离子相同,那所选试剂只需有一种离子与原来物质中的离子相同,另一种离子与杂质离子生成沉淀。
2、气化法:将混合物中的杂质与适当试剂反应变成气体而除去。
如:硝酸钠固体中含有少量碳酸钠杂质,可将混合物加水溶解,再加入适量稀硝酸溶液,硝酸与碳酸钠反应生成硝酸钠、水和二氧化碳,再蒸发滤液,或得硝酸钠固体。
例题2:下列混合物中的杂质(括号内的物质是杂质)适宜用气化法除去的是:
A.NaNO3〔Ba(NO3)2〕 B.NaCl [Mg(OH)2] C.KNO3〔K2CO3〕 D.Na2SO4〔MgSO4〕
答案:C:K2CO3
小结:杂质一般为碳酸盐或碳酸氢盐 ,试剂一般是酸。
3、置换法:将混合物中的杂质与适量试剂通过发生置换反应而除去。
如:硫酸锌固体中含有少量硫酸铜杂质,可将混合物溶解之后,加人适量锌粉,再过滤除去被置换出来的铜,蒸发滤液获得硫酸锌固体;Cu中混有少量CuO除了用酸除去外,可以用氢气在加热的条件下置换出氧化铜中的铜。
练习:1 加入下列哪些物质可以除去硫酸亚铁溶液中混有的少量杂质硫酸铜( )
A.Zn B.Fe C.Cu D.Mg
答案B
2 将混有少量铁粉和锌粉的硫酸铜晶体溶于适量水,充分静止过滤,结果是
A.滤出了混杂在其中的铁粉 B.滤出了混杂在其中的锌粉 C.滤出了一些铜粉 D.什么也没滤出
答案:C.
小结:根据杂质的类别,一般考虑金属与酸反应,金属与盐溶液反应,氢气还原金属氧化物,碳还原金属氧化物来选择试剂。
4、吸收法:两种以上混合气体中的杂质被某种溶剂或溶液吸收,而要提纯的气体不能被吸收时,可用此方法。
如:一氧化碳中含有二氧化碳时,可将混合气体通过盛有氢氧化钠的溶液。
练习:下列气体中的杂质(括号内的物质是杂质)用吸收法除去,所选试剂正确的是
A O2(H2O) 用浓H2SO4 除水 B CO2(HCl)用NaOH溶液除HCl
C NH3(H2O) 用浓H2SO4 除水 D CO2 (HCl )用Na2CO3溶液除HCl
答案:A D
小结:气体的吸收剂可考虑:浓硫酸吸收水蒸气、氨气;氢氧化钠溶液吸收二氧化碳、二氧化硫、氯化氢气体等;水吸收氨气、氯化氢气体等。
5、 其它法: 将混合物中的杂质用化学方法转化成其它物质。
如:氧化钙中含有碳酸钙,可采用高温燃烧的方法,使碳酸钙高温分解成氧化钙和二氧化碳,二氧化碳扩散到空气中,除去杂质。
1、下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是D

A.②③ B.①③ C.②④ D.①④
2、 某种即热饭盒用混有少量铁粉的镁粉与水反应提供热量。现将该混合物分成四等份,进行如下实验,其中所得实验结论正确的是C

3、鉴别下列各组物质,括号中选用的试剂或方法,不合理的是( C )
A、C2H5OH和NaCl溶液(闻气味) B、NaOH溶液和稀H2SO4(酚酞试液)
C、Ca(OH)2溶液和NaOH溶液(稀盐酸) D、KMnO4和KClO3(观察颜色)
4、下列各组混合物中,用一种试剂不能将括号内的杂质除去的是( A )
A、Cu(SO4)2 (Na2SO4) B、C (CuO)
C、CO2 (CO) D、NaCl (MgCl2)
5、除去二氧化碳中混有少量一氧化碳的方法是D
A.将一氧化碳倒出 B.将气体点燃
C.将气体通过足量澄清石灰水中 D.将气体通过灼热的氧化铜
6、鉴别日常生活中的下列各组物质,操作1和操作2均有错误的是B

7、要鉴别碳酸钠、硫酸钠、硝酸钡三种无色溶液,可选用下列试剂中的A
A. 硫酸 B. 硝酸 C. 盐酸 D. 石蕊试液
8、要除去氯化钠溶液中混有的少量硫酸铜,可加入下列试剂中的是A
A. 氢氧化钡溶液 B. 氯化钡溶液
C. 硝酸银溶液 D. 氢氧化钠溶液
9、用经济、简便的方法鉴别硫酸铜、碳酸钠、氢氧化镁三种白色固体粉末,应选用的一种试剂是C
A. 稀盐酸 B. 紫色石蕊试液
C. 水 D. 氢氧化钠溶液
10.下列各组溶液,不用其他试剂,就能区别出来的一组是D
A. NaCl、H2SO4、NaOH B. CuCl2、CuSO4、NaOH
C. BaCl2、Na2SO4、Na2CO3 D. BaCl2、CuSO4、Na2CO3
11.要除去氯化锌溶液里混有的少量盐酸和氯化铜,可加入下列试剂中的 D
A. NaOH溶液 B. AgNO3溶液
C. Fe D. Zn
12、如果要除去二氧化碳气体中混有的少量一氧化碳,应采用的方法是( C )
A. 点燃混合气体,使一氧化碳转变成二氧化碳
B. 把混合气体通入石灰水中
C. 使混合气体通过灼热的氧化铜
D. 把混合气体从一容器倒入另一容器
13、含CO、N2、H2、CO2和水蒸气的混合气,依次通过NaOH 溶液、灼热的CuO和浓硫酸,最后剩下的气体是( A )
A. N2和CO2 B. N2和H2
C. N2和CO D. 无任何气体
14、某无色气体可能含有H2、CO、CO2和N2中的一种或几种,当混合气体依次通过紫色石蕊试液时,紫色石蕊试液没有变色;通过灼热的氧化铜时有红色的铜生成,通过澄清的石灰水时,石灰水变浑浊。该气体一定含有________CO______,一定不含______ CO2______,可能含有___ H2和N2________。
15、有一包混合物,其中可能是含有碳酸氢铵、碳酸钙、炭粉、氧化铜、氧化铁中的一种或几种。现作如下实验,第一步:取样品,高温灼热后产生一种无色无味的气体,将该气体通入澄清的石灰水中,石灰水变浑浊;第二步:把足量稀盐酸滴入固体残留物后,残留物全部溶解,同时产生一种具有还原性的气体。试回答:
① 混合物中一定不含有的物质是 NH4HCO3和CuO ;② 混合物中一定含有的物质是 C和Fe2O3 ;③ 混合物中可能含有的物质是 碳酸钙(CaCO3) ;为证明它是否存在,应采用的方法是 若证明存在碳酸钙,可取少量样品,加入适量的稀盐酸,若产生能使澄清石灰水变浑浊的气体,则证明存在碳酸钙,否则不含有碳酸钙。 。
解析:由第一步实验产生无色无味的气体可推知,混合物中肯定不存在碳酸氢铵。能使澄清的石灰水变浑浊的气体是二氧化碳,它可能来自于碳酸钙分解,也可能来自炭粉与氧化铜或炭粉与氧化铁反应后的产物,所以此时不能判断碳酸钙的存在,根据第二步实验加稀盐酸后残留物全部溶解,且有还原性气体产生,可知一定存在单质铁而无单质铜,因为炭与氧化铜反应的产物铜不溶于盐酸,进而推知原混合物中一定存在氧化铁和炭,而无氧化铜。
16.下列各组中的物质,能在溶液中大量共存的是A
A.KNO3、NaCl、NaOH B.KOH、Na2CO3、HCl
C.KNO3、NaOH、FeC13 D.AgNO3、BaC12、HNO3
17.为除去CaCO3粉末中混有少量CaCl2,可采用的方法是B
A.加热 B.溶解后过滤
C.加适量稀盐酸 D.加适量稀硫酸
18.下列各组物质中,可依次通过溶解、过滤、蒸发等操作进行分离的是A
A.氯化镁和氯化银 B.水和植物油
C.二氧化锰粉末和铁粉 D.氯化钡和硝酸镁
19.要除去银粉中含有的少量铜粉,可加入下列试剂中的B
A.稀盐酸 B.硝酸银溶液
C.硝酸汞溶液 D.稀硫酸
20.氯化钙溶液中含有少量盐酸,欲中和盐酸使溶液呈中性,在没有指示剂的条件下可选用的试剂是C
A.熟石灰 B.生石灰
C.石灰石 D.纯碱
第二篇:初三化学 推断、鉴别、除杂题 专项练习
初三化学 推断、鉴别、除杂题 专项练习
1.下列试管内壁的物质能用括号内所给试剂除去的是( )
A. 盛石灰水后留下的固体(NaOH溶液) B. 用足量还原 后留下的光亮红色固体(稀HCl)C. 盛过植物油的试管(热碱液) D. 氯化铁溶液和氢氧化钠溶液反应后留下的固体(水)
2.利用无色酚酞试液可以鉴别的一组溶液是( )
A、BaCl2、H2SO4、HCl B、NaOH、KOH、HCl
C、K2CO3、Na2CO3 、HCl D、NaCl、NaOH、HCl
3.如果要除去二氧化碳气体中混有的少量一氧化碳,应采用的方法是( )
A. 点燃混合气体,使一氧化碳转变成二氧化碳 B. 把混合气体通入石灰水中
C. 使混合气体通过灼热的氧化铜 D. 把混合气体从一容器倒入另一容器
4.现有以下几项操作:① 加适量盐酸 ② 加适量水溶解 ③ 过滤 ④ 高温或加热灼烧 ⑤ 蒸发,请选择合适操作,以除去下列各物质中含有的少量杂质,并将其标号按操作的先后顺序填在横线上。
A. 除去氯化钾晶体中的碳酸钾,应先再。
B. 除去生石灰中的碳酸钙,应。
C. 除去铜粉中的氧化铜,应先。
D. 除去碳酸钙中的碳酸钠,应先
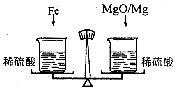
5.从铁、硫酸铜溶液、稀盐酸、氯化钡溶液四种物质中,选择适当的物质填入下图方框中。(图中连线表示相邻两种物质间能够发生化学反应,已知金属活动性:Ba>Ca)
6.某兴趣小组收集到两种岩石样品A和B。他们进行了如下实验探究(B是常用的建筑材料,H是单质):
(1)写出有关物质的化学式:A的主要成分 ,B的主要成分 ,X ,Y 。
(2)写出下列步骤的方程式:
② ,⑤ ,⑥ 。
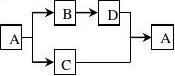
7.A、B、C、D是常见的化合物,A中含有钾元素。它们之间反应关系如下:
①2A+B=C+2H2O ②C+D=BaSO4↓+2A ③D+CuSO4=BaSO4↓+Cu(OH)2↓
根据以上信息,推断A、B两物质化学式:A ,B ;
写出反应②的化学方程式: 。

1 Na2CO3
8. A、B、C、D、E、F、G都是初中化学中常见物质。其中A是酸,C和D是盐,E和F是碱,它们相互可以发生如下变化:①A+E→D+G②2A+B→C+H2↑③2E+C→F↓+2D根据信息,回答:
⑴在化合物C中,元素B呈现的化合价是 含有B元素的化合物除了C外还
有 (填A、B、C、D、E、F、G等符号)。
⑵A的化学式是 ,G的化学式是 。
⑶写出符合反应③的一个化学方程式
9. 在托盘天平的两盘上各放一只烧杯,分别盛有等质量、等质量分数的足量
的稀硫酸,向左边烧杯中加入56g铁,向右边烧杯中加入58g镁和氧化镁的混
合物,充分反应后天平保持平衡,则参加反应的铁与氧化镁中氧元素的质量比
为 .
10. A~D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、反应物、产物均已略去)。请按要求写出下列物质的化学式:
(1)若A常温下是一种无色液体,且D是CuO。则:A为 ,
写方程式:C+D→A 。
(2)若A在常温下是一种不溶于水的白色固体,且C是形成温室效应的主要气体之一。则:A ,
写出化学反应方程式:B→D 。
11.若从Na2CO3、Na2SO4、H2SO4、NaCl、NaNO3、Cu(NO3)2、HNO3七种溶液中取出其中的两种,进行混合及有关实验,所观察到的现象记录如下表。试根据各步实验及其现象先进行分步推断,再椎断所取的两种溶液的可能组合。
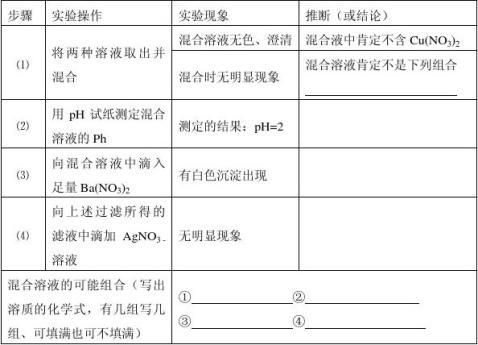
2
12.图中的各物质及其转化关系,都与人类生活有密切关系,其中A、B、E、H均为常见的单质,F为难溶于水的白色沉淀。将一定质量的A与B混合点燃生成了C和D两种物质。
(1)写出化学式:A ,G 。
(2)反应②在工业上有重要的应用,写出该反应的化学方程式 。
(3)反应④是未来人类获得能量的理想形式,其化学方程式是 。
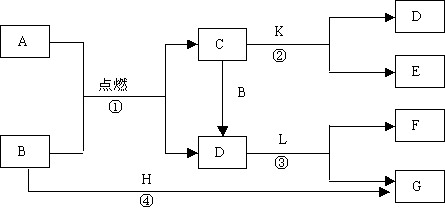
13.下列框图中的物质均为初中化学常见物质,其中A是建筑材料的主要成分,B属于氧化物,H是金属单质,下图是它们之间的相互转化关系。请回答:
(1)写出下列物质的化学式:A 、 C 、 F 。
(2)得到F溶液的操作方法为: 。
(3)若有气体X生成,则I为 ;B转化为H的化学方程式为 ;
若没有气体X生成,则 G与F溶液反应的化学方程式为 ,该反应的基本反应类型属于 反应。
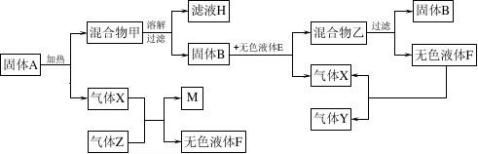
14.以下是一些常见物质间互相转化的关系图(有些反应条件未注明)
(1)将固体A充分加热至不再产生气体,滤液H中所含有的物质有:______________(写化学式)
(2)固体B的化学式为______________,它在与无色液体E的反应中起____________作用。
(3)如果气体Z是最简单的有机物,它在气体X中燃烧,会因X的量的变化和条件的不同而生成不同的物质。试写出X和Z反应生成固体单质M和无色液体F的化学方程式:____________________________________。
3

