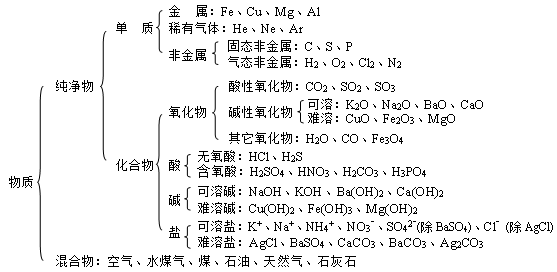
一、物质的分类:
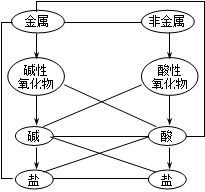
二、各类物质的主要化学性质:(见下图。短线表示相互间能反应,箭号表示相互间能转化)
1.单质:
 1)金属:
1)金属:
 2)非金属 + 氧气 → 氧化物
2)非金属 + 氧气 → 氧化物
2.氧化物:
 1)酸性氧化物:
1)酸性氧化物:
 2)碱性氧化物:
2)碱性氧化物:
 3)水:
3)水:
 3.酸:
3.酸:
 4.碱:
4.碱:
5.盐:

三、化学反应的基本类型:
1)化合反应:(有单质时化合价改变)
⑴单质+单质→化合物 Mg + O2 —— P + O2 ——
⑵单质+化合物→化合物 C + CO2 ——
⑶化合物+化合物→化合物 CaO + H2O —— CuSO4 + H2O ——
2)分解反应:(有单质时化合价改变)
⑴氧化物分解 H2O —— HgO ——
⑵酸分解 H2CO3 ——
⑶盐分解 KMnO4 —— KClO3 ——
CaCO3 —— CuSO4·5H2O ——
Cu2(OH)2CO3 ——
3)置换反应:(化合价一定改变)
⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)
Fe + HCl — Al + H2SO4 —
⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)
Fe + CuSO4 — Cu + AgNO3 —
⑶金属氧化物+H2(或C)→金属+水(或CO2)
CuO + H2 — C + Fe2O3 ——
4)复分解反应:(化合价一定不变)
⑴碱性氧化物+酸→盐+水
Fe2O3 + HCl — CuO + H2SO4 —
⑵酸+碱→盐+水
NaOH + H2SO4 — Fe(OH)3 + HCl —
⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)
H2SO4 + BaCl2 — HCl + CaCO3 —
⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)
Ca(OH)2 + Na2CO3 — NaOH + FeCl3 —
⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
CaCl2 + K2CO3 — Ba(NO3)2 + Na2SO4 —
※不属于四种基本类型的反应:
⑴金属氧化物+CO→金属+CO2 Fe2O3 + CO ——
⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO2 —
⑶有机物+O2→H2O+CO2 C2H5OH + O2 ——
☆氧化还原反应:
得到氧的物质被氧化,发生氧化反应,是还原剂;失去氧的物质被还原,发生还原反应,是氧化剂。
如:在2Mg+CO2 点燃 2MgO+C中, 是氧化剂, 是还原剂, 被氧化,
被还原。
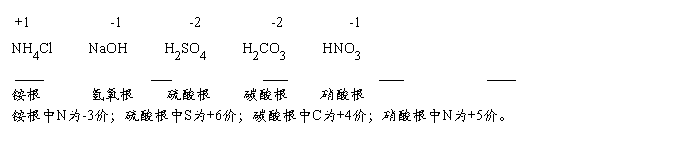 ☆常见的原子团及其化合价:
☆常见的原子团及其化合价:
四、金属活动性顺序和复分解反应发生的条件:
1.金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。
⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
2.复分解反应发生的条件:
⑴可溶的反应物,能生成↓、或H2O、或↑(CO2或NH3)⑵难溶的反应物,能生成↑、或H2O
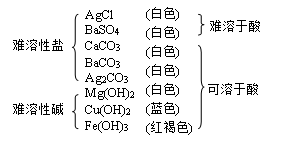 ☆复分解反应生成的沉淀:
☆复分解反应生成的沉淀:
五、物质的鉴别、鉴定(检验)、提纯(除杂)、分离:
☆检验物质的试剂:
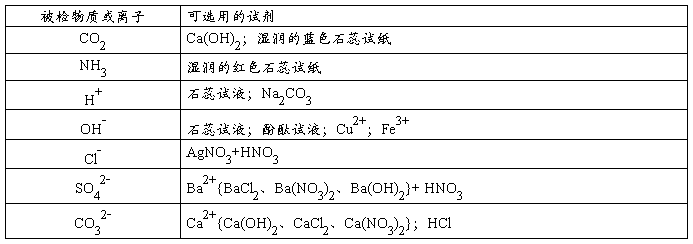
⑴鉴别:鉴别是将不同的物质按其物理性质或化学性质的不同而加以辨别的过程。
写出鉴别下列各组物质所需的试剂或方法:
①鉴别Na2CO3和CaCO3: ②鉴别Na2SO4和NaCl:
③鉴别H2和CH4: 、 ④鉴别Na2CO3和NaCl:
⑵鉴定(检验):检验是用一定的化学方法或物理方法将某种物质确定出来的过程。
写出检验下列各物质所需的试剂或方法:
①盐酸: 、 ②Fe2(SO4)3: 、
 ⑶除杂:除杂是用物理或化学方法除去混合物中的杂质的过程。
⑶除杂:除杂是用物理或化学方法除去混合物中的杂质的过程。
写出除去下列各物质中的杂质所需的试剂或方法:
①除去MnO2中的KCl: ②除去NaOH中的Na2CO3:
⑷提纯:提纯是用物理或化学方法除去混合物中的杂质除去并得到某纯净物的过程。
写出提纯下列各物质的实验步骤及所需的试剂或方法:
①从KCl与MnO2的混合物中提纯KCl: 、 、
②从MgCl2与CaCl2的混合物中提纯MgCl2: 、 、 、
⑸分离:分离将混合物中的各成分用物理或化学方法分开从而得到各纯净物的过程。
写出分离下列各物质的实验步骤及所需的试剂或方法:
①分离KCl与MnO2的混合物; ②分离BaCl2与NaCl的混合物。
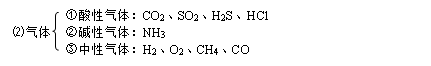 六、气体的干燥:
六、气体的干燥:

注意:酸性干燥剂不能用于干燥碱性气体;碱性干燥剂不能用于干燥酸性气体。
七、其他: 1.物质的学名、俗名及化学式:
⑴水银、汞、Hg ⑵金刚石、石墨、C;硫磺、S;红磷、白磷、P
⑶干冰、固体CO2 ⑷生石灰、氧化钙、CaO;氨气、NH3(碱性气体)
⑸盐酸、氢氯酸、HCl;氢硫酸、H2S;亚硫酸、H2SO3
⑹熟石灰、消石灰、Ca(OH)2;苛性钠、烧碱、火碱、NaOH;氨水、NH3·H2O(碱)
⑺纯碱、Na2CO3;碳酸钠晶体、纯碱晶体、Na2CO3·10H2O;碳酸氢钠、小苏打、NaHCO3;亚硝酸钠、NaNO2(工业用盐);胆矾、蓝矾、硫酸铜晶体、CuSO4·5H2O;铜绿、Cu2(OH)2CO3
⑻甲烷、CH4;甲醇、CH3OH;酒精、乙醇、C2H5OH;醋酸、乙酸、(冰醋酸)CH3COOH
2.常见混合物的主要成分:
煤:C; 石油:C、H、O元素 天然气:CH4
水煤气:H2、CO 石灰石、大理石:CaCO3 石灰水、石灰乳、石灰浆:Ca(OH)2
3.常见物质的颜色:
△ 白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4
△ 银白色:镁、铝、锌、铁、汞(液态) △ 黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4
△ 红色固体:Cu、Fe2O3 、HgO、红磷 △ 蓝色晶体:CuSO4·5H2O △ KMnO4为紫黑色 △ 硫:淡黄色
△ Cu2(OH)2CO3为绿色
4.溶液的颜色:
△含Cu2+的溶液呈蓝色(CuCl2溶液为蓝绿色);△ 含Fe2+的溶液呈浅绿色;
△ 含Fe3+的溶液呈黄色;△ 其余溶液一般为无色。(高锰酸钾溶液为紫红色)
5溶于水放热的物质:CaO、NaOH固体、浓H2SO4
6刺激性气味的气体:NH3、SO2、HCl(均无色)▲刺激性气味的液体:盐酸、硝酸、醋酸 ▲酒精为有特殊气体的液体
7有毒的物质:CO、CH3OH、NaNO2、Cu2+(如CuSO4)、Ba2+(如BaCl2)
8氮肥的含氮量:NH4HCO3 17.7%;(NH4)2SO4 21.2%;NH4Cl 26.2%;NH4NO3 35%;尿素CO(NH2)2 46.7%
第二篇:初三化学第十单元《酸碱盐》测试题(三)
初三化学第十单元《酸碱盐》测试题(三)
一、 选择题一(只有一个正确答案)(每道小题 1分 共 40分 )
1. 下列物质中属于正盐的是 [ ]
A.Na2CO3 B.NaHSO4 C.Cu(OH)2 D.Cu2(OH)2CO3
2. 下列各物质不能与酸反应生成盐和水的是 [ ]
A.NaOH B.CuO C.Cu(OH)2 D.H2O
3. 下列物质能导电的是 [ ]
A.酒精 B.冰醋酸 C.烧碱固体 D.氯化钾溶液
4. 某溶液的pH值=10,若将该溶液的pH值降到约等于4,应采取的措施是加入适量的 [ ]
A.蒸馏水 B.pH值=1的溶液C.pH值=14的溶液 D.食盐水
5. 下列各组物质的俗称、名称和化学式表示的不是同一种物质的
有 [ ]
A.食盐、氯化钠、NaCl B.纯碱、碳酸钠、Na2CO3
C.胆矾、硫酸铜、CuSO4 D.盐酸、氢氯酸 、HCl
6. 稀释浓硫酸时,是将浓硫酸注入水中,而不是将水注入浓硫酸中,其原因是
[ ]
A.浓硫酸的量小,水的量大 B.浓硫酸容易溶在水中
C.因放出大量热,使水沸腾,使硫酸液滴飞溅
D.浓硫酸是油状的粘稠液体
7. 下面金属排列顺序,前者能把后者从某溶液里置换出来是[ ]
A.Zn、Al、Mg B.Fe、Zn、Al C.Ag、Cu、Hg D.Zn、Cu、Hg
8. 下列物质能与水反应的是 [ ]
A.SiO2 B.MnO2 C.CaO D.CuO
9. 对于盐酸,下列说法错误的是 [ ]
A.它是一种挥发性酸 B.工业上用的盐酸往往带黄色
C.它是氯化氢的水溶液 D.紫色石蕊使盐酸变蓝色
10. 现有五种物质:1.二氧化硅,2.氧化铜,3.金属铁,4.碳酸钾,5.碳酸钡.其中不溶于水.但能与稀盐酸反应,并生成无色气体的是[ ]
A.1和4 B.1和3 C.3和5 D.4和5
11. 不能用硝酸银溶液检验含氯元素的化合物是 [ ]
A.盐酸 B.氯化钙 C.氯化钾 D.氯酸钾
12. 不能用稀酸和金属单质直接反应制得的物质,有下列中的 [ ]
A.MgCl2 B.Al2(SO4)3 C.ZnCl2 D.Fe2(SO4)3
13. 对于浓硫酸的稀释操作,现提出如下注意事项:①边稀释,边搅动溶液;②将水沿器壁加入到浓硫酸中;③稀释操作要缓慢进行;④可在量筒中,也可在烧杯中稀释,其中不正确的 [ ]
A.①和③ B.②和④ C.①、②和④ D.①、②和③
14. 下列各组反应中,都属于复分解反应的是 [ ]
①碳酸钠溶液加入石灰水 ②氯化镁溶液加入氢氧化钾溶液
③大理石与盐酸反应 ④灼热的四氧化三铁中通入一氧化碳
⑤灼热的木炭通入硫的蒸气
A.①②④ B.①③④ C.①②③ D.②③⑤
15. 要除掉二氧化硅中所含的杂质氧化镁,应采用的方法是 [ ]
A.加冷水使杂质溶解,经过滤去掉滤液
B.加酸使杂质溶解,经过滤去掉滤液
C.加碱使杂质溶解,经过滤去掉滤液
D.加热水使杂质溶解,经过滤去掉滤液
16. 下列氧化物中属于碱性氧化物,且能与水反应,水溶液pH>7[ ]
A.CuO B.Fe2O3 C.ZnO D.CaO
17. 下列四种物质中,在一定的条件下,其中一种与其它三种物质都能发生反应的是 [ ]
A.氯化铜 B.二氧化碳 C.氢氧化钠 D.硝酸
18. 下列哪一组物质全都不溶于水 [ ]
A.CaO、CaCl2、CaCO3 B.Cu、CuO、Cu(OH)2
C.SiO2、Fe(OH)3、AgNO3 D.Fe2O3、Mg(OH)2、K2SO4
19. 下列物质中,与盐酸,氯化铁溶液,碳酸钾溶液都能反应的是[ ]
A.氢氧化钠 B.硝酸钡 C.金属铝 D.氢氧化钡溶液
20. 下列各组中的两种物质相互反应时,可得到烧碱的一组是 [ ]
A.NaCl和Ca(OH)2 B.NaCl和CO2
C.Na2CO3和Ba(OH)2 D.AgCl和NaNO3
21. 下列物质不能和Hg(NO3)2溶液发生反应的是 [ ]
A.Ag B.Zn C.Fe D.Cu
22. 下列潮湿的气体能被固体氢氧化钠干燥的是 [ ]
A.CO2 B.CO C.SO2 D.H2S
23. 某溶液的pH值=6,要使pH值增大,可采用的方法是 [ ]
A.加浓盐酸 B.加入pH=2的溶液
C.蒸发水使溶液浓度增大 D.加氢氧化钠溶液
24. 下列各气体:①二氧化碳②氯化氢③氢气④氧气,其中不能用氢氧化钠进行干燥的有 [ ]
A.①和② B.①和④ C.③和④ D.①和③
25. 下列各组中两物质的溶液混合恰好完全反应并生成沉淀,将沉淀滤去后的溶液蒸发,可得到食盐晶体的是 [ ]
A.硫酸钠和氢氧化钡 B.氢氧化钡和氯化钾 C.硝酸银和氯化钡 D.氯化钡和硫酸钠
26. 下列物质中,能跟AgNO3溶液.CuSO4溶液.Na2CO3溶液反应,并都能生成白色沉淀的是 [ ]
A.盐酸 B.澄清石灰水 C.氢氧化钠溶液 D.氯化钡溶液 27. 用实验证明铜、银两种金属的化学活动性顺序,应选用的试剂是[ ] A.硫酸铜溶液 B.硝酸银溶液 C.硫酸锌溶液 D.稀硫酸
28. 有甲、乙、丙三种物质的溶液,甲与K2SO4溶液反应、乙与KCl溶液反应,丙与
KOH溶液反应均可生成KNO3,那么,甲、乙、丙应是下列各组中的 [ ]
A.甲为Ba(NO3)2,乙为AgNO3,丙为稀HNO3 B.甲为稀HNO3,乙为AgNO3,丙为NaNO3 C.甲为Ba(NO3)2,乙为NaNO3,丙为稀HNO3 D.甲为NaNO3,乙为稀HNO3,丙为AgNO3
29. 下列四种物质中,在一定情况下能与其它三种物质发生反应的是[ ] A.氯化铜 B.二氧化硅 C.氢氧化钠 D.硫酸 30. 金属元素M的相对原子质量为70,它在化合物中只有一种化合价.已知它的磷酸盐的相对分子质量为165,则它的硫酸盐的相对分子质量是 [ ]
A.166 B.236 C.428 D.无法计算
31. 下列各组变化中,后者一定包括前者的是: [ ]
A.化学变化、物理变化 B.还原反应、置换反应 C.氧化反应、化合反应 D.中和反应、复分解反应
32. 下列物质间不能发生复分解反应的是 [ ]
A.MgCO3+HCl B.KNO3+BaSO4 C.AgNO3+HCl D.NaOH+NH4Cl
33. 氯化钠溶液中混有少量氯化钙杂质,除去此杂质可选用适量的[ ]
A.稀盐酸 B.碳酸钠溶液 C.氯化钡溶液 D.硝酸银溶液
34. 下列物质中,能跟BaCl2、Al2O3、(NH4)2CO3都发生反应的是[ ]
A.CO2 B.H2SO4 C.CuSO4 D.KOH
35. 根据化学方程式: ①Ni+CuSO4=NiSO4+Cu
②Cu+2AgNO3=Cu(NO3)2+2Ag,
可知Cu、Ag、Ni(镍)三种金属的活动性由强到弱的顺序是 [ ]
A.Ni、Cu、Ag B.Cu、Ag、Ni C.Ag、Cu、Ni D.Ag、Ni、Cu
36. 欲使溶液中含有大量的Mg2+,K+,Cl-,NO3-,SO42-,(除去水电离出的微量H+和OH-外)不含其它离子,在蒸馏水中应加入 [ ]
A.AgCl、K2CO3、MgSO4 B.Na2SO4、Mg(OH)2、KCl C.MgCl2、KNO3、K2SO4 D.AgNO3、KCl、MgSO4
37. 下列各组物质在水中大量共存的是: [ ] A.MgCl2、HCl、Na2SO4、AgNO3 B.Ma2CO3、HCl、NaOH、CaCl2
C.NaCl、KNO3、NaOH、CaCl2 D.Ba(OH)2、Ba(NO3)2、Na2SO4、CaCO3
38. 下列各组物质混合在一起能进行反应,但不产生沉淀和气体的是[ ] A.生石灰和盐酸 B.氯化铁溶液和烧碱溶液
C.纯碱和硝酸 D.硫酸铜溶液和氢氧化钡溶液
39. 能把Na2CO3、Ba(OH)2、BaCO3、Mg(OH)2四种白色粉末一次区别开的试剂是 A.石灰水 B.稀硝酸 C.稀盐酸 D.稀硫酸 [ ] 40. 下列叙述正确的是 [ ]
A.制糖工业用活性炭使糖浆脱色的过程是化学变化 B.O2和O3(臭氧)是同种元素组成的不同单质 C.有多种物质生成的反应都是分解反应
D.构成离子化合物的阴、阳离子的总数一定相等
二、选择题二(有一个或二个正确答案)(每道小题 2分 共 10分 )
41. 既可以与盐酸反应,又可以与石灰水反应的物质有 [ ]
A.AgNO3溶液 B.NaOH溶液 C.Na2CO3溶液 D.AgCl
42. 相同浓度,相同质量的下列溶液,吸收CO2最多的是 [ ]
A.Ca(OH)2 B.Ba(OH)2溶液 C.NaOH溶液 D.KOH溶液
43. 最外电子层有3个电子的某金属M元素A克,使它与足量的稀硫酸反应,生成B克氢气,该金属元素的原子量为 [ ]
A、3A/B B、A/B C、A/3B D、3B/A
44. 某二价金属氧化物6.18克与足量稀硫酸完全反应后得到15克硫酸盐,则该金属氧化物的式量是 A.40 B.56 C.80 D.72 [ ] 45. 在稀硫酸中加入下列固体物质后,溶液的酸性不会显著减弱的是 [ ] A.氧化镁 B.碳酸钾 C.氯化钡 D.二氧化硅 三、填空题(1-4每题 2分, 5-6每题 6分, 共 20分)
46. 碳酸钠晶体(Na2CO3…10H2O)中,结晶水的质量分数是 ____________.
47. 既要除去氯化钾溶液中含有的少量碳酸钾,又不引入其它杂质,可加适量的 ____________,其化学方程式为 ___________________________.
48. 取少量白色的晶体放入一干燥试管内加热,试管壁上出现水珠.用湿润红色石蕊试纸置于管口,试纸变蓝色;把试管内产生的气体通入澄清的石灰水中,石灰水
变浑,此白色晶体名称为__________,白色晶体受热反应的化学方程式为
___________ ..
49. 将有一氧化碳、氯化氢和氮气的混合气体,先通过足量的氢氧化钙溶液,充分反应后剩余 ___________气体.再通过足量灼热的氧化铁,充分反应后还有 ____________气体.
50. 把两根铜丝分别放在酒精灯上加热使其表面变黑,这黑色物质是______,将其中一根插入盛有稀硫酸的试管里,溶液变成 __________色,化学方程式为___ ____;将另一根重新灼烧到红热,迅速插进盛有少量石灰水和 _____气的集气瓶里(用纸盖盖严瓶口,以免气体外逸);看到表面变黑的铜丝又恢复了原来的红色,同时石灰水变浑浊,化学方程式为 ______和 ______.
四、 简答题(第1小题 4分, 第2小题 6分, 共 10分)
51. 有硫酸钾、氢氧化钾、碳酸钾、氯化钾四种无色溶液,都可以和某些物质反应
生成化合物X,X是______.写出各反应的化学方程式.______ ________,________ ______,_______ ____,_________ ______.
52. 用化学方程式表示下列反应,并注明反应类型:
⑴氢氧化铁加热生成氧化物和水:____________________ ( )
⑵硫酐跟水:______________________ ( )
⑶铜片跟硝酸银溶液:________________________ ( )
⑷二氧化硫跟烧碱溶液:__________________________ ( )
⑸氢气跟灼热四氧化三铁:__________________________ ( )
⑹硝酸铜加热生成氧化铜、二氧化氮和氧气
______________________________________________ ( )
五、 计算题(1-2每题 5分, 第3小题 10分, 共 20分)
53. 欲制得12.8克铜,需要用硫酸铜与多少克含杂质2%的锌反应?(反应在溶液中进行)
54. 5克胆矾完全溶解在50克水中,所得溶液的质量分数是多少?
55. 取表面被氧化成氧化镁的镁片1.4克,跟53.9克10%的硫酸溶液恰好完全 反应,在标准状况下生成1.12升氢气(已知氢气密度是0.09克/升),
求:
(1)镁片上有氧化镁多少克?
(2)反应后溶液的质量分数是多
初中化学单元练习试题答案
一、 选择题一(只有一个正确答案)
1. A 2. D 3. D 4. B 5. C 6. C 7. D 8. C 9. D 10. C
11. D 12. D 13. B 14. C 15. B 16. D 17. C 18. B 19. D 20. C
21. A 22. B 23. D 24. A 25. D 26. D 27. B 28. A 29. C 30. C
31. D 32. B 33. B 34. B 35. A 36. C 37. C 38. A 39. D40. B
二、 填空题
1. 62.9%2. 盐酸(或HCl);K2CO3+2HCl=2KCl+H2O+CO2↑
3. A 4. N2,CO;N2,CO25. FeCl3 FeCl3=Fe3++3Cl-
A 6. CuO,蓝,CuO+H2SO4=CuSO4+H2O;CO;
A CO2+Ca(OH)2=CaCO3↓+H2O
三、 选择题二(有一个或二个正确答案)
1. AC 2. A 3. C 4. B 5. CD
四、 简答题
1. X是KNO3
K2SO4+Ba(NO3)2=BaSO4↓+2KNO3
KOH+HNO3=KNO3+H2O
K2CO3+2HNO3=2KNO3+H2O+CO2↑
K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
KCl+AgNO3=AgCl↓+KNO3
2. A
⑵SO3+H2O=H2SO4 化合反应
⑶Cu+2AgNO3=Cu(NO3)2+2Ag 置换反应
⑷SO2+2NaOH=Na2SO3+H2O 复分解反应
A
五、 计算题
1. 设x为需要纯锌的质量
Zn+CuSO=ZnSO+Cu
65 64
x 12.8克
A
需要含杂质2%的锌13.3克
2. 解:5克胆矾中含无水CuSO4的质量为:
A 所得溶液的百分比浓度为:
A 3. (1)0.2克(2)12%
