分子式:KNO3
分子量:101.11
性状:硝酸钾为无色透明斜方晶体或粉末,有潮解性。相对密度2.1109,熔点333℃,易溶于水,溶于乙醇和甘油,不溶于无水乙醇。有强氧化性,与有机物接触、摩擦或撞击能引起燃烧或爆炸。
用途:用作分析试剂,如氧化剂、助熔剂。用于合成钾盐、制造火药、火柴及玻璃生产。还用于显像管生产及电镀行业。
包装:25公斤内塑外编袋包装,或按客户要求
中学用结晶法制备和提纯晶体常用的方法有蒸发结晶,升温结晶、降温结晶和重结晶。晶体的析出过程并非纯粹是一个简单的物理过程,还应考虑干燥过程中酸的挥发,结晶水的丢失,产品本身在高温时易产生的水解、分解或氧化问题。
硝酸钾晶体的制备
步骤:
称取NaNO3和KCl晶体,加少量蒸馏水,小火加热使其中的盐全部溶解,再继续小火加热蒸发至有较多晶体析出,趁热过滤,得KNO3饱和溶液并和NaCl晶体。自然冷却晶体析出(大量的硝酸钾和极少量氯化钠结晶得KNO3晶体,抽滤,用少量饱和KNO3溶液淋洗晶体,晶体置于蒸发皿中烤干,重结晶(加适量水溶解,加热沸腾即止,冷却结晶,抽滤,用饱和KNO3淋洗,在表面皿中水浴烘干) 。
[角度] 本实验都涉及哪些基本操作,应注意什么?
1. 制备硝酸钾的原理?
解析:NaNO3 + KCl = NaCl + KNO3
因为随温度的变化,硝酸钾与氯化钠溶解度的变化不同,硝酸钾随温度升高,溶解度增加很多;而氯化钠随温度升高,溶解度变化很小。所以混合液经蒸发、浓缩后,首先析出氯化钠,趁热过滤除去氯化钠,将已有晶体析出的滤液加沸水溶解,适当蒸发,冷却,析出硝酸钾。
2. 为什么小火加热蒸发?
解析:溶液沸腾后,应调节火焰至小火,以防液体爆沸溅失。
3. 减压过滤(抽滤)和趁热过滤操作都使用的一种主要仪器及作用是什么?
解析:仪器是布氏漏斗,
抽滤:是一种快速过滤法,适用于易溶晶体的分离,若固体需要洗涤,将少量溶剂洒到固体上,静置片刻,再将其抽干。
趁热过滤:目的是防止溶液中的硝酸钾晶体析出。
(如果溶液中的溶质在温度下降时容易析出大量结晶,而我们又不希望它在过滤过程中留在滤纸上,这时就要趁热进行过滤。热过滤有普通热过滤和减压热过滤两种。)
4.预热的目的和方法是什么?
解析:预热的目的是防止冷却析出结晶。
预热方法:将漏斗放在水浴中加热至微沸。
5. 什么情况下需用热过滤法进行固、液分离?
解析:当需要除去热浓溶液中的不溶性杂质,又不能让溶液析出时,一般采用热过滤法。
6.为什么用少量饱和KNO3溶液淋洗晶体?
解析:因硝酸钾的溶解度较大,若用纯水洗涤晶体溶解较多。根据沉淀溶解平衡原理,用少量饱和KNO3溶液淋洗可防止硝酸钾晶体溶解。
7.重结晶的主要步骤及各步的主要目的?
解析:可溶性晶体物质可用重结晶法除去微量杂质
(1)将不纯固体样品溶于适当溶剂: 目的是制成热的近饱和溶液;
(2)将此溶液趁热过滤: 目的是除去不溶性杂质;
(3)将滤液冷却:目的是使结晶析出;
(4)抽气过滤:目的是使晶体与母液分离。
(5)洗涤干燥:目的是除去附着母液和溶剂。
8.若采用重结晶除杂,蒸发温度应控制在什么范围内?
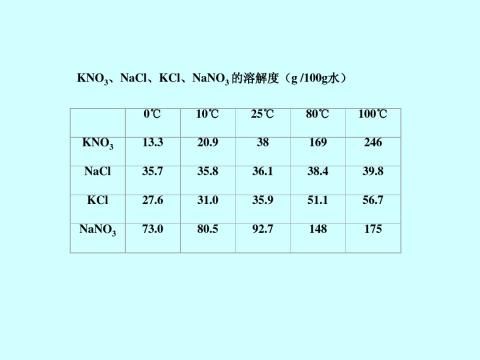
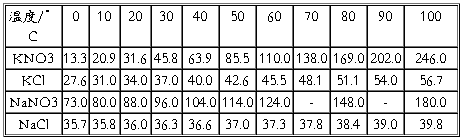
解析:80℃~100℃(参考下表溶解度数据)
四种盐在不同温度下的溶解度/(g/100g水)

9、为什么采用水浴烘干?
解析:防止硝酸钾高温分解。(分解温度380℃)
10、如何检验产品纯度?
解析:0.1g晶体KNO3+2ml水+2滴AgNO3溶液,无白色 AgCl↓
1.何谓重结晶?本实验都涉及哪些基本操作,应注意什么?
2.制备硝酸钾时,为什么要把溶液进行加热和热过滤?
3.试设计从母液提取较高纯度的硝酸钾晶体的实验方案,并加以试验。。
进行产品纯度检验时,应将粗产品和重结晶产品一起检验,进行对比观察。哪个溶液中的浑浊度浅,说明哪个溶液中的Cl-较少。一次重结晶后的产物中还有少量Cl一存在,甚至第二次重结晶后还能检出Cl-。这主要是由于在KNO3晶体长大过程中,Na+和Cl一被包在晶体里,或长大过程中晶体表面不断吸附这些离子造成的,通过多次重结晶能在一定程度上除去杂质,提高产品纯度。
硝酸钾的制备
一.实验目的
1.掌握无机制备中常用的过滤法,着重介绍减压过滤和热过滤。
2.练习加热溶解、蒸发浓缩、结晶等基本操作。
二.实验原理
1.KCl+ NaNO3=KNO3 +NaCl
2.当KCl和NaNO3溶液混合时,混合液中同时存在,由它们组成的四种盐,在不同的温度下有不同的溶解度,利用NaCl、KNO3的溶解度随温度变化而变化的差别,高温除去NaCl,滤液冷却得到KNO3。
表2.1.1 四种盐在水中的溶解度(g/100g H2O)
三.主要仪器与试剂
1 仪器 烧杯 量筒 热过滤漏斗 减压过滤装置 电子天平。
2 试剂 NaNO3(s)、KCl(s)。
四.操作步骤

五.实验结果及分析
结果:1.上述得到的粗KNO3产品重量为:6.7g
2.重结晶后得到的产品重量为:5.00g
分析:1. KCl + NaNO3 = KNO3 + NaCl
75 85 101 59
7.5g 8.5g 10.1g 5.9g
★最后体积为:(15*2/3+7.5)*3/4=13.1
★母液中留有的硝酸钾: 21.2g/100g*13.1g=2.8g
★(在283k时的KNO3溶解度为21.2g/100g水)
★本实验粗产品的理论产量是:10.1g-2.8g=7.3g
★粗产品的产率为:6.7/7.3*100%=91.8%
2 . 理论重结晶率为:(167g-21.2g)/167g*100%=87.3%
实际重结晶率为:5.0 /6.7*100%=74.6%
(在353k时的溶解度为167g/100g水)
六.问题及思考题
●问题:1.产品的主要杂质是什么?怎样提纯?
答:主要杂质是NaCl,可以通过重结晶来提纯。
2.能否将除去氯化钠后的滤液直接冷却制取硝酸钾?
答:不能。滤液直接冷却可以得到较多的硝酸钾,但会混氯化钠,产品纯度下降。
3.考虑在母液中留有硝酸钾,粗略计算本实验实际得到的最高产量。
答:设室温为293K,此时硝酸钾的溶解度为31.6g/100g水,氯化钠的溶解度为36g/100g水,则10mL水可溶解硝酸钾3.2g ,氯化钠为3.6g ,则析出硝酸钾为10.1-3.2 = 6.9g ,氯化钠为4-3.6 = 0.4g ,故共析出7.3g晶体。10.1-21.2*13.1=7.3g
●思考题:1.怎样利用溶解度的差别从氯化钾,硝酸钠制备硝酸钾?
答:NaCl和NaNO3溶液混合时,混合液中同时存在,由它们组成的四种盐,在不同的温度下有不同的溶解度,从利用NaCl、KNO3的溶解度随温度变化的曲线图看出:NaCl的溶解度随温度的变化不大,而KNO3的溶解度随温度的变化而显著变化,所以高温除去NaCl,滤液冷却得到KNO3。
2.实验成败的关键在何处,应采取哪些措施才能使实验成功?
答:在本实验中,热过滤是关键。因此要使实验成功,先准备好合
的滤纸,加热水浴预热漏斗;加7.5mL水在小烧杯内,盖上小
面皿。然后溶解盐,蒸发、浓缩。
七.注意事项
1.热蒸发时,为防止因玻棒长而重,烧杯小而轻,以至重心不稳而倾翻烧杯,应选择细玻棒,同时在不搅动溶液时,将玻棒搁在另一烧杯上
2. 若溶液总体积已小于2/3,过滤的准备工作还未做好,则不能过滤,可在烧杯中加水至2/3以上,再蒸发浓缩至2/3后趁热过滤。
3.要控制浓缩程度,蒸发浓缩时,溶液一旦沸腾,火焰要小,只要保持溶液沸腾就行。烧杯很烫时,可用干净的小手帕或未用过的小抹布折成整齐的长条拿烧杯,以便迅速转移溶液。趁热过滤的操作一定要迅速、全部转移溶液与晶体,使烧杯中的残余物减到最少。
4. 趁热过滤失败,不必从头做起。只要把滤液、漏斗中的固体全部回到原来的小烧杯中,加一定量的水至原记号处,再加热溶解、蒸发浓缩至2/3,趁热过滤就行。万一漏斗中的滤纸与固体分不开,滤纸也可回到烧杯中,在趁热过滤时与氯化钠一起除去
第二篇:02 复分解法制备硝酸钾