化学教学论实验
——电解质溶液实验报告
学院:化学化工学院
班级:10级化教班
组:第八组
组员:###
电解质溶液
一、实验目的
1、了解电解质溶液的化学原理,电极发生的氧化还原反应及其产物;
2、掌握离子迁移、电解水、电解饱和食盐水与电解氯化铜的实验演示技能;
3、以及探究浓度、电压、电极对电解质溶液电解速率的影响。
二、实验原理
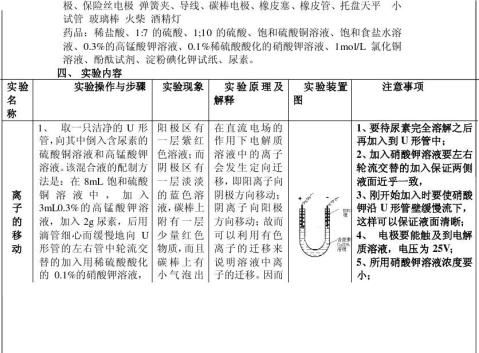
电解质溶液在直流电场的作用下,溶液中的离子发生定向移动,即阴离子向阳极方向移动,阳离子向阴极方向移动。可以利用某些有色离子(如Cu2+ ,MnO4-等)的迁移来演示说明溶液中离子的迁移。
氯化钠溶液在直流电场作用下,阳离子(即Na+和H+)移向阴极,阴离子(即Cl-和OH-)移向阳极。
阳极反应:2Cl- - 2e==Cl2↑(氧化反应)
阴极反应:2H+ + 2e==H2↑(还原反应)
总化学反应式:2NaCl+2H2O==2NaOH+H2↑+Cl2↑
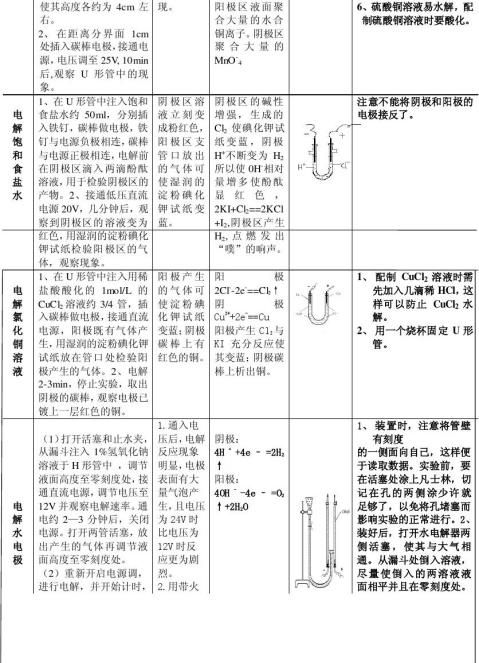
电解水的原理: 阴极:4H﹢+4e﹣=2H2↑
阳极:4OH﹣-4e﹣=O2↑+2H2O
电解氯化铜溶液就是电解氯化铜本身:
阳极:2Cl--2e-==Cl2↑
阴极:Cu2++2e-==Cu
总反应方程式为:CuCl2 =Cu + Cl2 ↑
三、 实验用品
仪器和材料:自制H形管(具支的滴定管)、小烧杯、U形管、漏斗、量筒、尖嘴玻璃管、滴定管、直流稳压电源、铁架台及附件、铁钉电极、回形针电极、保险丝电极 弹簧夹、导线、碳棒电极、橡皮塞、橡皮管、托盘天平 小试管 玻璃棒 火柴 酒精灯
药品:稀盐酸、1:7的硫酸、1;10的硫酸、饱和硫酸铜溶液、饱和食盐水溶液、0.3%的高锰酸钾溶液、0.1%稀硫酸酸化的硝酸钾溶液、1mol/L氯化铜溶液、酚酞试剂、淀粉碘化钾试纸、尿素。
四、 
实验内容


五、思考题
1. 向溶液中加入尿素的作用?是否可用其他物质代替?
答:1、加入尿素的作用是增加溶液的比重,使混合液和硝酸钾界面更加清晰;2、可以用其他物质代替,需满足的条件是:a.非电解质;b.与KMnO4和CuSO4均不反应;c.溶于水;d.无色物质,如蔗糖可以作为代替物。
2.在做电解饱和食盐水是为什么要向溶液中加入用稀硫酸酸化过的0.1%的硝酸钾溶液,而且要左右轮流交替的加入?
答:第一,选择1%的硝酸钾溶液的原因有三点:①硝酸钾溶液没有颜色,便于观察有色离子的移动;②硝酸钾溶液不参与电解;③1%的硝酸钾溶液密度比较小,可以使界面保持清晰。
第二,由于电解作用,会使得铜离子移动到1%的硝酸钾溶液中,铜离子易水解形成氢氧化铜絮状沉淀,为此需要进行酸化抑制其水解。而用稀硫酸是因为硫酸根离子不参与电解。
第三,轮流交替在U型管中加入1%的硝酸钾溶液的目的是为了让两边液面一样高,便于观察离子移动。
3.电解饱和食盐水时,为什么在阴极区滴加酚酞试液后溶液会变为红色?
答:阴极区因H+发生电解反应而被消耗,故OH-浓度增大,滴入酚酞后溶液变红。
4.电解饱和食盐水时为何碳棒作阳极,铁片作阴极?
答:因为在酸性条件下:Fe2++2e-=Fe, ø=-0.409V , 在碱性条件下Fe(OH)2+2e-=Fe+2OH-,ø=-0.877V,在阳极区:4OH-= O2+ H2O+ 4e- ,ø=+0.401V,Cl+2e=2Cl;ø=+1.3583V。
若用铁作阳极,无论在酸性还是碱性条件下,都是电极本身放电,即电极本身参与了反应而被消耗,因此,电解时往往用惰性导电材料作为阳极。
5.分析电解水,所得H2和O2比例偏离2:1的因素?
答:电解水,所得氢气和氧气体积比值偏离2:1主要是由于氧气体积偏低,造成氧气体积偏低的主要原因是由于副反应所造成的:
阴极:2H2SO4 == 2H+ + 2HSO4—
阳极:2H+ +2e— = H2
H2S2O8+ H20=H2SO4 + H2SO5
H2SO5 + H20=H2SO4 + H2O2
阳极处所生成的过氧化氢在酸性溶液里比较稳定,不易分解出氧,所以氧气的体积就偏低了。第二个原因就是氢气与氧气在水溶液中有一定的溶解度。1体积水可溶解0.02体积的氢气,0.03体积的氧气,氧气比氢气在水中的溶解度大。
6.电解水时采取什么措施,使得体积比接近2:1?
答:1由于H2和O2在都有一定的溶解度,所以记时前应该先接通电源电解几分钟左右,使H2和O2在溶液中达到饱和,打开活塞,放出所产生的气体,然后再进行后续电解;2每次电解时都必须将电极打磨;3读数时一定要准确,视线与液体凹液面平行。
7.探索电解水时电解质溶液浓度和电压的最佳条件?
答:根据记录的数据,比较几种不同材料作电极,不同溶液作电解质溶液的电解水产生气体的体积,可以清楚的看出,当电解质溶液浓度相同时(即都是1%的NaOH(aq)),电压为24V,产生的H2和O2的体积比更接近理论值。
当电极相同时,电解质溶液浓度不同,电压相同时,浓度小的实验结果更接近理论值,适宜浓度为:1:10的HSO4;
当电极相同,电解质溶液浓度相同,而电压不同时,电压大的实验结果更接近理论值,适宜电压:24V.
实验反思
在这次实验准备过程中,由于四个电解实验,每个实验都只做了一遍,导致在给学生讲解实验时,以及解决一些实验过程中的突发事件时,并没有及时,正确,妥善地处理好。
由于一些粗心,在做电解饱和氯化铜的试验时,电极的正负装反了,导致实验过程中没有出现现象。
在探索的过程中,我们小组发现问题,提出问题,齐心协力,合作交流解决问题,将团队精神发挥得很好,我们互相学习,在本次试验过程中受益很大。
电解质溶液实验总结:
(一)、作过程中出现的问题:
1、在做离子迁移的实验时,我们强调在滴加KNO3溶液时要轮流交替的沿U型管壁滴加但有的同学还是悬空滴加,甚至有个别同学边加边振荡。
2、在做电解水的实验时,有个别小组把装置还没有装好就加电解质溶液,导致溶液洒在实验桌上。
3、在检验阴、阳极产物时,把产物弄混,检验不出现象。
(二)、预习报告中出现的问题:
1、预习报告中有些同学还在写实验准备,实验准备只需实验准备小组同学写,其他人不需要写。
2、做完实验后个别同学没有完善预习报告中的实验现象。
(三)、实验报告中出现的问题:
1、实验时所用KMnO4溶液是0.3%的,但大多数同学写的是0.5%。
2、很多同学没有把电解水的实验步骤写完,只写了电解NaOH溶液,没有写换电极、换电解质溶液的过程。
3、有个别同学在实验现象与现象解释后写的是同上。
4、实验装置图只画一个,其他的不画,写的是同上。
5、离子方程式书写不正确。
7、有些同学没有写实验总结和实验反思。
总的来说大家的实验报告完成的不错,在实验操作过程中也没有出现大的问题。在大家的积极配合下我们小组的实验也比较成功的完成。
第二篇:电解质溶液及配位化合物 实验报告
西安交通大学实验报告
课 程 大学化学实验 实验名称 电解质溶液及配位化合物
系 别 电气 实 验 日 期 2011年11月11日
专业班号 钱学森12 组别 二 交报告日期
姓 名 ## 学号 ##
同 组 者 陈思成 戴威尔 董世豪 教师审批签字
一、实验目的
(1)了解共同离子对弱电解质和强电解质(易溶挥和难溶)溶液的影响。
(2)了解缓冲溶液的配制和性质。
(3)了解溶液淀的生成,溶解和转化原理。
(4)了解配离子的形成和配离子与简单离子的区别。
(5)了解配离子的解离平衡及不稳定常数。 。
(6)了解盐类水解和影响盐类水解的因素。
二、实验原理
弱电解质在水中.其分子电离成离子的过程是可逆的,当这两个相反过程的速率相等时,就达到电离平衡,此时如果增加某种离子的浓度,平衡就向减少该离子浓度的方向移动。在强电解质的饱和溶液中加入含有共同离子的电解质时,这种电解质的溶解度降低。
弱酸或弱酸盐所组成的溶液,弱碱或弱碱盐所组成的溶液称为缓冲溶液
假如某缓冲溶液由弱酸和它的盐组成,则它的pH值计算方法如下:

由此式可知,缓冲溶液的pH值除主要决定于a外,同时也随盐和酸浓度的比值而变化。从配制溶液时所用弱酸。弱酸盐及弱酸的电解常数即可计算出该缓冲溶液的pH值。本实验中用pH测试仪及pH试纸来实测所配制的醋酸-醋酸盐缓冲溶液的pH值,并与计算值
相比较。由于溶液中存在电离平衡.当缓冲溶液中加入少量酸或碱时。溶液的pH值不会发生显著的变化。
在难溶电解质饱和溶液中。当温度一定时。其离子浓度的乘积等于浓度积,当溶液
中存在的某几种离子均能与加入的某种试剂生成沉淀时,其离子浓度乘积首先达到浓度积的化合物首先沉淀。如果在NaCl和K2CrO4的混合溶液中 : c(Cl-)=c(CrO4 2-)=0.1 mol/L,逐滴加入AgNO3时,逐滴加入AgNO3溶液时.可能发生下列反应:
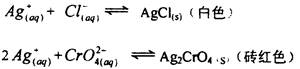
它们的溶度积数值:
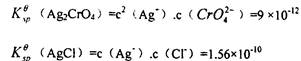
用溶度积原理可以计算出开始生成AgCl与Ag2Cro4沉淀时所用银离子最低浓度,通过计算可以说明AgCl首先沉淀。然后当Ag+溶度逐渐增大时,Ag2Cr04沉淀才出现。
对相同类型的的难溶电解质,如AgCI与Agl,可根据溶度积的大小.直接判断沉淀的先后及沉淀向溶解方向转化的易难。
另外,还可以根据溶度积原理,沉淀的溶解与转化成另一种溶解度更小的沉淀的情况,如要是沉淀溶解,只需加入某种试剂,降低溶液中一种离子的浓度。使其离子浓度相应方次乘积小于溶度积,就能使沉淀向溶解的方向转化。
由于副族元素有(n-1)d、ns、np等空轨道存在,因此,它们可以容纳配位体给予的电子对形成配离子,如[Ag(NH3)2]+、[Cu[NH3]4]2+、[AgI4]3-一等等。形成配离子以后,简单离子的性质就发生了变化。
含有配离子的化合物称为配合物,它在溶液中能解离:
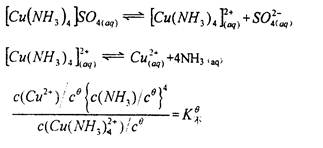
对具有相同配位数的配离子,K 越大,表示该配离子越不稳定:K 越小,表示该配离子越稳定,不易解离。
如
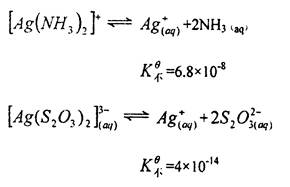
因此,在相同条件下,[Ag(NH3)2]+溶液中Ag浓度远远大于[Ag(S2O3)]3-溶液中Ag+的浓度
盐类水解造酸碱中和的逆反应,水解后溶液的酸碱性取决于盐的类型。由于水解是吸热反应,因此升高温度,有利于水解的进行。
两种都能水解的盐,如果其中一种水解后溶液显酸性,另一种水解后溶液显碱性,当这两种盐溶液相混合时.可以彼此加剧水解。
三、仪器与药品
1.仪器
2.药品
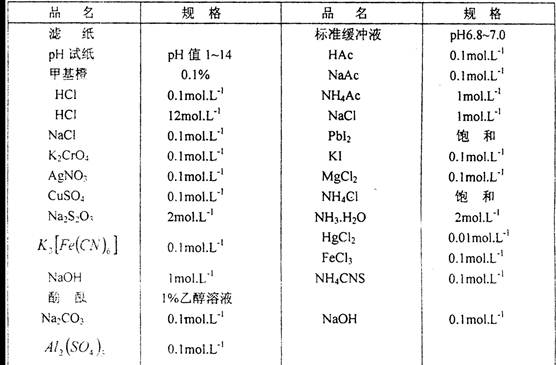
*pH值等于6.8的缓冲溶液,可用0.2 mol/L磷酸氢二钠溶液49mL和0.2 mol/L磷酸二氢钠溶液51mL混合配制而成。
四、实验步骤
1.强弱电解质的区别
取两支试管,在第一支试管中加入O.1 mol/L。HAc溶液5滴,甲基橙溶液l滴,记录其颜色,再滴入1 mol/L NH4Ac溶液1滴,观察其颜色变化。在第二支试管中加入0.1 mol/L HCI溶液5滴,甲基橙溶液1滴,记录其颜色,再滴加1mol/L NaCl溶液l滴。观察其颜色变化。
2.缓冲溶液的制备及溶液pH值的测定
(1)缓冲溶液的配制:用量筒量取溶液0.1 mol/L HAc 10ml 及0.1 mol/L NaAc溶液10mL于50mL小烧杯中,混合均匀即制成某pH值的缓冲溶液。用试纸测定该溶液的pH值。
(2)用pH测试仪精确测定所配制缓冲溶液的pH值并与用pH试纸测定值及理论值进行比较。
(3)缓冲溶液的缓冲性能:在上述配好的缓冲溶液中加入0.5mL(约10滴)
0.1mol/L NaOH溶液,用pH测试仪测定其pH值,再加入l mL(约20滴)
溶液,再用pH测试仪测定其pH值。
3.溶度积规则的应用
(1)沉淀的先后:在一支试管中加入 0.1 mol/L NaCl和 0.1 mol/L K2CrO4溶液各2滴,然后在振荡的情况下逐滴加O.1 mol/L AgNO3溶液5滴(小心不要滴在试管壁上)。记录沉淀的颜色变化,用溶度积原理解释之。
(2)同类型难溶电解质溶度积比较
取2支试管:每支试管加入0.1 mol/L AgNO3溶液2滴,在其中一试管中加入0.1 mol/L NaCl溶液2滴.另一试管中加入O.1 mol/L KI溶液2滴摇匀,观察AgCl白色沉淀和Agl黄色沉淀的生成,然后在沉淀中各加入2 mol/L 氨水2~3滴,观察二试管中沉淀溶解的情况有何不同.
(3)沉淀的溶解:在一试管中加入0.1 mol/L MgCl2溶液3滴,1 mol/L NaOH溶液2滴,观察现象,再加入饱和的NH4Cl溶液2滴,观察现象。
(4)沉淀的转化,在一支试管中加入O.1 mol/L K2Cr04溶液2滴,再加入0.1 mol/L AgNO3溶液4滴使砖红色Ag2Cr04沉淀完全,再加入0.1 mol/L NaCI溶液4~6滴,摇匀,使砖红色沉淀转化为白色的AgCl沉淀。
4.配合物的形成和性质
(1)正负配离子的形成
①[Ag(NH3)2]+的形成:在一试管中加入约1毫升0.1 mol/L AgN03溶液,再逐滴加入2 mol/L NH3H20溶液,每加一滴均应充分摇荡试管,观察褐色Ag2O沉淀的生成,再滴加2 mol/L NH3H20溶液,直到沉淀溶解.即得含有 [Ag(NH3)2]+的溶液。
② [Cu(NH3)4]2+ 的形成:在一试管中加入10滴0.1 mol/L CuSO4溶液,逐滴加入2 mol/L NH3H20溶液,观察浅蓝色Cu(OH)2沉淀的生成.再逐滴加入2 mol/L NH3H2O溶液,直到沉淀溶解而溶液转变为深蓝色,即得含有 [Cu(NH3)4]2+的溶液。
③[HgI4]2-的形成:在一试管中加入5滴0.01 mol/L HgCl2溶液,逐滴加入0.1 mol/L KI溶液,观察桔红色HgI2沉淀的生成,再逐渐加入O.1 mol/L KI溶液,直到沉淀溶解,即得含有[HgI4]2-的溶液。
(2)简单离子与配离子性质比较
Fe 3+与[Fe(CN)6]3-和NH4SCN的作用。
在一支试管中加 1 毫升O.1 mol/L FeCl3溶液在另一支试管中加入1mLO.1 mol/L K 3 [Fe(CN)6] 溶液,然后分别加人1滴NH4SCN,观察两试管中的变化。
(3)配离子稳定性的比较
[Ag(NH3)]2+与[Ag(S2O3)2]3-稳定性的比较
取一支试管加入O.1 mol/L AgN03溶液2滴,在逐滴加入2 mol/L氨水5滴即制得含有[Ag(NH3)2]+的溶液。
另取试管一支加入O.1 mol/L AgNO3溶液2滴,再逐滴加入2 mol/L Na2S2O3溶液5滴,制得含有[Ag(S2O3)2]3-的溶液。
将上述制得的-二种配合物溶液各加入O.1 mol/L KI溶液1滴,观察二试管中现象。
5.盐的水解
(1)在一支试管中加入O.1 mol/L NaAc溶液1mL,用pH试纸测pH值,再加入1滴酚酞溶液。然后用酒精灯加热,观察试管中颜色。
(2)取1支试管,加入2mL0.1 mol/L Al2(SO4)3溶液,用pH试纸测pH值,再加入3mL0.1 mol/L Na2CO3溶液,观察现象。
五、实验结果
(1) 强弱电解质的区别
(2) 缓冲溶液的制备及溶液pH值的测定
1.缓冲溶液的配制
0.1mol/L HAc 10ml +0.1mol/L NaAc 10ml
2.溶液的性能

(3)溶度积规则应用