1杂化有利于共价键的形成
2电负性:S 的成份越多,电负性越大, sp>sp2>sp3
3键的极性:组成共价键的两个原子间共用电子对的电子云的分布
4非极性(对称)共价键:同种(电负性相同)原子形成的,电子云对称分布
5极性(不对称)共价键:不同种(电负性不相同)原子形成的,
电子云靠近电负性较大的原子,带部分负电荷(用δ-表示);
电负性较小的原子则带部分正电荷(用δ+表示)。
6成键原子的电负性相差愈大,键的极性愈强。
7电负性顺序:F>O>Cl>Br,N>C>H
8偶极矩μ (单位:德拜D/ C?m )
v μ =q.d
v q :正电荷或者负电荷中心电量, 单位:C
v d :正负电荷中心间距离 单位:m
v 偶极距是向量(矢量),用一箭头表示指向键的负电荷端
6 双原子分子:非极性键--非极性分子 极性键 --极性分子,
多原子分子:分子的极性是各键极性(偶极矩)的向量和。
正负电荷的中心重叠,则 μ=0 ,非极性分子
正负电荷的中心不重叠,则 μ ≠ 0 ,极性分子
7极化性:在外电场影响下,共价键的电子云密度重新分布,键的极性发生变化。
8极化度:键极化的难易程度
v 极化度与成键原子的体积、电负性、键的种类、外电场强度有关。
…… …… 余下全文

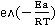
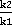 =
=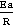 *
*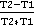
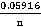 lg
lg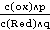 (298.15k)
(298.15k)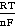 lg
lg
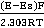 其中pHs为缓冲溶液的pH,Es为参比电极的电势。
其中pHs为缓冲溶液的pH,Es为参比电极的电势。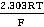 pH玻璃电极的电势计算
pH玻璃电极的电势计算