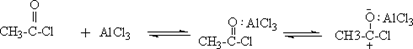实验五 苯乙酮的制备
一、 实验目的:
1、了解傅-克酰基化反应制备芳酮的一般原理,学习苯乙酮的制备方法;
2、学会电磁搅拌器的作用,掌握有毒气体的处理方法。
二、 实验原理:
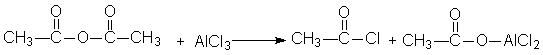
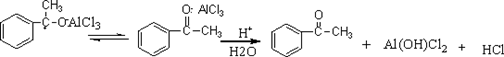
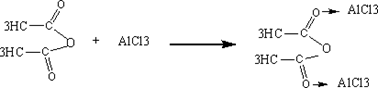
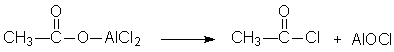
芳酮可通过苯与酸酐或酰卤在路易期酸的作用下反应来制备。因此在实验室中我们可用苯、乙酸酐和无水三氯化铝来制备苯乙酮:
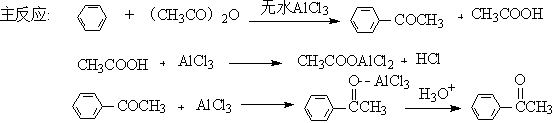
1、催化剂的用量大,乙酸酐:AlCl3=1:2.2。
2、反应体系必须严格无水,否则三氯化铝水解失效。
3、产物有有毒气体氯化氢,故装置应考虑吸收。
4、反应放热,且要反应完全,还需加热,反应体系温度高于反应物和溶剂沸点,故应采用回流、滴加装置。
三、 主要试剂与产物的物理常数

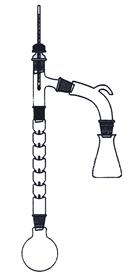
四、实验装置(如图)
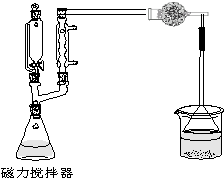
锥形瓶中装搅拌子,锥形瓶上装二通管,一颈装恒压漏斗,一颈装球形冷凝管;冷凝管上端横装干燥管,后装长颈漏斗,用碱液吸收。
五、操作步骤
向装有恒压滴液漏斗、电磁加热搅拌器和回流冷凝管(上端通过一氯化钙干燥管与氯化氢气体吸收装置相连)的50 mL三颈(或二颈)烧瓶中迅速加入研细的6.0g无水三氯化铝和8.0mL无水苯。在电磁搅拌下自滴液漏斗慢慢滴加2 mL乙酐(加2 mL苯稀释),开始少加几滴,待反应发生后再继续滴加,切勿使反应过于激烈,滴加速度以烧瓶稍热为宜。加完后(约需10~15min),待反应速度稍缓和后,水浴加热回流,直到不再有氯化氢气体逸出为止。
将反应混合物冷却到室温,在搅拌下倒入12.5mL浓盐酸和12.5 g碎冰的烧杯中(在通风橱中进行)。若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用5mL苯(也可用石油醚)萃取两次,合并有机层,依次用5 mL10%氢氧化钠、5 mL水洗涤,有机层用无水硫酸镁干燥。将干燥后的反应混合物在水浴上蒸馏回收苯(或蒸出苯和石油醚),然后在石棉网上加热蒸去残留的苯,稍冷却后改用空气冷凝管,蒸馏收集195-202℃馏份,产量约为1-1.2 g。
…… …… 余下全文


 C6H5CHO + CH3COC6H5 C6H5CHOHCH2COC6H5 C6H5CH=CHCOC6H5
C6H5CHO + CH3COC6H5 C6H5CHOHCH2COC6H5 C6H5CH=CHCOC6H5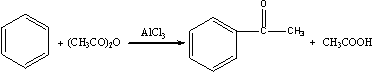

 C6H5CHO + CH3COC6H5 C6H5CHOHCH2COC6H5 C6H5CH=CHCOC6H5
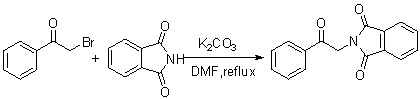
C6H5CHO + CH3COC6H5 C6H5CHOHCH2COC6H5 C6H5CH=CHCOC6H5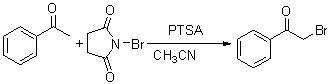

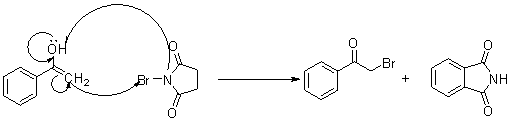

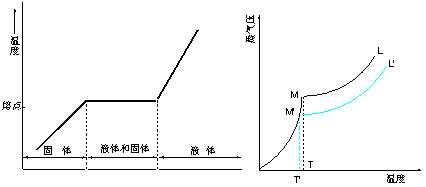
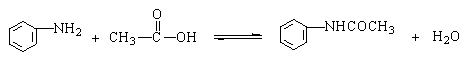
 在不断搅拌下将反应混合物趁热以细流慢慢倒入盛有100mL冷水的烧杯中。继续剧烈搅拌,并冷却烧杯,使粗乙酰苯胺成细粒状完全析出。用布氏漏斗抽滤析出的固体。用玻璃塞把固体压碎,再用5~10mL冷水洗涤以除去残留的酸液。把粗乙酰苯胺放入150mL热水中,加热至沸腾。如果仍有未溶解的油珠[3],需补加热水,直到油珠完全溶解为止[4]。
在不断搅拌下将反应混合物趁热以细流慢慢倒入盛有100mL冷水的烧杯中。继续剧烈搅拌,并冷却烧杯,使粗乙酰苯胺成细粒状完全析出。用布氏漏斗抽滤析出的固体。用玻璃塞把固体压碎,再用5~10mL冷水洗涤以除去残留的酸液。把粗乙酰苯胺放入150mL热水中,加热至沸腾。如果仍有未溶解的油珠[3],需补加热水,直到油珠完全溶解为止[4]。