物理化学总结
一、简史
随着化学与物理学两个学科的发展,二者之间相互结合渗透并吸收其他学科(如计算机、数学等)的科研成果逐步形成比较成熟的现代的物理化学。热力学第一定律和第二定律被广泛地应用于化学系统 。1840年,盖斯(Hess)建立了热化学定律。1876年,美国的化学家吉布斯(Gibbs),对化学热力学贡献最大,引出了吉布斯自由能,定义了化学势,形成一套完整的处理方法,对相平衡、化学平衡等进行了严密地数学处理。1884年范特荷夫(Van't Hoff),创立了稀溶液理论,推导出化学平衡的等温方程式。1886~1893年间F.M.拉乌尔发表了关于系列物质蒸气压与溶液浓度、溶液凝固点与温度方面论文提出了拉乌尔定律和非挥发溶质溶剂凝固点降低规律。J.W.吉布斯对多相系统平衡的研究并建立了相律,奠定了化学热力学重要理论基础。1886年,阿仑尼乌斯(S.Anhencus)建立电离理论,揭了电解质水溶液的本性。在化学动力学上作出很大贡献。提出了阿仑尼乌斯方程式。1906年能斯特(W.Nernst)发现了热定律,建立了热力学第三定律,他还对电化学作出很大的贡献,提出了能斯特方程。。化学热力学基本理论已经臻于成熟。
二、物理化学的特殊研究方法:
1、热力学方法。以热力学二个定律为基础,研究宏观体系。
2、统计力学方法。以几率定律为基础,核心是配分函数,是微观方法。
3、量子力学方法。以薛定谔方程为基础,是微观方法。
三、学习内容
1、关于热力学定律和热力学基本方程
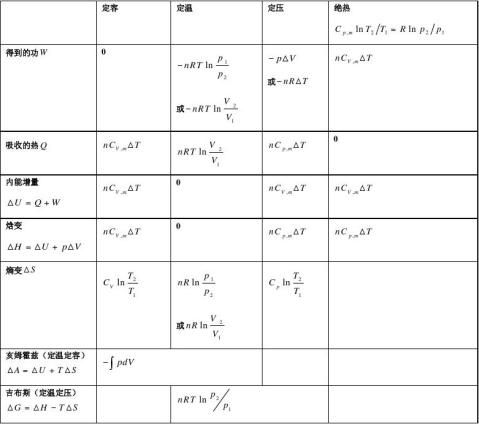
热力学基本方程是热力学理论框架的中心热力学基本方程将p、V、T、S、U、H、A、G 等八个状态函数及其变化联系起来,它是一种普遍联系,可以由一些性质预测或计算另一些性质。
主要公式:热力学第一定律: △U=Q—W 焓 H=U+pV
…… …… 余下全文



 表示环境向系统传热。
表示环境向系统传热。 表示环境对系统做功。
表示环境对系统做功。
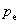 表示环境的压力。
表示环境的压力。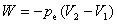
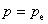 ,p为系统的压力,则有
,p为系统的压力,则有 

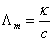

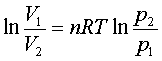
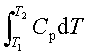
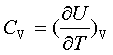 ;
;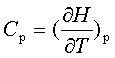
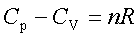
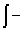 pedV
pedV ; ΔH=
; ΔH=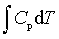
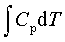 ; ΔU=
; ΔU=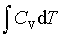
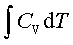 ;ΔH=
;ΔH=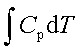
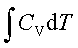 ;ΔH=
;ΔH=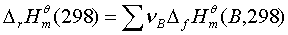
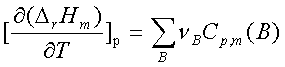 。
。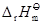 (物质,相态,温度)
(物质,相态,温度)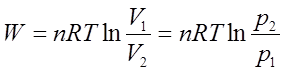
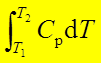
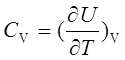 ;
;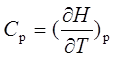

 pedV
pedV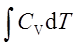 ; ΔH=
; ΔH=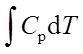
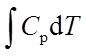 ; ΔU=
; ΔU=
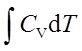 ;ΔH=
;ΔH=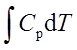

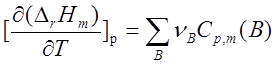 。
。