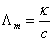学习物理化学已经有一学年的时间了,感触颇深,早在以前就听说物理化学是化学基础课中的难点,因为学习这么门课有它自身的学习方法,与其他科不同的是物理化学的逻辑思维很强,可以说是在数学公式中去学习化学。所以要学好任何一门学科都要有科学的方法,物理化学也不例外,在这里我把自己在学习物理化学过程中的一点收获,一点经验写出来和大家分享。
一、学习物理化学要记忆基本概念。基本概念和基本规律是学习物理的基础,每个概念我们要知道它是怎样引出来的,有哪些注意事项,其物理意义或适用条件是什么?每个概念之间有什么联系区别等等。学习物理必须熟记基本概论和规律,没有它,所有的学习就是空中楼阁。
二、学习物理化学要注重平时的积累,以旧带新,温故知新。上课认真听课,做好课堂笔记,课下还要在复习的基础上整理课堂笔记,加强印象和记忆。在整理过程中,要善于将不同的知识点分析归纳,找出相同点和不同点,以便于记忆。学完每一章、每一节后要及时概括总结,使所学的知识形成一个整体。
三、要重视实验, 勤于实验,在实验的基础上掌握物理规律。 多做实验可以帮助我们形成正确的概念,增强分析问题解决问题的能力,加深对物理规律的理解。对这些实验,要认真观察和分析实验现象,弄清每个实验的目的、原理,了解一些仪器的性能与使用,明确实验的步骤。做实验时,要遵守操作规程,依据步骤,认真实验,仔细纪录,通过正确的。
四、要加强练习。虽说盲目搞题海战术只能浪费时间,但必要的巩固练习还是有必要的。通过不断练习,不断归纳总结,才能提高解决问题的能力。在做题中注意“一题多解”和“一题多变”,以便培养自己应用知识,灵活解决问题的应变能力。 处理和分析,从而得出正确的结论。
实际上,有时候我觉得物化还是挺好玩的,然而,它的难度一点不小。在学习物化的过程中,我尽量让它更系统化,注意不同章节之间的联系,例如根据△G=-nEF,在适当的时候可以用电极电势E计算△G,这样也就把热力学与电化学关联起来。
…… …… 余下全文

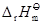 (物质,相态,温度)
(物质,相态,温度)
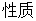

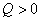 表示环境向系统传热。
表示环境向系统传热。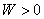 表示环境对系统做功。
表示环境对系统做功。
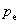 表示环境的压力。
表示环境的压力。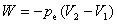
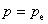 ,p为系统的压力,则有
,p为系统的压力,则有