第6单元 碳和碳的氧化物
一、碳的几种单质
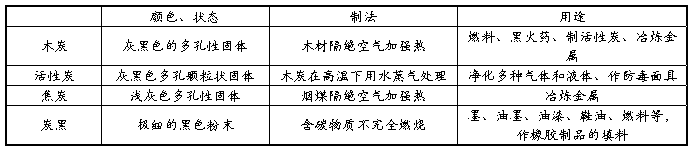
1、金刚石(C
2、石墨(C电极、电车的滑块等 金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。 CO和CO2的化学性质有很大差异的原因是:分子的构成不同。
3、金刚石和石墨是由原子直接构成的,C60是由分子构成的
4、无定形碳:由石墨的微小晶体和少量杂质构成.主要有:焦炭,木炭,活性炭,炭黑等. 活性炭、木炭具有强烈的吸附性,焦炭用于冶铁,炭黑加到橡胶里能够增加轮胎的耐磨性。
二、.单质碳的化学性质:
单质碳的物理性质各异,而各种单质碳的化学性质却完全相同!
1、常温下的稳定性强
2、可燃性:
完全燃烧(氧气充足),生成CO2 : C+O2
不完全燃烧(氧气不充足),生成CO:2C+O
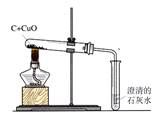
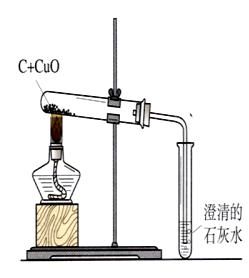
3、还原性:2↑ (置换反应) 应用:冶金工业
现象:黑色粉末逐渐变成光亮红色,石灰水变浑浊。
2Fe2O32↑
三、二氧化碳的制法
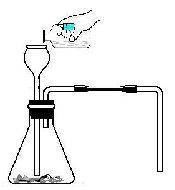
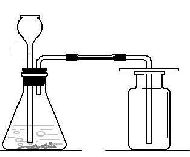
1、实验室制取气体的思路:(原理、装置、检验) (1)发生装置:由反应物状态及反应条件决定: 的发生装置。 (2)收集方法:气体的密度及溶解性决定:
难溶于水用排水法收集 CO只能用排水法
密度比空气大用向上排空气法 CO2只能用向上排空气法
密度比空气小用向下排空气法
2、二氧化碳的实验室制法
1)原理:用石灰石和稀盐酸反应: CaCO3+2HCl==CaCl2+H2O+CO2↑
2) 选用和制氢气相同的发生装置 3)气体收集方法:向上排空气法
4
1 / 3
3、二氧化碳的工业制法:
煅烧石灰石: CaCO2↑
生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2
四、二氧化碳的性质
1、物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体----干冰
2、化学性质:
…… …… 余下全文

 3、还原性:
3、还原性:



 CO2(充分燃烧) 2C+O2
CO2(充分燃烧) 2C+O2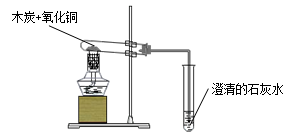 C+2CuO
C+2CuO 2Cu+CO2↑
2Cu+CO2↑ 完全燃烧(氧气充足),生成CO2 : C+O2点燃CO2
完全燃烧(氧气充足),生成CO2 : C+O2点燃CO2 CO2
CO2 2Cu + CO2↑(置换反应)
2Cu + CO2↑(置换反应)