化学(必修一)知识大总结
一、教材中涉及的离子检验
物质检验的一般步骤:取试样———加试剂———观现象———定结论
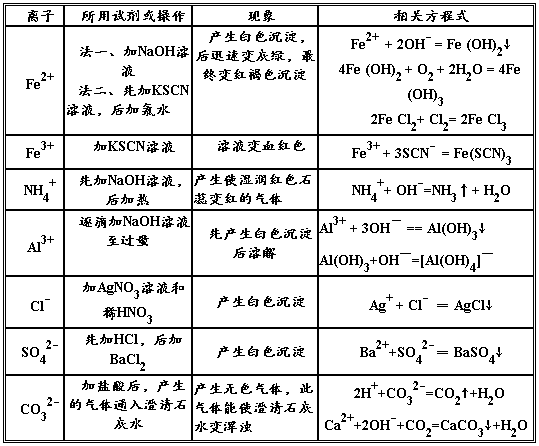
1、SO42-的检验:取待测液先用稀盐酸酸化,再加BaCl2溶液,若出现白色沉淀,则证明有SO42-
2、CO32-的检验: 取待测液加稀盐酸,产生无色无味气体,通入澄清石灰水变浑浊;另取待测液加CaCl2溶液有白色沉淀产生。综合上述两种现象说明有CO32-
3、Cl-的检验:待测液先用稀硝酸酸化,再加入AgNO3溶液,若出现白色沉淀,则证明有Cl-
4、Na+、K+的检验:用铂丝蘸取待测液,在酒精灯上灼烧,
产生黄色火焰,证明有Na元素,火焰透过蓝色钴玻璃观察呈淡紫色,证明有K素
5、Al3+的检验:在待测液中加NaOH溶液,有白色沉淀产生,继续加过量NaOH沉淀溶解,说明有Al3+
6、Fe3+的检验:①待测液中滴KSCN溶液,呈红色,说明有Fe3+
FeCl3+3KSCN = Fe(SCN)3+3KCl Fe3++3SCN-= Fe(SCN)3
②取待测液加NaOH溶液,有红褐色沉淀生成,说明有Fe3+
7、Fe2+检验:向溶液中加入KSCN,溶液不变红,再加入Cl2,溶液变红则证明原溶液中有Fe2+
8、NH4+的检验:在待测液中加强碱加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明有NH4+
9、CO2的检验:将气体通入品红,品红不褪色,再将气体通入澄清石灰水,
石灰水变浑浊,则原气体为CO2
10、SO2的检验:将气体通入品红溶液,品红褪色,加热溶液,恢复原来的颜色,则原气体为SO2
二、教材中出现的方程式(题号带下划线的有离子反应方程式、黑题号的为可逆反应)
1、Fe(OH)3胶体的制备:FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
2、碳还原氧化铜:2CuO+C 2Cu+CO2↑
2Cu+CO2↑
…… …… 余下全文

 Na2O2
Na2O2  2Na+Cl2↑
2Na+Cl2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
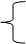 2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑ Na2O2 2Na+2H2O=2Na++2OH-+H2↑
Na2O2 2Na+2H2O=2Na++2OH-+H2↑ 2Cu + CO2↑
2Cu + CO2↑ Na2O2
Na2O2  2Na2O2
2Na2O2