离子共存问题专题
(一)因为发生复分解反应而不能共存
1、有气体产生。
H+与CO32ˉ、HCO3ˉ、SO32ˉ、HSO3ˉ、S2ˉ、HSˉ等不能共存
2、有沉淀生成。
①SO42ˉ与Ba2+、Ca2+、Ag+等不能共存;
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+等不能共存;
③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+等不能共存;
④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+等不能共存;
⑤AlO2ˉ与HCO3ˉ不能大量共存:AlO2ˉ+HCO3ˉ+H2O=Al(OH)3↓+CO32ˉ
3、有弱电解质生成。
如OH-和弱酸阴离子(CH3COO-、PO43-、CO32-、HCO3-、HPO42-、H2PO4-)等与H+不能大量共存,一些酸式弱酸根和弱碱阳离子不能与OH-大量共存。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、等必须在碱性条件下才能在溶液中存在;
如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
*H+与OHˉ和弱酸根离子等不能大量共存;在中学化学中不能在酸性溶液中共存的离子有:OH-、AlO2-、CO32-、HCO3-、SiO32-、SO32-、HSO3-、S2-、HS-、ClO-、F-、PO43-、H2PO4-、CH3COO-、SCN-等;
*OHˉ与所有酸式弱酸根和弱碱阳离子及H+均不能大量共存。在中学化学中不能在碱性溶液中大量共存的是:H+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+、Mg2+、Al3+、NH4+、HCO3-、HPO42-、H2PO4-、HSO3-、HS-等。
*既不可以与H+也不可以与OHˉ共存的例子是酸式弱酸根离子
(二)、由于发生氧化还原反应,离子不能大量共存
(1)在酸性条件下
①NO3ˉ与Iˉ、Brˉ、Fe2+、S2ˉ、HSˉ、SO32ˉ、HSO3ˉ等不能共存;
②S2ˉ与SO32ˉ等不能共存;(碱性条件下可以共存)
③MnO4ˉ与Iˉ、Brˉ、Clˉ、S2ˉ、HSˉ、SO32ˉ、HSO3ˉ、Fe2+等不能共存;
④ClOˉ与Fe2+、Iˉ、S2ˉ、HSˉ、SO32ˉ、HSO3ˉ等不能共存;
(2)Fe3+与S2ˉ、HSˉ、SO32ˉ、HSO3ˉ、Iˉ等不能共存;
如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;
SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能存在。
注意: MnO4-,NO3-等在酸性条件下具有强氧化性。
Fe2+、NO3-、H+三个离子不能共存,但任意两个可以共存(NO3-、H+、I-也是如此)
MnO4- 与Cl-在强酸性条件也不能共存;
(三)、能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存。
(1)Al3+与AlO2ˉ、HCO3ˉ、CO32ˉ、HSˉ、S2ˉ、SO32ˉ、HSO3ˉ、SiO32ˉ、ClOˉ等不能共存;
(2)Fe3+与AlO2ˉ、HCO3ˉ、CO32ˉ、SiO32ˉ、ClOˉ等不能共存;
(3)NH4+与AlO2ˉ、SiO32ˉ、ClOˉ等不能共存;
(4)AlO2-与Fe3+、Fe2+、Zn2+、Cu2+、Ag+、NH4+不共存;
(四)、由于形成络合离子,离子不能大量共存
Fe3+和SCN-不能共存;
(五)、由于水解和电离的相互影响而不能大量共存。AlO2-与HCO3-虽然均属于弱酸根离子,水溶液因水解呈碱性,但H3AlO3的酸性太弱,AlO2-的水解能力太强,含有AlO2-的水溶液中c(OH-)较大,能直接与HCO3-作用生成Al(OH)3沉淀和CO32-。故AlO2-与HCO3-不能共存于同一溶液中。 与其类似的还有AlO2-与HSO3-、HS-、H2PO4-、HPO42-等。
限制酸性溶液的条件
1. PH=1的溶液
2.使紫色石蕊溶液呈红色
3.使甲基橙呈红色
4.加镁粉放氢气
5.c(oH-)=1×10-10mol.l-1的溶液
限制碱性的条件
1.PH=14的溶液
2.使pH变蓝
3.使红色石蕊变蓝
4.酚酞呈红色
5.甲基橙呈黄色
6.c(H+)=1×10-10mol.l-1的溶液
可酸可碱的条件
1.水电离c(OH-)或者c(H+)浓度为十的负N次方摩尔每升
2.加入铝粉有氢气产生(不能有硝酸)
3.HCO3-离子不能稳定存在的溶液
有色离子:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4ˉ(紫红色)
巩固练习
1.下列各组离子在水溶液中能大量共存的是( )
A.K+ HCO3— CO32— Br— B.CO32— HCO3— OH— K+
C.Fe3+ Cu2+ NO3- SO42- OH— D.H+ Cl- Na+ SO32-
2.下列各组离子,在强碱性溶液中可以大量共存的是( )
A.I- AlO2- Cl- S2- B.Na+ K+ NH4+ Ba2+
C.Br- S2- Cl- HCO3- D.SO32- NO3- SO42- Mg2+
3.室温时某溶液的pH为1,该溶液中可能大量共存的离子组是( )
A.Zn2+ Cl- Ba2+ NO3- B.Na+ NO3- K+ CO32-
C.K+ SO42- Na+ AlO2- D.Fe2+ NO3- Al3+ SO42-
4.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H3O+、 NO3- 、 Fe2+ 、 Na+ B.Ag+、 NO3- 、Cl-、 K+
C.K+ 、Ba2+、OH-、 SO42- D.Cu2+、NH4+、Br-、OH-
5.下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是( )
A.K+ MnO4- Cl- SO42- B.Na+ AlO2- NO3- CO32-
C.Na+ H+ NO3- SO42- D.Na+ NH4+ S2- Cl-
6.若溶液中由水电离产生的C(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A. Al3+ Na+ NO3- Cl- B. K+ Na+ Cl- NO3-
C. K+ Na+ Cl- AlO2- D. K+ NH4+ SO42- NO3-
7.下列各组离子中,在碱性溶液中可大量共存,加入盐酸后会产生气体和沉淀的是( )
A.Na+ NO3- AlO2- SO42- B.Na+ NO3- SiO32- K+
C.K+ Cl- AlO2- CO32- D.Na+ Cl- HCO3- Ca2+
8.巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是( )
A.Al3+、CH3C00—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
9.下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2-、CO32—
C.在c(H+) =10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH =1的溶液中:K+、Fe2+、Cl—、NO3—
10.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3- NO3- B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3-、Na+
11.下列各组离子在溶液中能大量共存的是 ( )
A.酸性溶液Na+、K+、MnO4-、Br- B.酸性溶液Fe3+、NH4+、SCN-、NO3-
C.碱性溶液Na+、K+、AlO2-、SO D.碱性溶液Ba2+、Na+、CO
D.碱性溶液Ba2+、Na+、CO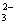 、Cl-
、Cl-
12.一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
13.下列各组离子一定能大量共存的是( )
A.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、HCO3—
B.在强碱溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3-
14.在由水电离的c(H+)H2O=1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
15.在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液中:K+、SO42-、Cl-、H+
16.下列各组离子在给定条件下能大量共存的是( )
A.在pH=1溶液中:NH4+、K+、ClO—、Cl—
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I—
C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br—
D.在c(H+) =1.0×10—13mol/L的溶液中:Na+、S2—、AlO2-、SO32—
17.在溶液中加入大量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
18.下列各组离子:
(1) I—、Na+、NO3-、H+; (2) K+、、NO3-、H+、SO42-;(3) Na+、S2—、OH-、SO32—; (4)Mg2+、Cu2+、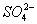 、
、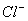 ; (5)Fe3+、
; (5)Fe3+、 、K+、
、K+、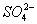 ;(6) K+、HCO3、 Na+、S2—、AlO2--。在溶液中能大量共存的组别共有( )
;(6) K+、HCO3、 Na+、S2—、AlO2--。在溶液中能大量共存的组别共有( )
A.1组 B.2组 C.3组 D.不少于4组
19.在某无色透明酸性溶液中,能共存的离子组是( )
A.NH4+ NO3- Al3+ Cl- B.Na+ AlO2- K+ NO3-
C.MnO4- K+ SO42- Na+ D.K+ SO42- HCO3- Na+
20.在pH=12的无色溶液中能大量共存的离子组是 ( )
A.NH4+ Mg2+ SO42- Cl- B.Ba2+ K+ OH- NO3-
C.Al3+ Cu2+ SO42- Cl- D.Na+ Ca2+ HCO3- AlO2-
21.在某溶液中加入铝片有氢气产生,则在该溶液中一定能大量共存的离子组是 ( )
A. AlO2- NO3- Ba2+ Ca2+ B.SO42- CH3COO- Al3+ Mg2+
C.Na+ K+ SO42- Cl- D.NH4+ Ba2+ Cl- HCO3-
22.因发生氧化还原反应在水溶液中不能大量共存的离子组是 ( )
A.Ca2+ Br- Fe3+ CO32- B.Fe2+ Cl- NO3- H+
C.K+ Na+ I- NO3- D.NO3- OH- Cl- Ba2+
23.下列各组离子在溶液中能大量共存,且此溶液既能与盐酸反应又能与NaOH溶液反应的是A.Na+ K+ SO42- HCO3- B.AlO2— OH— Na+ K+
C.K+ NH4+ NO3— Cl- D.NH4+ Fe2+ HSO3— OH—
24.在一种能使PH试纸变红的溶液中,下列离子因发生了氧化还原反应而不能大量共存的是
①Ag+ Na+ Al3+ Cl— ②Na+ Fe2+ Cl— NO3— ③K+ Mg2+ S2— SO42—
④K+ MnO4— SO42— Cl- ⑤Na+ NO3— SO42— I—
(A)②③ (B)②④⑤ (C)②③⑤ (D)全部
25.某无色透明溶液,跟金属铝反应放出H2 ,试判断下列离子:Mg2+、Cu2+、 Ba2+ 、H+、Ag+、 SO42- 、 SO32-、HCO3- 、OH-、NO3-
(1)当生成Al3+时,不可能大量存在__________;
(2)当生成AlO2-时,不可能大量存在__________。
答案1-5AAAAB 6-10BCDBB 11-15CABBC 16-20DBCAB 21-24CBAB
25(1) Cu2+、 Ba2+ 、Ag+、SO32-、HCO3- 、OH-、NO3-
(2) Mg2+、Cu2+、H+、Ag+、 SO42- 、 SO32-、HCO3-
第二篇:高中化学常见考点汇总(离子共存问题)
离子共存问题 一、“无色透明”条件型
若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、
I-、SO42-;Ca2+与CO32-、SO42-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。
例1.某无色透明的溶液中,下列各组离子能大量共存的是
A.H+、Cl-、Ba2+、CO32-
B.Ag+、I-、K+、NO3-
C.K+、OH-、Cl-、Na+
D.Fe3+、Cl-、NO3-、Na+
解析:正确选项应满足无色透明和能大量共存两个条件。答案为C项。
二、“酸性”条件型
常见的叙述有强酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、
S2-、F-、ClO-、CH3COO-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。
例2.在pH=1的溶液中,可以大量共存的离子是
A.K+、Na+、SO42-、SO32-
B.NH4+、Mg2+、SO42-、Cl-
D.K+、Na+、AlO2-、NO3-
解析:正确选项应满足pH=1(有大量H+存在)和可以大量共存两个条件。答案为B项。 三、“碱性”条件型
常见的叙述有强碱性溶液、PH=14的溶液、能使PH试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成AlO2-的溶液、既能溶解Al(OH)3又能溶解H2SiO3的溶液等。
若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Cu2+、Fe2+、Fe3+等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。
例3.某溶液既能溶解Al(OH)3又能溶解H2SiO3的溶液,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3-、Na+
解析:正确选项应满足溶液既能溶解Al(OH)3又能溶解H2SiO3的溶液(有OH-存在)、可以大量共存两个条件,只有B项符合题意。
四、“酸性或碱性”条件型
常见的叙述有能使Al反应放出H2的溶液等。
若题目中出现这样的条件,则溶液中可能有H+存在,也可能有OH-存在,分析时要注意题目要求回答的是一定能大量共存(满足无论是与H+还是与OH-都不会反应)还是可能大量共存(只要满足与H+、OH-中的一种不会反应就可以)。
例4.若溶液能与Al反应放出H2,满足此条件的溶液中一定可以大量共存的离子组是
B.K+、Na+、Cl-、SO42-
C.K+、Na+、Cl-、AlO2-
D.K+、NH4+、SO42-、NO3-
解析:题目所给的溶液为酸性(含有H+)或碱性(含有OH-)溶液。正确选项应满足在酸性或碱性都能大量共存的条件,只有B项符合题意。
五、“氧化还原反应”条件型
若题目中出现因发生氧化还原反应而不能大量共存这样的条件时,要考虑各离子组中是否存在强氧化性和强还原性的离子。如Fe3+与S2-、SO32-、HSO3-、I-;H+与S2O32-和S2-;MnO4-(H+)与Cl-;MnO4-(H+)、NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I-等不能大量共存。
例5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是()。
A.H+、NO3-、Fe2+、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
解析:正确选项应满足发生氧化还原反应、不能大量共存两个条件。A项中H+、NO3-、Fe2+能发生氧化还原反应,故答案为A项。
跟踪训练
1.下列各组离子在溶液中能大量共存的是
A.酸性溶液Na+、K+、MnO4-、Br-
B.酸性溶液Fe3+、NH4+、I-、NO3-
C.碱性溶液Na+、K+、AlO2-、SO42-
D.碱性溶液Ba2+、Na+、CO32-、Cl-
2.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中
NH4+、Na+、Cl-、OH-
B.在强碱性溶液中
Na+、K+、AlO2-、CO32-
C.在无色透明的溶液中
NH4+、Fe3+、SO42-、NO3-
D.在PH=1的溶液中
K+、Fe2+、Cl-、NO3-
答案:1、C 2、B
