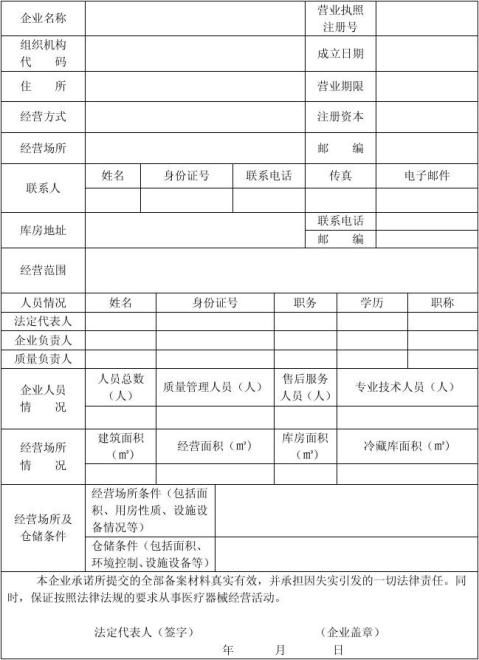
第二类医疗器械经营备案表
1
填 表 说 明
一、本表按照实际内容填写,不涉及的可缺项。其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
2
附件5
第二类医疗器械经营备案材料要求
1.第二类医疗器械经营备案表(一式三份);
2.企业营业执照复印件(如工商不先办营业执照,应向工商讲明新器械监督管理条例备案的要求);
3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;
4.企业组织机构与部门设置说明;
5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;
6.企业经营设施和设备目录;
7.企业经营质量管理制度、工作程序等文件目录;
8.经办人授权证明;
9.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
3
附件6
第二类医疗器械经营备案凭证
备案号:XX食药监械经营备XXXXXXXX号

备案部门(公章)
备案日期: 年 月 日 4
第二篇:第二类医疗器械注册申请材料要求
附件2
安徽省第二类医疗器械注册申请材料要求
一、准产注册申请材料要求:
(一)安徽省第二类医疗器械注册申请表;
(二)医疗器械生产企业资格证明:
包括生产企业许可证、营业执照副本复印件,并且所申请产品应当在生产企业许可证核定的生产范围之内;
(三)产品技术报告:
至少应当包括技术指标或者主要性能要求的确定依据等内容;
(四)安全风险分析报告:
按照YY0316《医疗器械风险分析》标准的要求编制。应当有能量危害、生物学危害、环境危害、有关使用的危害和由功能失效、维护不周及老化引起的危害等五个方面的分析以及相应的防范措施;
(五)适用的产品标准及说明:
采用国家标准、行业标准作为产品的适用标准的,应当提交所采纳的国家标准、行业标准的文本;注册产品标准应当由生产企业签章。
生产企业应当提供所申请产品符合国家标准、行业标准的声明,生产企业承担产品上市后的质量责任的声明以及有关产品型号、规格划分的说明;
(六)产品性能自测报告:
产品性能自测项目为注册产品标准中规定的出厂检测项目,应当有主检人或者主检负责人、审核人签字。执行国家标准、行业标准的,生产企业应当补充自定的出厂检测项目;
(七)医疗器械检测机构出具的产品注册检测报告:
需要进行临床试验的医疗器械,应当提交临床试验开始前半年内由医疗器械检测机构出具的检测报告。不需要进行临床试验的医疗器械,应当提交注册受理前1年内由医疗器械检测机构出具的检测报告;
(八)医疗器械临床试验资料:
至少应包括临床试验合同(或协议)、临床试验方案、临床试验报告,临床试验应符合《医疗器械临床试验规定》的要求,临床试验资料的提供方式执行《医疗器械注册管理办法》中的《医疗器械注册临床试验资料分项规定》;
(九)医疗器械使用说明书:
应符合《医疗器械说明书、标签和包装标识管理规定》的要求;
(十)产品生产质量体系考核(认证)的有效证明文件——根据对不同产品的要求,提供相应的质量体系考核报告:
1、省、自治区、直辖市(食品)药品监督管理部门签章的、在有效期内的体系考核报告;
2、医疗器械生产质量管理规范检查报告或者医疗器械质量体系认证证书;
3、国家已经实施生产实施细则的,提交实施细则检查验收报告;
(十一)所提交材料真实性的自我保证声明:
应当包括所提交材料的清单、生产企业承担法律责任的承诺。
二、重新注册申请材料要求:
(一)安徽省第二类医疗器械注册申请表;
(二)医疗器械生产企业资格证明:
包括生产企业许可证、营业执照副本复印件,并且所申请产品应当在生产企业许可证核定的生产范围之内;
(三)原医疗器械注册证书:
属于《医疗器械注册管理办法》第五章第三十三条情形的,提交原医疗器械注册证书复印件;属于本第五章第三十四、第三十五条情形的,应当提交原医疗器械注册证书原件;
(四)医疗器械检测机构出具的产品注册检测报告:
需要进行临床试验的医疗器械,应当提交临床试验开始前半年内由医疗器械检测机构出具的检测报告。不需进行临床试验的医疗器械,应当提交注册受理前1年内由医疗器械检测机构出具的检测报告。
(五)适用的产品标准及说明:
采用国家标准、行业标准作为产品的适用标准的,应当提交所采纳的国家标准、行业标准的文本;注册产品标准应当由生产企业签章。
生产企业应当提供所申请产品符合国家标准、行业标准的声明,生产企业承担产上市后的质量责任的声明以及有关产品型号、规格划分的说明;
(六)产品质量跟踪报告:
由生产企业出具的产品在中国医疗单位使用后的质量跟踪报告,应当包括不良事件监测情况说明;
(七)医疗器械使用说明书;
应符合《医疗器械说明书、标签和包装标识管理规定》的要求;
(八)产品生产质量体系考核(认证)的有效证明文件——根据对不同产品的要求,提供相应的质量体系考核报告:
1、省、自治区、直辖市(食品)药品监督管理部门签章的、在有效期之内的体系考核报告;
2、医疗器械生产质量管理范围检查报告或者医疗器械质量体系认证证书;
3、国家已经实施生产实施细则的,提交实施细则检查验收报告;
(九)属于《医疗器械注册管理办法》中第五章第三十四条情形的,应当提交相应的情况说明和证明性文件;
(十)所提交材料真实性的自我保证声明:
应当包括所提交材料的清单、生产企业承担法律责任的承诺。
注:1、以上所有资料申办单位应提供两份,一份包含有关单项材料的原件,一份为复印件,所有单项材料均应加盖企业公章。
2、除原件外,所有注册申请材料均应用A4纸打印,并装订成册。
