自主发现 合作探究
-----《钠的重要化合物》教学反思
一、教学设计:
本节课以生火、灭火、着火为贯穿始终的线索,以实验和生活用途激发学生兴趣和探求欲望。发挥实验的功能,本节课实验较多,开头可以反问:大家都知道水和二氧化碳能灭火,你知道他们能生火吗?提出了违背常识的问题,更难能激发学生的好奇心,接着让学生把水滴到脱脂棉上的过氧化钠上,发现脱脂棉着火了,进一步调动了学生的兴趣,到此为止学生积极性被调动,教师易如反掌的进入角色,在学习过氧化钠的性质就轻而易举的完成了,学完后再接着问,如果真着了火,用什么制取二氧化碳最好呢?又引导了碳酸钠个碳酸氢钠的性质上,探讨与盐酸的反应,一气呵成,学生驾熟就轻的完成了他们的性质的学习。再诱导学生如果不慎着火了,燃烧的东西火焰的颜色是一样的吗?比如春节的放的烟火,又引导焰色反应,总之,本节课以生火、灭火、着火为线索,把各个内容贯穿在一起,完成教学任务。
二、本节课的成功之处:
(一)教法的成功:
本节课中,学生兴趣盎然,始终以积极的态度、主人翁的姿态投入到每一个环节的学习中。我认为教学成功的关键在于学生是通过自主探究得到了知识,获得了发展。主要体现在以下几个方面:
(1)创设生活情境,激发探究欲望
本节课多处创设生活情境,如新课以违背生活常识的滴水生火实验引入;讲述灭火器原理引入Na2CO3、NaHCO3与酸的反应;以人们在制造苏打饼干、焙制面包时,常往面粉中掺进小苏打粉的事例引入Na2CO3与NaHCO3的热稳定性。
(2)重视学生的自主探索和合作学习
动手实践,自主探索与合作交流是学生学习化学的重要方式。对滴水生火实验的解释是让学生提出假说、设想,在此基础上进行分组实验,并对实验中的各种现象进行分组讨论分析。又如,关于Na2CO3与NaHCO3的热稳定性比较实验,由于课堂时间有限,我特地将全班分两大组进行对比实验,这样既节约了时间,又使学生获得了自主探索的乐趣,同时也学会了合作学习。
(3)培养学生的问题意识
问题能给学生的思维以方向和动力,不善于发现、提出和解决问题的学生是不可能具有创新精神的。
(二)课堂尾声,让探究的情境在学生头脑中延续
回归生活,研究性学习:厨房里,我们不小心将盛有纯碱和小苏打的瓶子弄混了,该怎样区别它们呢?学生活动:对一堂课的活动从提问的质量、思维的活跃度、创新度以及学习收获等方面给予自评和相互评价。
总之,在对新课程学习与探索的过程中,在对新的教学模式、方法的研究与实践中,本课的教学将是一个有益的尝试。不论是对于教师还是对于学生,收获都将颇多!
第二篇:钠的化合物(四)
【同步达纲练习】
一、选择题
1.关于钠的氧化物下列叙述正确的是( )
A.都是淡黄色固体 B.都是碱性氧化物
C.都能与水反应生成碱和氧气 D.都能与CO2反应生成盐
2.下列物质在空气中最稳定的是( )
A.碳酸钠晶体 B.苛性钠 C.氯化钠 D.氧化钠
3.对于2Na2O2+2H2O4NaOH+O2↑反应,下列说法正确的是( )
A.属于非氧化还原反应 B.Na2O2是还原剂,H2O是氧化剂
C.Na2O2是氧化剂,H2O是还原剂 D.Na2O2既是氧化剂又是还原剂
4.把7.8gNa2O2充分溶解在92.2g水中,所得溶液溶质的质量分数是( )
A.8% B.8.13% C.16.26% D.7.8%
5.关于Na2CO3、NaHCO3性质的有关叙述正确的是( )
A.在水中溶解性:Na2CO3<NaHCO3
B.热稳定性:Na2CO3>NaHCO3
C.与酸反应的速度:Na2CO3<NaHCO3
D.Na3CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
6.放置于空气中,易发生氧化还原反应而变质的化合物是( )
A.Na2O2 B.NaHCO3 C.Na D.NaOH
7.欲除去小苏打溶液中少量的苏打杂质,加入的物质最宜选用( )
A.干冰 B.盐酸 C.碳酸氢钙 D.氢氧化钙
8.当钠、钾燃烧引起失火时,最适宜灭火的是( )
A.泡沫灭火器 B.液态CO2灭火器
C.干粉灭火器 D.砂土
9.过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )
A.Na2CO3和Na2O2 B.只有Na2CO3 C.Na2CO3和NaOH D.Na2O和NaHCO3
10.室温时,将下列物质各5g分别投入100g水里,充分搅拌后,所得溶液中溶质的质量分数最小的是( )
A.CaO B.Na2O C.Na D.NaOH
二、填空题
11.今向100g8%的NaOH溶液中通入CO2,生成盐的质量为13.7g时通入CO2 克.
12.向盛有水的试管里加入Na2O2,再向所得的溶液中滴加2滴酚酞,溶液先呈 色,但很快 ,原因是 .该反应的离子方程式为 ,电子转移数目为 ,氧化剂为 ,还原剂为 .
13.将ag钠溶于bg水中,a1gNa2O溶于b1g水中,a2gNa2O2溶于b2g水中,均得到溶液中溶质的质量分数为8%的溶液.
(1)若a1∶a2=31∶39,则b1∶b2= ;

(2)若a=4.6,则b= g.
三、计算题
14.将148gNa2CO3和NaHCO3的混合物加热到质量不再减少为止,再称其混合物的质量变为137g,求原混合物中Na2CO3的质量分数.
15.将Na2CO3和NaHCO3的混合物加强热,将生成的气体通入足量的石灰水中,生成CaCO320.0g,将残留物加足量盐酸时,生成CO2气体11.0g.试计算原混合物中含Na2CO3、NaHCO3的质量.
【素质优化训练】
一、选择题
1.等质量的下列各物质粉末,分别与足量的盐酸反应,放出CO2气体最多的是( )
A.Ca(HCO3)2 B.NaHCO3 C.Na2CO3 D.CaCO3
2.下列物质中,既能与盐酸反应,又能与NaOH溶液反应的是( )
A.NaHSO4 B.NaHCO3 C.Na2SO3 D.Na2S
3.将①Na2O ②NaOH ③Na2O2微粒数目相等的上述固体物质长期放置于空气中,最后质量增加(不考虑潮解因素)是( )
A.①=②>③ B.①>③>② C.②>①=③ D.②>③>①
4.向紫色石蕊试液中加入过量Na2O2粉末,振荡,正确叙述是( )
A.溶液仍为紫色 B.最后溶液变蓝 C.最后溶液褪色 D.有气泡产生
5.某淡黄色粉末常用作潜水员的供氧剂,在该供氧反应中,被氧化和被还原的物质的质量比为( )
A.1∶1 B.2∶1 C.3∶1 D.3∶2
++-2-6.某溶液中只含K、Na、NO3、SO4等四种离子,它们的离子数目之比为1∶6∶3∶2,
则该溶液所含的溶质可能是( )
A.KNO3、Na2SO4 B.K2SO4、NaNO3、KNO3
C.KNO3、Na2SO4、NaNO3 D.K2SO4、Na2SO4、NaNO3
7.在一定的温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,充分搅拌后静置,最终所得晶体的质量( )
A.等于1.06g B.大于1.06g而小于2.86g
C.等于2.86g D.大于2.86g
+8.15.6gNa2O2溶于bg水中,恰好使Na离子数与水分子数之比为1∶50,则b值为( )
A.360 B.363.6 C.180 D.183.6
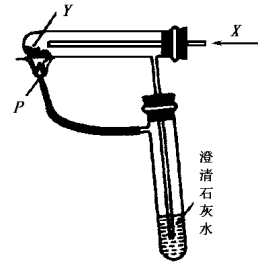
9.按右图的装置持续通入X气体,并在管口P处点燃,实验时澄清石灰水变浑浊,则X、Y可以是( )
A.H2和NaHCO3 B.CO和Na2CO3
C.CO和CuO D.H2和Fe2O3
10.10gCaCO3样品(内含一种杂质)与足量盐酸反应得到
4.3gCO2,则CaCO3中可能含有( )
A.MgCO3 B.Na2CO3
C.NaHCO3 D.K2CO3
二、填空题
11.选择适当的试剂或方法,除去杂质.
(1)碳酸钠固体中混有少量的碳酸氢钠:
(2)碳酸氢钠溶液中混有少量的碳酸钠:
(3)氯化钠溶液中混有少量的碳酸钠:
(4)二氧化碳气体中混有少量的氯化氢:
12.把一瓶不饱和的NaOH溶液分为四等份,在保持温度不变的情况下,向四份溶液中分别加入NaOH、Na2O2、Na2O、Na四种固体,都使溶液恰好达到饱和.则加入的物质质量最大的是 ,这是因为 .
13.工业生产的纯碱中常含有少量的NaCl等杂质.下图是测定产品中Na2CO3质量分数的实验装置.实验操作步骤有:
A.在干燥管内填满碱石灰,质量为mg;
B.取ng样品装入广口瓶中;
C.检验装置的气密性;
D.缓缓鼓入空气数分钟,再称干燥管质量为wg;
E.关闭止水夹;
F.打开止水夹;
G.缓缓加入稀硫酸至不再产生气体为止;
H.缓缓鼓入空气数分钟
.
(1)正确的操作顺序是(填写符号):
C→ →F→ →E→ →G→ →D.
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是 ;装置甲的作用是 ;装置乙的作用是 .
(3)计算溶液中Na2CO3质量分数的计算式为 .
(4)若去掉装置甲,测定结果会 ;若去掉装置乙,测定结果会(填“偏大”,“偏小”或“无影响”).
三、推断题
14.有四种钠的化合物W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式: WX+CO2↑+H2O Z+CO2→X+O2↑
Z+H2O→Y+O2↑
W是
X是
Y是
Z是 X+Ca(OH)2→Y+CaCO3↓
参考答案:
【同步达纲练习】
一、1.D 2.C 3.D 4.B 5.C 6.C 7.A 8.D 9.B 10.A
二、11.6.6
12.红;褪去;Na2O2与H2O反应生成NaOH故溶液呈红色,Na2O2有漂白性又使溶液的红
+-色褪去;2Na2O2+2H2O=4Na+4OH+O2↑;2;Na2O2;Na2O2
13.(1)1∶1 (2)95.6
三、14.79.9% 15.m(Na2CO3)=5.3gm(NaHCO3)=33.6g
【素质优化训练】
一、1.A 2.B 3.D 4.BD 5.A 6.AC 7.D 8.B 9.AC 10.D
二、11.(1)加热 (2)通入过量CO2气体 (3)加适量盐酸 (4)通过饱和NaHCO3溶液洗
+气瓶 12.NaOH;NaOH中Na的质量分数最小,且又不消耗水. 13.(1)B;H;A;F (2)使
广口瓶中产生的CO2气体全部排出;吸收空气中的CO2;吸收CO2中的水份 (3)
×100% (4)偏大;偏大 14.NaHCO3;Na2CO3;NaOH;Na2O2 53(10?m)22n
