CO2的PVT关系测定和临界现象观测
一.实验目的
1.学习流体PVT关系的实验测定方法,加深理解流体P-V状态图和不同类型等温线的特征。
2.掌握实际气体液化的条件和气-液相变、饱和蒸气压的意义。
3.通过对CO2临界现象的感性认识,理解临界点和超临界流体的重要意义。
4.学习活塞式压力计的正确使用。
二.实验原理
PVT关系是物理化学研究的重要课题之一,总体上,PVT关系可以通过三种方法得到:(1)直接实验测定,通过数据拟合参数得到状态方程(2)经验半经验方法,主要是建立在一定理论基础或物理意义的各种状态方程(3)理论推导。
对于物质的量确定的系统,当处于平衡状态时,其状态函数PVT之间存在着一定的关系:f(P,Vm,T)=0,该方程描述的物质状态图是以P、Vm、T为坐标的立体曲面。在不同温度下截取恒温剖面,相交曲线投影在P-Vm平面上,可以得到由一族恒温线组成的P-Vm图。温度较高时,等温线是一条光滑曲线;温度较低时,等温线上有一水平线段,反映气-液相变化的特征,水平线段的两个端点分别代表互为共轭的饱和气体和饱和液体,随着温度升高,水平线段不断缩短,饱和气体线和饱和液体线最后汇于一点,即临界点(Critical point)。临界点的温度、压力和体积分别称临界温度TC、临界压力PC和临界体积VC,是物质固有的特征参数。温度低于TC是气体液化的必要条件。温度、压力高于临界点的流体称超临界流体。
由于充进承压玻璃管内的CO2质量和玻璃管截面积不便测量,实验中采用间接办法来确定CO2的比体积。假设CO2的比体积V与其高度呈线性关系。已知CO2液体在20℃,9.8MPa时的比容V(293K,9.8MPa)=0.00117m3/Kg,若实际测定在20℃,9.8MPa时的CO2液柱高度Δho(m),则


K即为玻璃管内CO2的质面比常数。所以,任意温度、压力下CO2的比体积为:

三.实验仪器和试剂
仪器:PVT关系测定实验装置1套,由活塞式压力计、超级恒温槽和试验台本体及其防护罩等几部分组成。
试剂:CO2工作物质;压力油。
四.实验步骤
1. 加压前的准备:
(1)关压力表及其进入本体油路的两个阀门,开启压力台上油杯的进油阀。
(2)摇退活塞式压力计上的活塞螺杆,直至螺杆全部退出。这时,压力台油缸中抽满了油。
(3)先关闭油杯阀门,然后开启压力表和进入本体油路的两个阀门。
(4)摇进活寒螺杆,使本体充油。如此反复,直至压力表上有压力读数为止。
(5)再次检查油杯阀门是否关好,压力表及本体油路阀门是否开启。若均已调定后,即可进行实验。
2. 测定气-液相变等温线:
(1)将超级恒温槽调定在t=20℃,并保持恒温。
(2)压力记录从水夹套管上有刻度开始,当玻璃管内水银升起来后,应足够缓慢地摇进(退)活塞螺杆,以保证平衡。
(3)平衡后,记录该温度下的压力与水银高度。按照适当的压力间隔取h值,直至压力p=9.8MPa。注意加压后CO2变化,仔细测试和观察CO2最初液化和完全液化时的压力和水银高度。特别要注意饱和气体和饱和液体之间的变化以及液化、气化等现象。
(4)重复测定t=23℃,t=25℃,t=27℃,t=29℃时的实验数据。
3、测定临界等温线和临界参数,并观察临界现象:
(a)观察临界乳光现象:保持临界温度不变。摇进活塞杆至压力达PC附近,然后突然摇退活塞杆(注意勿使实验本体晃动!)降压。在此瞬间玻璃管内将出现圆锥状的乳白色的闪光现象。这就是临界乳光现象。这是由于CO2分子受重力场作用沿高度分布不均匀和光的散射所造成的。可以反复几次,来观察这一现象。
(b)整体相变现象:由于在临界点时,气化潜热等于零,饱和气体线和饱和液相线合于一点,所以这时气液的相互转变不像临界温度以下时那样逐渐积累、需要一定的时间且表现为渐变过程,这时当压力稍作变化时,气、液是以突变的形式相互转化。
(c)气、液两相模糊不清现象:首先在压力等于7.64MPa附近,突然降压,CO2状态点由等温线沿绝热线降到液相区,管内CO2出现了明显的液面。这就是说,如果这时管内的CO2是气体的话,那么,这种气体离液相区很接近,可以说是接近液态的气体;当我们在膨胀之后,突然压缩CO2时,这个液面又立即消失了。这就告诉我们,这时CO2液体离气相区也是非常接近的,可以说是接近气态的液体。这就是临界点附近饱和气、液相模糊不清现象。
4、测定高于临界温度时的等温线:调节温度t=35℃,t=45℃,记录数据。
五.数据记录和处理


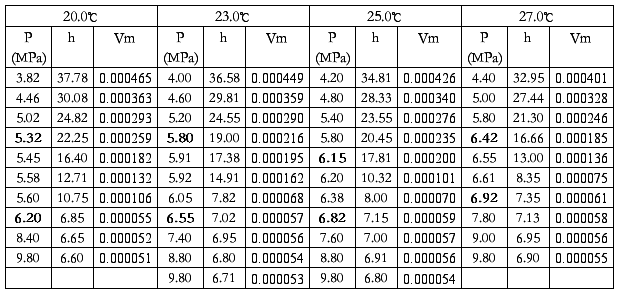

(黑体字为刚液化的压力和完全液化的压力)
CO2的饱和蒸汽压数据

实验CO2的饱和蒸汽压数据




从第三张图可以明显看出存在系统误差
六.实验讨论
1.P-V图水平段问题:
P-V图水平线段明显不平,分析原因,可能是每次读数的时候未等到完全平衡读数,再加上体系由恒温槽供应的恒温水在输送过程中与大气有热量交换,无法准确恒温,所以导致水平线段不平。另外可能的原因为刚刚开始液化时候的压力并没有达到理论上液化的压力,而是完全液化时的压力数据才与理论的液化压力相同,原因可能是温度造成的,或者是气体不纯。
2.临界点问题:
由于恒温槽无法准确控温,也就无法达到理论上需要的31.1℃的温度,所以无法得到临界点的数据。如果要观察到临界点现象,需要小心调节温度,不断重复测量数据和观察现象,但这样的工作会非常烦琐。如果是要得到临界点的数据,在实验过程在要在小范围内得到大量数据,即小范围高密度的温度变化、小范围高密度的压力变化,但无法知道实验室提供的仪器能否达到如此的精度。希望能采用其它的实验方法得到临界点的数据。
3.饱和蒸汽压的系统误差:
得到的CO2气体的各个温度的饱和蒸气压明显比理论上的数据要小。从图上可以看出,这应该是由于系统误差产生的,分析原因,估计为CO2气体不纯,可能混入了少量空气,导致CO2气体开始液化的压力明显比饱和蒸气压小。当然,也如问题一中讨论的,平衡时间不够,读数显示的压力并不是气体系统内的实际压力,气体系统内局部压力可能已经达到液化的饱和蒸气压,导致了气体液化,而读数显示的压力却还没有达到理论上CO2气体液化的温度。所以,实验过程中,每次操作延长平衡时间对于提高实验数据的质量是非常重要的,而不是一味追求实验做得快。
4.PVT三维图问题:
使用MatLab作图工具可以得到PVT的三维图,但我试了没有成功。
第二篇:物理化学实验-电池电动势的测定实验报告
原电池电动势的测定与应用
华南师范大学 化学与环境学院
合作: 指导老师:林晓明
一、实验目的
① 掌握电位差计的测量原理和原电池电动势的测定方法;
② 加深对可逆电池,可逆电极、盐桥等概念的理解;
③ 测定电池(Ⅰ)及电池(Ⅱ)的电动势;
④ 了解可逆电池电动势测定的应用。
二、实验原理
1.用对消法测定原电池电动势:
原电池电动势不能能用伏特计直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生极化,结果使电极偏离平衡状态。另外,电池本身有内阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流(或极小电流)通过电池的情况下进行,因此采用对消法(又叫补偿法)。
对消法是在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。
本实验使用的电动势测量仪器是SDC型数字电位差计,它是利用对消法原理设计的。
2.原电池电动势测定:
电池的书写习惯是左方为负极,右方为正极。负极进行氧化反应,正极进行还原反应。如果电池反应是自发的,则电池电动势为正。符号“|”表示两相界面,“||”表示盐桥。
在电池中,电极都具有一定的电极电势。当电池处于平衡态时,两个电极的电极电势只差就等于该可你电池的电动势,规定电池的电动势等于正、负电极的电极电势之差,即
E=φ+-φ-
式中,E是原电池的电动势。φ+、φ-分别代表正、负极的电极电势。
根据电极电位的能斯特方程,有

 -RT/ZF·ln(α
还原/α
氧化)
-RT/ZF·ln(α
还原/α
氧化)

 -RT/ZF·ln(α
还原/α
氧化)
-RT/ZF·ln(α
还原/α
氧化)
电池(Ⅰ)Hg|Hg2Cl2(s)|KCl(饱和)‖AgNO3(0.02mol/L)|Ag
负极反应:Hg + Cl-(饱和) 1/2Hg2Cl2 + e-
1/2Hg2Cl2 + e-
正极反应:Ag+ + e- Ag
Ag
总反应:Hg + Cl-(饱和)+ Ag+  1/2Hg2Cl2 + Ag
1/2Hg2Cl2 + Ag
根据电极电位的能斯特公式,正极银电极的电极电位:
φAg/Ag+ = φθAg/Ag+ + 0.05916V lgɑAg+
其中 φθAg/Ag+ = 0.799 - 0.00097(t-25)
又因AgNO3 浓度很稀,ɑAg+ ≈ [Ag+] = 0.02
负极饱和甘汞电极电位因其氯离子浓度在一定温度下是个定值,故其电极电位只与温度有关,其关系式:
φ饱和甘汞 = 0.2415 - 0.00065(t–25)
而电池电动势 E = φ+ - φ-;可以算出该电池电动势的理论值。与测定值比较即可。
3.电动势测定的应用:
求溶液的pH值,通常将醌氢醌电极与饱和甘汞电极组成原电池,测定其电动势,则溶液的pH值可求。
电池(Ⅱ)Hg|Hg2Cl2|KCl(饱和)||H+(0.2mol/L HAc+0.2mol/L NaAc)Q·QH2|Pt
醌氢醌是一种暗褐色晶体,在水中溶解度很小,在水溶液中依下式部分溶解。
C6H4O2·C6H4(OH)2(醌氢醌)== C6H4O2(醌)+C6H4(OH)2(氢醌)
在酸性溶液中,对苯二酚解离度极小,因此醌与对苯二酚的活度可以认为相同,即
α醌=α氢醌。
醌氢醌电极的制备很简单,只需待测pH值溶液以醌氢醌饱和,浸入惰性电极(铂电极)中即可。醌氢醌电极作为还原电极时,电极反应是
C6H4O2(醌)+2H+ +2e- →C6H4(OH)2(氢醌)
其电动势为:φ醌氢醌 =φθ醌氢醌 –RT/F·ln 1/αH+ =φθ醌氢醌 -2.303RT/F ·pH
其中φθ醌氢醌 =0.6994-0.00074(t-25)
通过实验测得电池的电动势,就可以计算出溶液的pH值。
三、实验仪器及用品
1.实验仪器:
SDC数字电位差计、超级恒温槽、饱和甘汞电极、光亮铂电极、银电极、250mL烧杯、20mL烧杯、U形管。
2.实验试剂:
0.02mol/L的硝酸银溶液、饱和氯化钾溶液、硝酸钾、琼脂。
四、实验步骤
1.制备盐桥
3%琼脂-饱和硝酸钾盐桥的制备方法:在250mL烧杯中,加入100mL蒸馏水和3g琼脂,盖上表面皿,放在石棉网上用小火加热至近沸,继续加热至琼脂完全溶解。然后加入40g硝酸钾,充分搅拌使硝酸钾完全溶解后,趁热用滴管将它灌入干净的U形管中,两端要装满,中间不能有气泡,静置待琼脂凝固后便可使用。制备好的盐桥丌使用时应浸入饱和硝酸钾溶液中,防止盐桥干涸。
2.组合电池
将饱和甘汞电极插入装有饱和硝酸钾溶液的广口瓶中。将一个20mL小烧杯洗净后,用数毫升0.02mol/L的硝酸银溶液连同银电极一起淌洗,然后装此溶液至烧杯的2/3处,插入银电极,用硝酸钾盐桥不饱和甘汞电极连接构成电池。
3.测定电池的电动势
①根据Nernst公式计算实验温度下电池(I)、(Ⅱ)的电动势理论值。
②正确接好测量电池(I)的线路。电池与电位差计连接时应注意极性。盐桥的两支管应标号,让标负号的一端始终不含氯离子的溶液接触。仪器要注意摆布合理并便于操作。
③用SDC数字电位差计测量电池(I)的电动势。每隔2min测一次,共测三次。
④同法,用SDC数字电位差计测量电池(Ⅱ)的电动势,要测至平衡时为止。
测量完毕后,倒去两个小烧杯的溶液,洗净烧杯的溶液。盐桥两端淋洗后,浸入硝酸钾溶液中保存。
五、实验数据记录与处理
将实验数据列入表1中。
室温: 23.5℃ 大气压: 1014.3hPa
1.电池(I)测定记录 恒温槽: 30℃



表1 电池(Ⅰ)实验数据记录表

2.电池(Ⅱ)测定记录 恒温槽: 30℃
PH理论值=-lg[H+]=-lg(ca/cb*Ka)=4.74



PH测定=(0.45745-E)/0.06015=4.50
表2 电池(Ⅱ)实验数据记录表

六、讨论与分析
1.误差分析:
(1)温度的影响:文献值是在298.15K时测定得到的;而实验测定时并不是在298.15K下进行,且测定过程中还有升温的操作,故温度的偏差会对结果带来影响。
(2)仪器的不稳定带来较大误差:调节电桥平衡的操作时间应尽可能的短,否则电极上较长时间的有电流通过,会发生电池反应使得溶液浓度下降、电极表面极化,这样可逆电极变成不可逆的,会给实验带来较大误差。而本次实验中所用仪器不稳定,需要较长的时间才能大致调节到平衡,即使是同一个电动势值,在很短的时间内测得的数据都有较大波动,所以不能很快调节到平衡是实验的误差主要来源。
(3)电流无限小的情况下测量,才能达到可逆电池的要求,但在实验过程中电流无法达到无限小仍存在一定值的电流,于是产生的极化作用破坏了电池的可逆性,使电动势偏离可逆值。
(4)恒温槽温度存在波动,电镀不均匀,会造成不稳定。此外实验中采用盐桥来消除液接电位,但实际实验中由于一开始的时候仪器不稳定,导致无法正常测定,最后得更换仪器后重新测定。而此时,盐桥已经被消耗一部分,其作用被减弱,不能保证盐桥能够完全消除液接电位。
2.数据分析:
观察实验测得的数据,可以看到,在相同温度下,随着反应时间的增加,原电池测得的电动势值并非维持在稳定态,而是逐渐降低的。产生这种现象的主要原因有两个:
(1)随着时间的增加,反应也在不断地进行,电极的反应物也被不断地消耗,导致Ag+的浓度减小。由原电池反应的能斯特方程可知饱和甘汞电极由于Hg为纯液态,Cl-也达到饱和态,因此这两者的浓度可看作不变,即原电池负极的电极电势不变;另外,Ag+的浓度减小导致正极电势减小,电池反应的E减小,测得的结果也逐渐变小。
(2)随着反应的进行,盐桥也在不断地消耗。插入盐桥的目的就是为了降低液接电势,减少电池的极化现象。但因为盐桥被消耗,会导致其工作能力下降,电池的极化现象严重化,导致电池反应的E减小,测得的结果也逐渐变小。
七、思考题
1.为何测定电动势要用对消法?对消法的原理是什么?
解:原电池电动势不能能用伏特计直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生生极化,结果使电极偏离平衡状态。另外,电池本身有内阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流(或极小电流)通过电池的情况下进行,因此采用对消法。
对消法的原理:在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。
2.测电动势为何要用盐桥?如何选用盐桥以适合不同体系?
解:使用盐桥可以有效地减弱液体接界电位,减小电池的极化现象带来的干扰,使测定更加准确。选用盐桥时,要求盐桥的盐浓度远远高于被测物的浓度,最少应大于10倍以上。此外,还要求盐桥的正、负离子迁移速率尽量相等,且不与溶液反应,最好选用与电极具有相同离子的盐桥,以排除引入外来离子造成测定干扰。
3.使用醌氢醌电极的限制条件是什么?
解:在酸性溶液中,方有α醌=α氢醌。
参考文献
[1] 何广平,南俊民,孙艳辉等. 《物理化学实验》[M].华南师范大学化学实验教学中心,
化学工业出版社,2007.
[2] 傅献彩,沈文霞等编. 物理化学. 第四版. 北京:高等教育出版社,2008.
