酚酞电离平衡常数的测定
20##级化学一班 20105051148 张琳 指导老师:王岩
一、实验目的 :
测定酚酞的电离平衡常数 。
二、实验原理:
酚酞可以看成是一种弱酸 ,以 HR表示,在水溶液中按下式电离 :
HR ? H+ + R- (1)
无色 红色
已知定温下,上反应平衡后,若改变体系 中的H+浓度,将使平衡移动 ,新的平衡达到时,各参与物的浓度均有所变化,平衡常数不变。实验将以不同pH的缓冲液为反应介质,在定温下测定酚酞之电离平衡常数。反应在定温平衡以后 , 下式 成立 :
KT = [H +][R-]/[HR] (2)
若以[H R]0表示酚酞原始浓度 , 则 :
[HR] = [HR]0 –[R -] (3)
两式 合并,并令电离度a=[R-]/[HR]0,
KT= [H +][a/(1-a)] (4)
根据比耳定律 : 一有色物质溶液,在光径不变时,其浓 度与光密度成正比。故若取一定体积 的酚酞溶液加到一已知pH 的缓冲液中,测得光密度为 E;在相同 条 件 下,加适当量的 NaOH ,增大pH ,使酚酞完全电离。测得光密度为 E0 ; 根 据 ( 1 ) 和 比耳定律 ,下式成立 :
a=[R -]/[HR]0=E/E0 (5)
得 KT=[E/(E0-E)]×10-PH (6)
三、仪器和试剂
7230G型分光光度计,PH计,容量瓶,烧杯,移液管,乳头胶管,0.5%的酚酞溶液,0.1N和1N的NaOH, 0.4N的缓冲溶液,蒸馏水。
四、实验步骤
在1至3号的250mL容量瓶中分别加2.5mL0.5%的酚酞和2.5mL0.4N缓冲溶液后,加入蒸馏水至容量瓶体积的2/3,摇匀,用乳头胶管吸取1N的NaOH分别滴加在上述3只容量瓶中刚好滴至微红,然后改用0.1N的NaOH,使1至3号容量瓶中溶液的颜色由浅至深形成一个色阶,然后用蒸馏水稀释到刻度。在另一只250mL容量瓶中(编号为4)加入2.5mL的0.5%酚酞和2.00mL 0.1N的NaOH ,用蒸馏水稀释至刻度处,迅速测定1—4号溶液的吸光度和PH值。
五、数据处理
室验温度:26 ℃

根据原理,计算在实验温度时各个不同PH值的酚酞试液的电离常数,计算时应考虑到6号容量瓶中的酚酞只为其他各号的1/10,故E0=10E。
六、注意事项
不进行实验,应将分光光度计暗室盖子打开;
分光光度计连续使用时间不超过两小时;
玻璃电极在使用前需在蒸馏水中浸泡,且需谨慎使用。
七、问题讨论
1、在实验中,溶液配制好之后,为什么要快速测定?
答:因为溶液配制好之后,敞口放置时候会吸收空气中的二氧化碳,影响实验结果。
2、各个容量瓶中所取的酚酞溶液的量不一致对实验结果有无影响?
答:有影响。因为实验中要测定的是酚酞的电离平衡常数,当酚酞的量不一样时,其解离程度不同,所测结果有偏差。
第二篇:酚酞电离平衡常数的测定
酚酞电离平衡常数的测定
———风光光度法
姓名: 学号:
班级:2 指导老师:
一、实验目的
1、用分光光度计和PH计测定酚酞的电离平衡常数。
二、实验原理
酚酞是一元有机弱酸,用HR表示,在水溶液中按下式部分电离:
HR===H++R- (1)
无色 红色
在一定温度下,上述反应达到平衡后,若改变体系的酸的浓度,将是平衡移动;新的平衡到达时,各反应物浓度均有所变化,但平衡常数不变。本实验以不同的PH的缓冲溶液为反应介质在定温下测定酚酞的电离平衡常数。
若以[HR]0表示酚酞的原始浓度,则应有:
[HR]= [HR]0 - [R-]
令电离度α=[R-]/[HR]0 则得:
KT=[H+] [α/(1-α)]
本实验用分光光度计测吸光度,用PH计测其PH。
根据比尔定律:一有色物质之浓度,在光径不变时,其浓度与光密度成正比。故若取一定体积的酚酞溶液加到一已知PH值得缓冲溶液中测得光密度为E,在相同条件下,加适量的NaOH,使酚酞完全电离,测得光密度为E 。根据电离度的定义和比尔定律,下式成立
α=[R-]/[HR]0=E/ E0
从而得出KT的计算公式为:
KT=[E/(E0-E)]x10-PH
三、仪器和药品
7721型分光光度计、PH计、100 ml 容量瓶6个、50ml烧杯、6个1ml刻度移液管2支、乳头滴管1支、2ml刻度移液管1支、1N NaOH溶液(A液);0.4N混酸(HAc,)();0.5% 酚酞;0.1N NaOH溶液.
四、实验步骤
1. 在1至5号的100ml容量瓶中分别加入1.00ml0.5% 酚酞和1.00ml 0.4N混酸后,加入蒸馏水至容量瓶体积的2/3.摇匀。
2.用乳头滴管吸取1N NaOH分别滴加在上述5只容量瓶中刚好滴至微红,然后改用 0.4N NaOH,使1号至5号容量瓶中溶液的红色由浅到深形成一个色阶,最后用蒸馏水稀释至刻度。
3.在另一只100ml容量瓶(编号6)中,加入0.10ml 0.5%酚酞和2.00ml 0.1N NaOH,用蒸馏水稀释至刻度处。迅速测定1~6号溶液的光密度和PH值。
五、实验记录和数据处理
1.将测定的1~6号溶液的光密度(E)和PH记录与下表。
实验温度:25℃
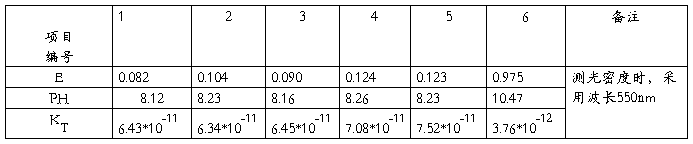
六、误差分析
1.移液时有误差,进而对实验结果造成误差。
2.容量瓶定容是存在误差,进而对实验结果造成误差。
3.比色皿的清洗不彻底,会对实验造成一定误差。
4.吸光率的测定和PH的测定不是同时进行也会造成一定实验误差。
5.由于实验仪器长期使用,会出现一定的磨损,是使实验仪器的精密度降低,进而对实验结果造成一定影响。
七、思考题
1.所配溶液色阶颜色太深对实验有无影响?1至5号瓶子中酚酞的量不一致对实验结果有无影响?
答:有影响,溶液的吸光度在0.1至0.7这个范围准确性最高,吸光度超出这个范围,即对应的浓度超出这个范围,准确性要打折扣。吸光度在0.434时,准确度最高,越接近这个值,精度越高;没有影响,平衡常数对于一个特定的反应来说,当温度确定时,它是一个常数,不随着反应物的量的变化而变化,故1至5号瓶子中的酚酞的量可以不一致。。
