以作对照判断(使终点色调一致)。
四、 实验内容
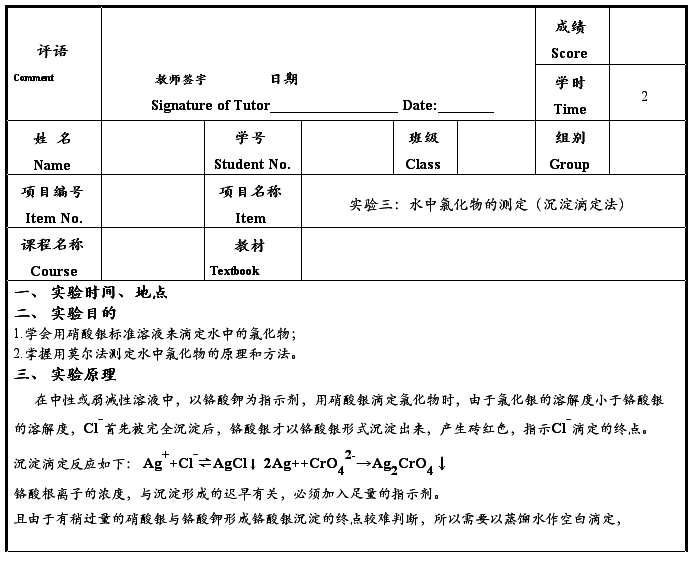
用移液管移取0.1000mol/L氯化钠标准溶液25.00ml,加25.00ml蒸馏水,加一毫升K2CrO4,指示剂。在玻璃棒的不断搅动下,用硝酸银标准溶液滴定至淡橘红色,即为终点。同时做空白试验。根据氯化钠标准溶液的浓度和滴定中所消耗硝酸银溶液的体积,计算硝酸银溶液的准确浓度。
五、 实验器材
1. 棕色酸式滴定管一支,25ml;
2. 瓷坩埚一个,250ml;
3. 移液管一支,50ml;
4. 烧杯一支,250ml;
5. 玻璃棒1支;
6. 滴定台、滴定夹。
六、 实验步骤
步骤1: 取水样25ml到250ml瓷坩埚中,在用量筒量入25ml的自来水稀释,滴加1ml K2CrO4,用玻璃棒搅匀;


 步骤2:在滴定管装满水后,扭开活塞,检查滴定管的严密性。检查完毕后,将0.1000mol/L的硝酸银溶液倒入滴定管中;
步骤2:在滴定管装满水后,扭开活塞,检查滴定管的严密性。检查完毕后,将0.1000mol/L的硝酸银溶液倒入滴定管中;
步骤3:用烧杯将瓷坩埚固定住,在玻璃棒的搅拌下,用硝酸银溶液滴定至淡橘红色,即为终点。根据氯化钠标准溶液的浓度和滴定中所消耗硝酸银溶液的体积,计算硝酸银溶液的准确浓度。



七、 数据处理
(V2-V1)×C×35.5×1000
Cl-(mg/L) = ------------------------
V水
C—硝酸银标准溶液浓度(mol/L);
V水—水样的体积(mL);
V1——蒸馏水消耗硝酸银溶液的体积(ml);
V2——水样消耗硝酸银标准溶液的体积(ml)。
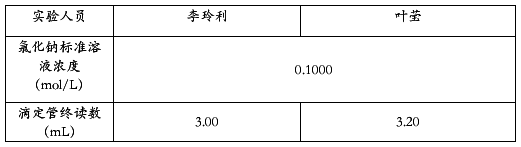
八、 实验结果
水样碱度的测定
九、 思考题
1. 滴定中试液的酸度宜控制在什么范围内?为什么?怎样调节?
答:严格控制酸度,酸度大了会引起酸效应,使络合不完全;酸度小了常温不能反应,准确控制酸度的方法是一般加入缓冲溶液。调节酸碱度应用弱酸或弱碱,避免发生其他反应。
2. 为什么要做空白试验?滴定过程中为何要用力摇动?
答:一般试验都要设置参比试验,为的就是控制一个变量,消除其他变量带来的对试验结果的影响。
3. 以K2CrO4作指示剂时,指示剂的浓度过大或过小对测定有何影响?
答:指示剂浓度过大,则测量得到的CL的实际值变小,例如假设17%浓度的指示剂中,正常反应氯一摩尔,此时由于指示剂浓度过大,实际反应的数量超过一摩尔,测得的值纠偏小了,反之亦然
十、 注意事项
1. 如果水样的pH值在6.5—10.5范围内,可直接测定。当pH<6.5时,须用碱中和水样;当水样pH>10.5时,亦须用不含氯化物的硝酸或者硫酸中和。
2. 空白试验中加少量CaCO3 ,是由于水样测定时有白色AgCl沉淀生成。而空白试验是以蒸馏水代替水样,蒸馏水中不含Cl- ,所以滴定过程中不生成白色沉淀。为了获得与水样测定有相似的浑浊程度,以便比较颜色,所以加少量CaCO3的作背景。
3. 沉淀Ag2CrO4为砖红色,但滴定时一般以出现淡橘红色即停止滴定。因Ag2CrO4 沉淀过多,溶液颜色太深,比较颜色确定滴定终点比较困难。
4. 水样分析前不应打开瓶盖,不能过滤,稀释,浓缩,应及时分析,或者在4?C以下保存。
5. 将水样倒入锥形瓶,眼睛与锥形瓶刻度平视,倒入50ml。
6. 试剂滴入1-2滴即可不可多;
7. 在使用酸式滴定管前,要检查该仪器的严密性,包括:是否漏水,活塞扭动是否灵敏,有无破裂残缺等;
8. 滴定的时候,右手握住滴定管的活塞,目的为随时控制活塞;左手握住锥形瓶瓶口处,用手腕力量轻轻并均匀晃动锥形瓶;滴定时应让盐酸呈连续的水滴般流出,好控制滴定的终点。
9. 记录滴定管读数时,眼睛与盐酸标准溶液凹面处平行。
10. 使用洗耳球时注意使用方法
11. 实验结束后,整理桌面并清洗相关仪器。
碱度数据

硬度数据
第二篇:自动电位滴定法测定氯化物含量
湖南工程学院化学化工学院系实验指导书
自动电位滴定法测定氯化物含量
一、实验目的
1、了解自动电位滴定的原理及实验方法。
2、熟悉和学猩ZD-2型自动电位滴定仪的使用。
二、实验原理
若溶液本身具有很深的颜色,影响指示剂的变色,故一般容量滴定不能进行。虽然可用重量法测定;仍太麻烦。用电位滴定法测定,其方法方便,快速、被确。电位电位法测Cl-,通常采用AgNO3作滴定剂,以银离子选择性电极作为指示电极,饱和甘汞电极为参比电极,滴定反应为:
Ag-十Cl-= Ag Cl↓

在滴定过程中,随着Cl-的浓度变化E也在同步变化, 滴定至预定终点时,仪器发出一控制信号,使自动电位滴定仪停止滴定。最后由用去的AgNO3体积计算出Cl-含量。
终点电位计算:

△E = Ee.p-ESCE = 0.276V
三、仪器与试剂
ZD-2型自动电位滴定仪
216型银离子选择性电极
232型饱和甘汞电极
AgNO3标准溶液0.0100mo1/L
未知试样
四、实验步骤
1. 调试仪器,预置滴定终点
调试好仪器后,将终点预置在276mV。
2. 未知试样测定
取10 mL未知试样于100 mL烧杯中,加蒸馏水稀释至50 mL。平行测定三次。
3. 自来水样测定
取50 mL自来水于烧杯中,按照上述方法,平行测定三次。
4. 实验后处理
用蒸馏水吹洗电极、毛细管。
五、数据处理
按下述方法计算Cl-含量
Cl??(V2?V1)?NAgNO?35.53
V?1000
其中:V1滴定前读数; V2滴定后读数。
V为水样体积
湖南工程学院化学化工学院系实验指导书
五、问题讨论
1、电位滴定与一般容量滴定有何不同?
2、试写出该电池的表达式。
3、分析本实验可能的误差。
4、怎样配制0.0100mo1/L AgNO3标准溶液?
