维生素C药片中Vc含量的测定(碘量法)
一、实验目的
1、 掌握直接碘量法测定Vc的原理及其操作。
2、 掌握碘标准溶液的配制及标定。
3、 掌握维生素C的测定方法。
二、实验原理
(一)碘量法
碘量法是以I2的氧化性和I-的还原性为基础的滴定分析方法。在一定条件下,用碘离子来还原,定量的析出碘单质,然后用Na2S2O3 标准溶液来滴定析出的I2。这种方法叫做间接碘量法。本实验采用间接碘量法测碘的浓度。以淀粉为指示剂,Na2S2O3 标准溶液来滴定析出的I2,以蓝色消失为终点,即可算出碘的浓度。
维生素C又称抗坏血酸Vc,分子式C6H8O6。Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。其滴定反应式:
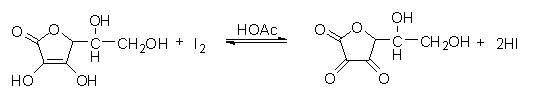
(二)碘溶液的配制与标定
I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶解得很慢,所以配制I2溶液时不能过早加水稀释,应先将I2和KI混合,用少量水充分研磨,溶解完全后再加水稀释。
I2 溶液的标定可以用As2O3或Na2S2O3标定,因为As2O3是剧毒物质,我们用Na2S2O3来标定。
(三)硫代硫酸钠溶液的配制与标定
Na2S2O3一般含有少量杂质,在PH=9-10间稳定,所以在Na2S2O3溶液中加入少量的Na2CO3,Na2S2O3见光易分解可用棕色瓶储于暗处,经一周后,用K2C2O7做基准物间接碘量法标定Na2S2O3溶液的浓度。根据K2C2O7标准溶液的物质的量浓度和滴定消耗的体积,就可计算出溶液中Na2S2O3的浓度。
其过程为:K2C2O7与KI先反应析出I2:析出的I2再用标准的Na2S2O3溶液滴定:从而求得Na2S2O3的浓度。这个标定Na2S2O3的方法为间接碘量法。
碘量法的基本反应式:2S2O32-+I2=S4O62-+2I-
标定Na2S2O3溶液时有:
6I-+Cr2O72-+14H+=2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I-
Na2S2O3标定时有:n(K2C2O7): n(Na2S2O3)=1:6
三、实验药品及仪器
实验药品和试剂:
I2分析纯 KI溶液100g·L-1 Na2S2O3·5H2O溶液 0.0170 mol.L-1K2C2O7溶液 淀粉指示剂5 g·L-1 Na2CO3 固体 HCl溶液 6 mol.L-1 冰醋酸 维生素C药片
主要仪器:
分析天平、天平、量筒、烧杯、酸式碱式滴定管、表面皿、容量瓶(250mL)、锥形瓶(250mL)、碘量瓶(250mL)、移液管(25mL)、洗瓶等常规分析仪器
四、实验步骤
(一)、Na2S2O3 溶液的配制及标定
1、配制0.10mol/L Na2S2O3溶液500mL 称取13gNa2S2O3·5H2O,溶于500mL新煮沸的蒸馏水中,加入0.1gNa2CO3,保存于棕色瓶中,放置一周后进行标定。
2、Na2S2O3溶液的标定。移取25.00mL标准 K2Cr2O7 溶液于250mL锥形瓶,加3mL6mol/L的HCl, 5mLKI,盖上表面皿,以防止I2 因挥发而损失,摇匀后置于暗处5分钟,使反应完全,加50ml蒸馏水稀释,用Na2S2O3溶液(碱氏)滴定到溶液呈浅绿黄色时,加2ml淀粉溶液。继续滴入Na2S2O3溶液,直至蓝色刚刚消失而溶液呈亮绿色(Cr3+)出现为止。记下消耗Na2S2O3溶液的体积,平行滴定三次。计算Na2S2O3溶液的浓度。
(二)、标准碘溶液的配制及标定
1、配制0.050mol/L I2溶液300 mL 称取4.0gI2 放入小烧杯中,放入8gKI,加水少许,用玻璃棒搅拌至I2全部溶解后,转入500 mL烧杯,加水稀释至300mL。摇匀,贮存于棕色瓶。
2、I2溶液的标定 用移液管取25.00mL I2溶液置于250mL锥形瓶中,加50mL水,用Na2S2O3标准溶液滴定至溶液呈浅黄色时,加入2 mL淀粉指示剂,继续用Na2S2O标准溶液滴定至蓝色恰好消失,即为终点。平行滴定三次,计算标准溶液浓度。
(三)、Vc含量的测定
1、配制2mol/L醋酸溶液。量取6mL冰醋酸稀释至50mL
2、维生素C的提取。取10片药剂,准确称量其质量。研成细粉末并混均匀,准确称取粉末约0.6g(三份)。置于锥形瓶中,操作一定要快,加50mL蒸馏水稀释,马上进行下一步滴定。(若颜色太深可加蒸馏水稀释)
3、维生素C的测定。向锥形瓶中加入10mL2mol/LHAc溶液,2mL淀粉溶液,立即用标准碘液(酸式滴定管)进行滴定至溶液刚好呈现蓝色,30s内不褪色即为终点.记下体积,平行滴定三次,,计算Vc的含量。
五、原始数据记录
表一:Na2S2O3 溶液的配制及标定


c (Na2S2O3)= C(K2Cr2O7)×25.00×6/V(Na2S2O3)


 表二:标准碘液的配制及标定
表二:标准碘液的配制及标定

c (I2)=0.5×C(Na2S2O3)×25.00/V(I2)


 表三:维生素C药片Vc含量的测定
表三:维生素C药片Vc含量的测定

C% %
%
M(药片)=176.13g/mol
六、注意事项
1、 实验中所用指示剂为淀粉溶液。I2与淀粉形成蓝色的加合物,灵敏度很高。温度升高,灵敏度反而下降。淀粉指示剂要在接近终点时加入。
2、 用心煮沸并冷却的蒸馏水:否则Na2S2O3因氧气和二氧化碳和微生物的作用而分解,使滴定时消耗Na2S2O3溶液的体积偏大。
七、思考题
1、 测定维生素C的溶液中为什么要加稀HAC?
2、 溶样时为什么要用新煮过的并冷却的蒸馏水?
3、 为减少误差一次溶解三片好,还是滴定完后在溶解下一片好?
八、参考文献
1、 《分析化学实验》 第三版 华中师范大学、东北师范大学、陕西师范大学、北京师范大学编,高等教育出版社,2001。
2、 《碘量法测维生素C含量》 豆丁网。
第二篇:直接碘量法测定维生素C含量
一.实验目的
1.掌握碘标准溶液的配制和标定方法;
2.了解直接碘量法测定维生素C的原理和方法。
二.实验原理
维生素C(Vc)又称抗坏血酸,分子式C6H8O6,分子量176.1232/g?mol。Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接滴定。其滴定反应式为:。 ?1
由于Vc的还原性很强,较易被溶液和空气中的氧氧化,在碱性介质中这种氧化作用更强,因此滴定宜在酸性介质中进行,以减少副反应的发生。考虑到I-在强酸性溶液中也易被氧化,故一般选在pH=3~4的弱酸性溶液中进行滴定。
三.主要试剂
1.I2溶液(约0.05mol?L):称取3.3gI2和5gKI,置于研钵中,加少量水,在通风橱中研磨。待I2
全部溶解后,将溶液转入棕色试剂瓶中,加水稀释至250mL,充分摇匀,放阴暗处保存。
2.Na2S2O3标准溶液(0.1127mol?L)
3.HAc(2mol?L)
4.淀粉溶液
5.维生素C片剂
6.KI溶液 ?1?1?1
四.实验步骤
1.I2溶液的标定
用移液管移取20.00mLNa2S2O3标准溶液于250mL锥形瓶中,加40mL蒸馏水,4mL淀粉溶液,然后用I2溶液滴定至溶液呈浅蓝色,30s内不褪色即为终点。平行标定3份,计算c(I2)/mol?L。
2.维生素C片剂中Vc含量的测定
1 ?1
准确称取2片维生素C药片,置于250mL锥形瓶中,加入100mL新煮沸过并冷却的蒸馏水,10mLHAc溶液和5mL淀粉溶液,立即用I2标准溶液滴定至出现稳定的浅蓝色,且在30s内不褪色即为终点,记下消耗的V(I2)/mL。平行滴定3份,计算试样中的Vc的质量分数。
五.数据记录与处理
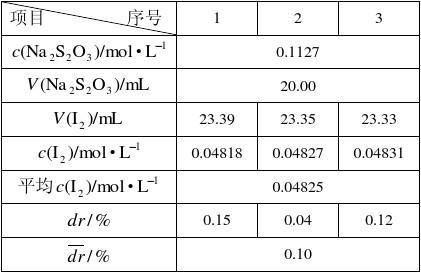
1.I2溶液的标定
2.维生素C片剂中Vc含量的测定

六.实验总结
标定得c(I2)?0.04825(mol?L),测得?(Vc)?84.52%。
?1
七.分析讨论
1.I2?KI溶液呈深棕色,在滴定管中较难分辨凹液面,但液面最高点较清楚,所以常读取液面最高点,读时应调节眼睛的位置,使之与液面最高点前后在同一水平位置上。
2
2.使用碘量法时,应该用碘量瓶,防止I2、Na2S2O3、Vc被氧化,影响实验结果的准确性。 3.由于实验中不能避免地摇动锥形瓶,因此空气中的氧会将Vc氧化,使结果偏低。
八.思考题
1.溶解I2时,加入过量KI的作用是什么?
答:查得,碘在水中的溶解度为0.02(g/?00gH2O)。因此,溶解度很低。加入过量的KI,可增加I2 在
水中的溶解度,反应式如下:

2.维生素C固体试样溶解时为何要加入新煮沸并冷却的蒸馏水?
答:Vc有强还原性,为防止水中溶解的氧氧化Vc,因此要将蒸馏水煮沸,以除去水中溶解的氧;为
防止Vc的结构被破坏,因此要将煮沸的蒸馏水冷却。
3.碘量法的误差来源有哪些?应采取哪些措施减少误差?
答:(1)读数误差,由于碘标准溶液颜色较深,溶液凹液面难以分辨;但液面最高点较清楚,所以常
读数液面最高点,读时应调节眼睛的位置,使之与液面最高点前后在同一水平位置上。
(2)反应物容易被空气中的氧氧化;滴定过程中用碘量瓶,而不用锥形瓶,避免剧烈地摇动。
3
