实验八 维生素C的定量测定
一、实验目的
1、学习并掌握定量测定维生素C的原理和方法。
2、了解蔬菜、水果中维生素C含量情况。
二、实验原理
维生素C是人类营养中最重要的维生素之一,缺少它时会产生坏血病,因此又称为抗坏血酸(ascorbic acid)。它对物质代谢的调节具有重要的作用。近年来,发现它还有增强机体对肿瘤的抵抗力,并具有化学致癌物的阻断作用。
维生素C是具有L系糖型的不饱和多羟基物,属于水溶性维生素。它分布很广,植物的绿色部分及许多水果(如橘子、苹果、草莓、山楂等)、蔬菜(黄瓜、洋白菜、西红柿等)中的含量更为丰富。维生素C具有很强的还原性。它可分为还原性和脱氢型。金属铜和酶(抗坏血酸氧化酶)可以催化维生素C氧化为脱氢型。根据它具有还原性质可测定其金属含量。
还原型抗坏血酸能还原染料2,6-二氯酚靛酚(DCPIP),本身则氧化为脱氢型。在酸性溶液中,2,6-二氯酚靛酚呈红色,还原后变为无色。因此,当用此染料滴定含有维生素C的酸性溶液时,维生素C尚未全部被氧化前,则滴下的染料立即被还原成无色。一旦溶液中的维生素C已全部被氧化时,则滴下的染料立即使溶液变成粉红色。所以,当溶液从无色变成微红色时即表示溶液中的维生素C刚刚全部被氧化,此时即为滴定终点。如无其它杂质干扰,样品提取液所还原的标准染料量与样品中所含还原型抗坏血酸量成正比。 本法用于测定还原型抗坏血酸,总抗坏血酸的量常用2,4-二硝基苯肼法和荧光分光光度法测定。
三、实验器材
1、仪器
匀浆机,锥形瓶(100ml),吸量管(10ml),漏斗,纱布,微量滴定管(5ml),容量瓶 (100ml,250ml)。
2、材料和试剂
(1)苹果、卷心菜、桔子等。
(2)2% 草酸溶液: 草酸2g溶于100 ml蒸馏水中。
(3)1% 草酸溶液: 草酸1g溶于100 ml蒸馏水中。
(4)标准抗坏血酸溶液(1mg/ml): 准确称取100 mg纯抗坏血酸(应为洁白色,如变为黄
色则不能用)溶于1%草酸溶液中,并稀释至100 ml,贮于棕色瓶中,冷藏。最好临用前配制。
(5)0.1% 2,6-二氯酚靛酚溶液: 250 mg 2,6-二氯酚靛酚溶于150ml含有52mg NaHCO3的热水中,冷却后加水稀释至250 ml,贮于棕色瓶中冷藏(4℃)约可保存一周。每次临用时,以标准抗坏血酸溶液标定。
四、实验步骤
1、提取
水洗干净整株新鲜蔬菜或整个新鲜水果,用纱布或吸水纸吸干表面水分。然后称取20 g,加入20ml 2%草酸,用研钵研磨,四层纱布过滤,滤液备用。纱布可用少量2%草酸洗几次,合并滤液,滤液总体积定容至50ml。
2、标准液滴定
准确吸取标准抗坏血酸溶液1ml置100ml锥形瓶中,加9ml 1%草酸,用微量滴定管以0.1% 2,6-二氯酚靛酚溶液滴定至淡红色,并保持15s不褪色,即达终点。由所用染料的体积计算出1ml染料相当于多少毫克抗坏血酸(取10ml 1%草酸作空白对照,按以上方法滴定)。
3、样品滴定
准确吸取滤液两份,每份15ml, 分别放入2个锥形瓶内,滴定方法同前。另取10ml 1%草酸作空白对照滴定。
五、实验结果
维生素C含量(mg/100 g样品)=
式中:
VA为滴定样品所耗用的染料的平均毫升数;
VB为滴定空白对照所耗用的染料的平均毫升数;
C为样品提取液的总毫升数;
D为滴定时所取的样品提取液毫升数;
T为1ml染料能氧化抗坏血酸毫克数(由操作二计算出);
W为检测样品的重量(g)。 (?????)×C×T×100D×W六、注意事项:
1、某些水果、蔬菜(如橘子、西红柿等)浆状物泡沫太多,可加数滴丁醇或辛醇。
2、整个操作过程要迅速,防止还原型抗坏血酸被氧化。滴定过程一般不超过2min。滴定所
用的染料不应小于1ml或多于4ml,如果样品含维生素C太高或太低时,可酌情增减样液用量或改变提取液稀释度。
3、本实验必须在酸性条件下进行。在此条件下,干扰物反应进行得很慢。
4、 2%草酸有抑制抗坏血酸氧化酶的作用,而1%草酸无此作用。
5、干扰滴定因素有: 若提取液中色素很多时,滴定不易看出颜色变化,可用白陶土脱色,或加1ml氯仿,到达终点时,氯仿层呈现淡红色。Fe2可还原二氯酚靛酚。对含有大量Fe2+
+的样品可用8%乙酸溶液代替草酸溶液提取,此时Fe2不会很快与染料起作用。样品中可+
能有其它杂质还原二氯酚靛酚,但反应速度均较抗坏血酸慢,因而滴定开始时,染料要迅速加入,而后尽可能一点一点地加入,并要不断地摇动三角瓶直至呈粉红色,于15s内不消退为终点。
6、提取的浆状物如不易过滤,亦可离心,留取上清液进行滴定。
附注:维生素C标定法:为了准确知道标准维生素C含量,须经标定,方法如下:(1)将标准维生素C溶液稀释为0.02 mg/L;(2)量取上述标准维生素C溶液5mL于锥形瓶中,加入6%碘化钾溶液0.5mL, 1%淀粉3滴,再以0.001mol/L碘酸钾标准液滴定,终点为蓝色。 抗坏血酸浓度(mg/mL)=V1*0.088/V2(式中:V1——滴定时所消耗0.001mol/L碘酸钾标准液的量(mL);V2——滴定时所取抗坏血酸的量(mL); 0.088——1mL碘酸钾标准液(0.001mol/L)相当于抗坏血酸的量(mg)。
第二篇:维生素C的定量测定—2,6-二氯酚靛酚滴定法
维生素C的定量测定—2,6-二氯酚靛酚滴定法
实验目的
1. 学习定量维生素C的原理和方法
2. 掌握微量滴定技术
实验原理
维生素C是人类营养中最重要的维生素之一,缺乏时会产生坏血病,因此,又称为抗坏血酸。它对物质代谢的调节具有重要的作用,近年来发现它还能增强机体对肿瘤的抵抗力,并具有对化学致癌物的阻断作用。
维生素C是具有L-系糖构型的不饱和多羟基化合物,属于水溶性维生素。它分布很广,植物的绿色部分及许多水果(桔类、草莓、山楂、辣椒等)的含量都很丰富。
维生素C具有很强的还原性,在碱性溶液中加热并有氧化剂存在时,维生素C易被氧化而破坏。在中性和微酸性环境中,维生素C能将染料2,6—二氯酚靛酚还原成无色的还原型的2,6—二氯酚靛酚,同时将维生素C氧化成脱氢维生素C。氧化型的2,6—二氯酚靛酚在酸性溶液中呈现红色,在中性或碱性溶液中呈兰色。当用2,6—二氯酚靛酚滴定含有维生素C的酸性溶液时,在维生素C尚未全被氧化时,滴下的2,6—二氯酚靛酚立即被还原成无色。但当溶液中的维生素C刚好全部被氧化时,滴下的2,6—二氯酚靛酚立即时溶液呈红色。所以,当溶液由无色变为微红色时即表示溶液中的维生素C刚好全部被氧化,此时即为滴定终点,从滴定时2,6—二氯酚靛酚溶液的消耗量,可以计算出被检物质中还原型维生素C的含量。
其化学反应式如下:
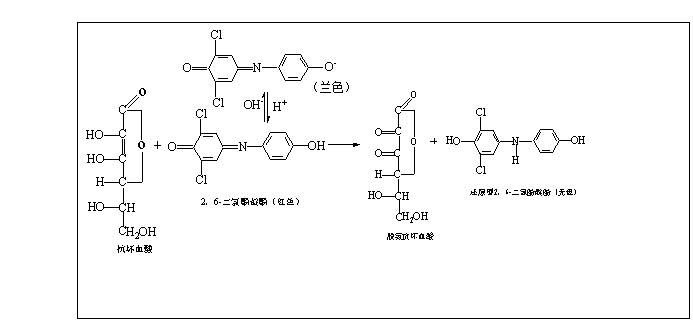
仪器、试剂
(一)仪器:研钵、天平、容量瓶(100ml)、量筒、移液管、锥形瓶(50ml)、微量滴定管、漏斗
(二)材料、试剂
1、新鲜蔬菜或新鲜水果
2、1%草酸溶液
1g草酸溶于100ml蒸馏水中
3、2%草酸溶液
2g草酸溶于100ml蒸馏水中
4、标准维生素C溶液
准确称取20mg纯维生素C 粉状结晶于1%草酸溶液中,稀释至100ml,再取其中10ml稀释至100ml,即得0.02mg/ml的维生素C溶液。在使用前临时配制。
5、0.02%2,6—二氯酚靛酚溶液
溶解50mg2,6—二氯酚靛酚于约200ml含有52mg的NaHCO3的热水中,冷后稀释至250ml,过滤,装于棕色瓶中,放入冰箱中保存。使用时用维生素C标准液标定其浓度。
实验步骤
(一)2,6—二氯酚靛酚溶液的标定:
取5ml维生素C标准液及5ml1%草酸溶液于50ml的锥形瓶中,用配制好的2,6—二氯酚靛酚溶液于微量滴定管中滴定至粉红色出现,并保持15s不褪色,即滴定终点,此时所用染料的体积相当于0.1mg维生素C,由此可求出每ml2,6—二氯酚靛酚溶液相当于维生素C的mg数。
(二)称取新鲜蔬菜或水果(要有大、中、小各部分的代表,洗净,除去不可食部分,切碎,混匀)约10克,于研钵中,加入等体积的2%草酸溶液研磨成浆状,得匀浆液。将匀浆液移入100ml容量瓶中,可用1%草酸溶液帮助转移,加入30%Zn(AC)2和15%K4Fe(CN)6溶液各5ml,脱色,然后用1%的草酸稀释至刻度,充分摇匀 ,静止几分钟后过滤。(弃去最初流出的几毫升溶液)
(三)用移液管吸取滤液5或10ml于50ml的锥形瓶中,立即用标定过的2,6—二氯酚靛酚溶液滴定,直至溶液呈浅粉红色15s不褪色为止。记录所用染料的ml数。为了避免其它物质的干扰,滴定过程不得超过2min。(此步骤平行作2—3次)
(一) 计算
维生素C含量(mg/100g样品)=(VT/W)×100
式中:V为滴定样品所耗用的染料的平均ml数
T为1ml染料相当于维生素C的mg数
W为滴定时所用样品稀释液中含样品的g数

 注意事项
注意事项
1.整个滴定过程要迅速,防止还原型的维生素C被氧化。滴定过程一般不超过2min。滴定所用的染料不应少于1ml或多于4ml,若滴定结果不在此范围,则必须增减样品量或将提取液稀释;
2.本实验必须在酸性条件下进行,在此条件下,干扰物反应进行很慢;
3.提取液中尚含有其它还原性的物质,均可与2,6—二氯酚靛酚反应,但反应速度均较维生素C慢,因而,滴定开始时,染料要迅速加入,而后尽可能一滴一滴地加入,并要不断地摇动锥形瓶直至呈粉红色15s不褪色为终点;
4.若提取液中色素很多时,滴定不易看出颜色变化,需脱色,可用白陶土、30%Zn(AC)2和15%K4Fe(CN)6溶液等,本实验用30%Zn(AC)2和15%K4Fe(CN)6溶液脱色,若色素不多,可不脱色,直接滴定。
5.在生物组织和组织提取液中,维生素C还能以脱氢维生素C及结合维生素C的形式存在,它们同样具有维生素C的生理作用,但不能将2,6—二氯酚靛酚还原脱色.
6. 2%草酸有抑制抗坏血酸酶的作用,而1%的草酸无此作用
思考题
1.指出3—4种维生素C含量丰富的物质。
2.为了准确测定维生素C的含量,实验过程中应注意哪些操作步骤?为什么?
