华南师范大学实验报告
学生姓名 张小静 学 号 20082401057 专 业 化学 年级、班级 08化学4班 课程名称 仪器分析实验 实验项目微分脉冲极谱法测定果汁中维生素C的含量 实验类型 □验证 □设计 □综合 实验时间 2010 年 3月 24日 实验指导老师 孙峰 实验评分
微分脉冲极谱法测定果汁中维生素C的含量
实验目的
1、掌握微分脉冲极谱法的基本原理。
2、掌握伏安极谱法的操作方法。
3、学会使用微分脉冲极谱法测定果汁中的维生素C。
实验原理
脉冲极谱法不仅使用于无机物的定量测定,而且适用于有机物的定量测定。能否可以赢极谱法测定水溶性机制中的有机物,与有机物功能团的氧化还原特性有关。功能团很大程度上决定在汞滴电极的电位窗口是否可以发生氧化还原反应,是否可通过物质的还原或氧化定量测定。脉冲极谱法测定果汁中维生素C的含量是基于抗坏血酸氧化为脱氧抗坏血酸。该反应的氧化还原电位与pH有关:
如果缓冲效果不适宜的话,抗坏血酸的氧化会是电极表面的pH移动,从而导致峰形变宽,在实验中选用乙酸缓冲液可以避免此类情况。
仪器和试剂
1、仪器
瑞士万通797伏安极谱仪
2、试剂:抗坏血酸标准溶液1g/L 乙酸缓冲溶液0.1mol/L乙酸+0.1mol/L乙酸钠;果汁样品。
实验步骤
1、抗坏血酸极谱曲线
在伏安极谱仪软件操作界面选择“Exploratory mode”,选择DP(微分脉冲),
测定20mL乙酸缓冲液中加入200μL抗坏血酸标准溶液,重复实验。实验结果可用于“Determination mode”,确定峰最大的电位值。该峰电位值用于“Determination mode”的自动分析。
2、在伏安极谱仪软件操作界面选择“Determination mode”,通过“Exploratory mode”的伏安法参数。
可通过“Substances”选项保存自动峰形编辑参数。当设置测定参数时,必须准确切换输出格式。依据峰电流高度进行测定。
3、取10mL乙酸缓冲液,加入0.5mL果汁样品溶液,记录样品的测定曲线后,依序2次加入100μL抗坏血酸标准溶液,分别测定峰电流值,采用标准加入法自动计算果汁中维生素C的含量。
结果与讨论
Ⅰ.数据处理—见附表
由数据处理表中,可得出果汁中维生素C中的浓度为307.772mg/L,相对误差为0.74%。仪器分析的相对误差通常为1%~5%,而本实验中的相对误差仅为0.74%,表明用微分脉冲极谱分析法测出的果汁中维生素C的含量较为准备。
Ⅱ.实验讨论:
1.脉冲极谱分析的特点:
改变了方波极谱中方波电压连续的方式,代之以在每一滴汞滴增长到一定的时间时,在直流线形扫描电压上叠加一个10~100mV的脉冲电压,脉冲持续4~80ms。脉冲极谱允许支持电解质的浓度小很多(0.01~0.1mol/L),这有利于降低痕量分析的空白值,还降低了毛细管噪声,对电极反应速度较慢的不可逆电对,其灵敏度亦有所提高。
2、使用标准加入法时应注意以下几点:
1)待测元素的浓度与其相应的吸光度应呈直线关系;
2)为了得到较为精确的外推结果,最少应采用4个点(包括试样溶液本身)来作外推曲线,并且第一份加入的标准溶液与试样溶液的浓度之比应适当,这可通过试喷试样溶液和标准溶液,比较两者的吸光度来判断。增量值的大小可这样选择,使第一个加入量产生的吸收值约为试样原吸收值的一半;
3)本法能消除基体效应带来的影响,但不能消除背景吸收的影响,这是因为相同的信号,既加到试样测定值上,也加到增量后的试样测定值上,因此只有扣除了背景之后,才能得到待测元素的真实含量,否则将得到偏高结果;
4)对于斜率太小的曲线(灵敏度差),容易引进较大的误差。
思考题:
1、 标准加入法有何优缺点?
答:标准加入法适用于样品组分复杂的情况,其缺点是,由于进样多次,进样误差加倍。优点是准确度较高,因为加入的标准溶液体积很小,避免了底液不同所引起的误差。但是如果加入的标准溶液太少,波高增加的值很小,则测量误差大;若加入的量太大,则引起底液组成的变化。所以使用这一方法,加入标准溶液的量要适当。另外要注意的是,只有波高与浓度成正比关系时才能使用标准加入法。
2、测定果汁中维生素C为什么要采用标准加入法?
答:因为果汁组分复杂,待测物含量较低,难以保证试样组成与标准溶液的 条件完全相同,易制成标准溶液。因而要采用标准加入法,并且测量出的信号峰高与待测物的浓度成正比,因而可以采用标准加入法。
3、为什么需要缓冲溶液?
答:缓冲溶液用于调节PH值。如果溶液的PH值不适宜的话,抗坏血酸的氧化
会使电极表明的PH移动,从而导致峰形变宽,使用已酸缓冲溶液可避免此类情况。
第二篇:紫外光度法测定维生素C实验报告
紫外分光光度法测定维生素C片维生素C的含量
一、实验目的
1.学习利用紫外吸收光谱测定物质含量的原理和方法;
2.熟练紫外-可见分光光度计的操作。
二、实验原理
维生素C(VC)是一种酸性己糖衍生物,具有烯醇式己糖内酯立体结构,分D和L两种立体构型,但只有L型有生理功效。维生素C具有较强的还原性,在一定条件下氧化型和还原型可以互变 ,两者均具有生物活性(结构式见图1),其C2和C3位上两个相邻的烯醇式羟基极易解离而释放出H+,故维生素C虽然不含自由羧基,仍具有有机酸的性质。维生素C呈无色无臭的片状结晶体,易溶于水,不溶于脂。在酸性环境中稳定,遇空气中氧、热、光、碱性物质,特别是有氧化酶及痕量铜、铁等金属离子存在时可促进其破坏速度。

具有π电子的共轭双键化合物、芳香烃化合物等,在紫外光谱区都有强烈吸收,其摩尔吸收系数k可达104-106数量级。利用紫外吸收光谱进行定量分析,要借助朗伯-比尔定律。根据维生素C在稀硫酸溶液(维生素C水溶液在pH 5~ 6之间稳定)中,在245 nm 波长处有最大吸收的特性,建立了紫外分光光度法测定维生素C片含量的方法。
三、实验仪器及试剂
实验仪器:容量瓶(100 ml、1000 ml)、移液管(0.5 ml、5 ml)、烧杯、紫外分光光度计
实验用品:98%浓硫酸(分析纯,1.84 g/ml)、维生素C对照品系以原料药经105 ℃干燥至恒重(含量为99.7 %)、维生素C片(2片)、去离子水
四、实验步骤
1. 0.005 mol·L-1硫酸溶液的配制
用0.5 ml移液管移取0.27 ml 98%浓硫酸放入事先已盛有蒸馏水的烧杯中,搅拌,冷却至室温后移入1000 ml容量瓶,稀释至刻度,待用。
2. 0.5 g·L-1 对照品溶液的配制
精密称取105℃ 干燥至恒重的维生素C对照品50 mg置100 ml量瓶中,加0.005 mol·L-1硫酸溶液制成0.5 g·L-1 对照品溶液。
3. 维生素C对照品标准溶液的配制
用5 ml移液管精密量取0.5 g·L-1对照品溶液0.5、1.0、1.5、2.0、2.5 ml,分别置100 ml量瓶中,用0.005 mol·L-1硫酸溶液稀释至刻度,摇匀,待用。
4. 测定波长及标准曲线
以0.005 mol·L-1 硫酸溶液为空白,测定维生素C在稀硫酸溶液中最大吸收波长,并在此波长处测定维生素C对照品标准溶液的吸光度,以浓度对吸光度作线性回归。
5. 样品含量测定
取维生素C片2片,精密称定,研细,精密称取适量(0.06g,约相当于维生素C 50 mg)置100 ml容量瓶中,加0.005 mol·L-1硫酸溶液适量,超声5 min使溶解,再加0.005 mol·L-1硫酸溶液至刻度,摇匀,滤过,弃去初滤液,精密量取续滤液2.0 ml置100 ml量瓶中,加0.005 mol·L-1硫酸溶液至刻度,摇匀,在最大吸收波长处测定吸光度。
6.空白试验
模拟维生素C片处方比例,精密称取辅料适量置100 ml量瓶中,与步骤5样品含量测定同法操作,在最大吸收波长处测定吸收度为0。
7.回收率试验
先测得2 ml样品溶液的吸光度A1(C1),再取0.0125 g/L 的VC 标液200 μl,于2 ml 已测得吸光度A1的样品溶液中,再测得吸光度A2(C2)。
五、实验数据记录及处理
1.维生素的吸收波长
在紫外可见分光光度计上扫描测定VC标准样品的吸收光谱,结果显示VC在244nm波长处的吸光度值最大。
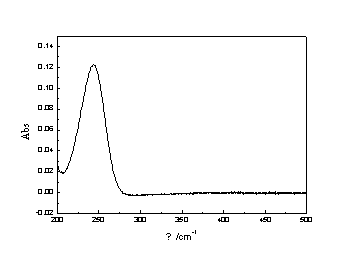
2.维生素C对照品标准曲线

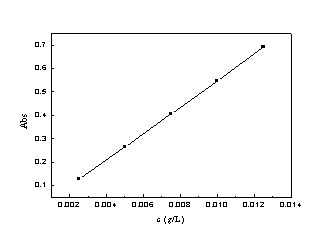
y = 56.3240 x - 0.0150 R=1.0000
3.样品中维生素C含量测定
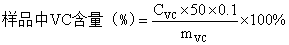
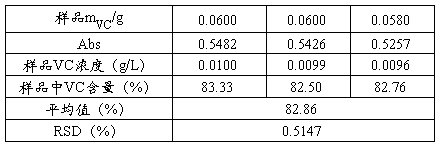
4.回收率试验
先测得2 ml样品溶液的吸光度A1(C1),再取0.0125 g/L 的VC 标液200 μl,于2 ml 已测得吸光度A1的样品溶液中,再测得吸光度A2(C2)。
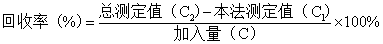

六、实验结果及讨论
1. 维生素C 还原性很强,在空气中易被氧化,在酸性介质中氧化作用减慢,水溶液在pH = 5~6 之间稳定,故本实验选用0.005 mol·L-1硫酸溶液(pH = 5.2)为溶剂,维生素C稳定性好。
2. 标准曲线R=1.0000,且测定的未知样品的吸光度均落在标准曲线有效的范围内,实验结果表明,维生素C在0.0025-0.0125 g/L范围内与吸光度呈良好的线性关系。
3. 由于对加标回收率的原理及概念模糊,导致实验在这一环节消耗较多的时间。本实验测得维生素C的平均回收率为96.65%,相对标准偏差为5.17%。
4. 利用紫外分光光度法测定维生素C片维生素C的含量,该法操作简便,快速,准确,所用试剂价格低廉、易得,适合维生素C 片剂含量测定的快速分析。
