宁波工程学院
物理化学实验报告
专业班级 姓名 序号 实验日期
同组姓名 指导老师
实验名称 氨基甲酸铵分解反应标准平衡常数的测定
一、 实验目的
1、掌握测定平衡常数的一种方法;
2、用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、 实验原理
氨基甲酸铵是白色固体,是合成尿素的中间产物,它很不稳定,易分解成NH3和CO2 。
其分解反应式为:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
在常压下其平衡常数可近似表示为:
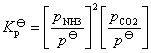
未达到平衡时体系的总压力为p,固体NH2COONH4产生的分压很小,可以忽略不计其中,又体系中的NH3和CO2全部是由氨基甲酸铵分解长生的,所以:
p=pNH3+pCO2
由反应方程式可知
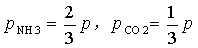
所以:
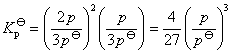
因此可知当体系达平衡后,测量其总压p,即可计算出平衡常数Kθp温度对平衡常数的影响一般都很显著的,其定量关系为:
 (C′为积分常数) (1)
(C′为积分常数) (1)
若以ln Kθp对1/T作图,应为一直线,其斜率为 -ΔrHθm/R。由此可求出ΔrHθm。在一个小的温度区间内,也可用此式计算出此温度区间的平均ΔrHθm。
因为任一温度下的平衡常数与反应的标准自由能变化值间有如下关系:
ΔrGθm =﹣RT ln Kθp (2)
可用平衡常数求出该反应的温度下的ΔrGθm 。
利用实验温度范围内反应的平均等压热效应ΔrHθm和T温度下的标准吉布斯自由能变化ΔrGθm,可近似计算出该温度下的熵变ΔrSθm 。
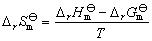 (3)
(3)
三、 实验仪器、试剂
仪器 :循环水泵,低真空数字测压仪,等压计,恒温槽一套,样品管;
试剂 :氨基甲酸铵,液体石蜡。
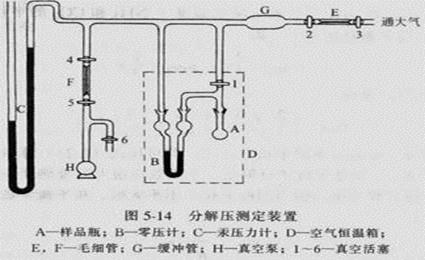
四、 实验步骤
1、由特制的小漏斗将氨基甲酸铵粉末小心装入干燥的球状样品管中,与已装好的液体石蜡的等压计连好。注意不能让液体石蜡进入样品管;
2、开动循环水泵,旋转活塞10与体系相通,旋转活塞10和减压瓶2相通,旋转活塞12至三个方向都通,此时观察到的测压仪数字应不断减小,至低真空测压仪示数为-90KPa以下时,关闭活塞11,检查体系气密性;
3、恒温槽中加水至没过样品管和等压计,调节恒温槽水温至25℃;
4、旋转活塞11,抽吸大约1分钟,把样品管中的空气抽走,然后关闭活塞11.慢慢旋转活塞13,缓慢放入空气进入体系,使U型等压计液面水平。若1分钟内保持液面水平,记下低真空测压仪的读数,即为氨基甲酸铵分解的平衡压力;
5、用同样的方法测25℃,30℃,35℃,40℃,45℃的分解压力;
6、整理实验数据,收拾实验仪器和药品。
五、 数据记录与处理
室温:17.4℃ 大气压力:101.92KPa
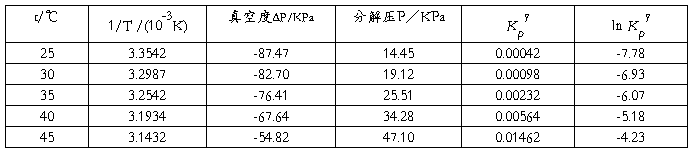

从图中测量所得的斜率为 -1.749×104 ;
ΔrHθm = ﹣(﹣1.749 )× 104 × 8.314 = 145390 J/mol = 145.390 kJ/mol ;
已知25℃时氨基甲酸铵的标准ΔrHθm = 159.32 kJ/mol ;
故相对偏差为 8.74% 。
ΔrGθm =﹣RT ln Kθp = 8.314 × 298.15 × 7.78 = 19285 J/mol = 19.285 kJ/mol ;
ΔrSθm = (ΔrHθm﹣ΔrGθm )/T = (145.390﹣19.285)/298.15 = 0.423 kJ/mol·K =423 J/mol·K
六、 注意事项
1、体系必须平衡后,才能读取数字压力计的压力差;
2、恒温槽温度控制到不相差0.1℃;
3、玻璃等压计中的封闭液一定要选用黏度小,密度小,蒸汽压低。并且与反应体系不 发生作用的液体。
七、 结果与讨论
刚开始实验的时候未能将样品球内的空气完全排尽,对实验有一定的影响;
U型等压计液面等高调节有失误,未能等到液面完全等高便读取数据。
八、 思考题
1、若体系有漏气的地方会发生什么现象?
平衡常数测定仪的示数会一直变大,稳定不下来;
关闭真空泵,关闭阀门,观察平衡常数测定仪的示数是否变化,若变化则说明系统漏气。
2、当空气通入体系时,若通得过多有何现象出现?怎么办?
得到的蒸气压数据就会偏大,平衡常数就会偏大;
开真空包将空气抽出。
第二篇:物化实验:氨基甲酸铵分解反应平衡常数的测定1
宁波工程学院
物理化学实验报告
专业班级 姓名 序号 12 实验日期2012.2.28 同组姓名 指导老师
实验名称 氨基甲酸铵分解反应标准平衡常数的测定
一、实验目的
1 掌握测定平衡常数的一种方法。
2 用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、实验原理
氨基甲酸铵是白色固体,是合成尿素的中间产物,它很不稳定,易分解成NH3和CO2。 其分解反应式为:
NH2COONH4(s)
在常压下其平衡常数可近似表示为:
?Kp2NH3(g)+CO2(g) 2?p3??pCO2???NH ??????p??p?
未达到平衡时体系的总压力为p,固体NH2COONH4产生的分压很小,可以忽略不计其中,又体系中的NH3和CO2全部是由氨基甲酸铵分解长生的,所以
p=pNH+pCO。 3
由反应方程式可知
pNH3?
所以: 21p,pCO2?p 33
2?2p?? Kp???3p??????p?4?p???3p????27??p??? ????3
因此可知当体系达平衡后,测量其总压p,即可计算出平衡常数Kp?温度对平衡常数的影响一般都很显著的,其定量关系为:
??rHmlnK???C' (C′为积分常数) (1) RT?
p
? ? 若以lnK?p对1/T作图,应为一直线,其斜率为-ΔrHm/R。由此可求出ΔrHm。在一个小的温度
区间内,也可用此式计算出此温度区间的平均ΔrH?m。
因为任一温度下的平衡常数与反应的标准自由能变化值间有如下关系:
? ΔrG?m=-RT ln Kp (2)
可用平衡常数求出该反应的温度下的ΔrG?m
? 利用实验温度范围内反应的平均等压热效应ΔrH?m和T温度下的标准吉布斯自由能变化ΔrGm,可近
似计算出该温度下的熵变ΔrS?m ???rHm??rGm ?rS? (3) T?
m
三、 实验仪器与药品
1 仪器 :循环水泵,低真空数字测压仪,等压计,恒温槽一套,样品管。 2 试剂 :氨基甲酸铵,液体石蜡
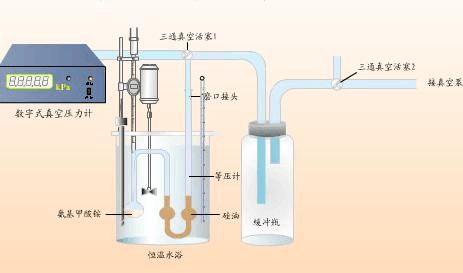
四、 实验步骤
1 由特制的小漏斗将氨基甲酸铵粉末小心装入干燥的球状样品管中,与已装好的液体石蜡的等压计连好。注意不能让液体石蜡进入样品管。
2 开动循环水泵,旋转活塞10与体系相通,旋转活塞10和减压瓶2相通,旋转活塞12至三个方向都通,此时观察到的测压仪数字应不断减小,至低真空测压仪示数为-90KPa以下时,关闭活塞11,检查体系气密性。
3恒温槽中加水至没过样品管和等压计,调节恒温槽水温至25℃
4旋转活塞11,抽吸大约1分钟,把样品管中的空气抽走,然后关闭活塞11.慢慢旋转活塞13,缓慢放入空气进入体系,使U型等压计液面水平。若1分钟内保持液面水平,记下低真空测压仪的读数,即为氨基甲酸铵分解的平衡压力。
5用同样的方法测25℃,30℃,35℃,40℃,45℃的分解压力。
6整理实验数据,收拾实验仪器和药品。
五 、数据记录及处理
室温:11.8℃ 大气压:101.325kPa
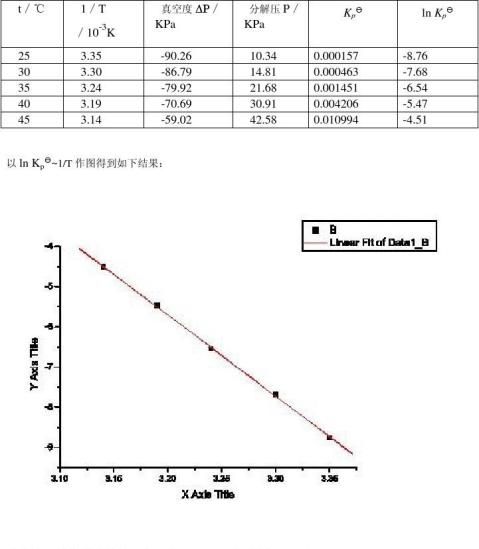
由图可知该直线的斜率为(-4.51+8.76)/(3.14-3.35)*10= -2.02*10 4
则由-ΔrH?m/R = -2.02*10可知:
4ΔrH?m=-2.02*10 *8.314=167.96kJ/mol
查阅资料知25℃氨基甲酸铵分解的ΔrH?m=159.32kJ/mol,
? 25℃时:ΔrG?m=-RT ln Kp=8.314*298.15*8.76=21.72 kJ/mol
由△Grm0=△Hrm0—T△Srm知:
△Srm0=(△Hrm0-△Grm0)/T=(167.96-21.72)/298.15=0.490KJmol-1 K-1
六、注意事项
1.体系必须平衡后,才能读取数字压力计的压力差
2.恒温槽温度控制到不相差0.1℃
3.玻璃等压计中的封闭液一定要选用黏度小,密度小,蒸汽压低。并且与反应体系不发生作用的液体
七、结果与讨论
误差分析:
1.在开始使在U型管中有气泡。
2.液面还没有平衡时或者还没有到达到液面1分钟平衡就读数。
