 宁 波 工 程 学 院
宁 波 工 程 学 院
物理化学实验报告
专业班级 化工095 姓名 孙彬芳 序号 09402010503
同组姓名 陈茜茜、黄云 指导老师蒋仲庆罗利娟实验日期 2011.3.16
实验名称 实验三 氨基甲酸氨分解反应标准平衡常数的测定
一、实验目的
1、 掌握一种测定系统平衡压力的方法—等压法;
2、 测定不同温度下氨基甲酸铵的分解压力;
3、计算相应温度下该分解反应的标准平衡常数、标准摩尔反应焓变△rHθm、标准摩尔反应吉布斯函数变△rGθm及标准摩尔反应熵变△rSθm;
4、掌握真空泵、恒温水浴、大气压计的使用。
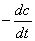 二、实验原理
二、实验原理
氨基甲酸铵是合成尿素的中间体,白色固体,很不稳定,加热时按下式分解:
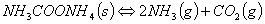 (9.1)
(9.1)
根据化学势判据,分解达到平衡时,反应的标准平衡常数Kθ为:
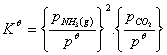
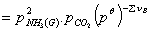
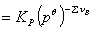 (9.2)
(9.2)
式中: 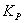
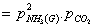 (9.3)
(9.3)
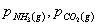 分别为平衡系统中
分别为平衡系统中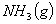 、和
、和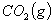 的平衡分压;
的平衡分压;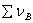 为反应式中各气体物质计量系数之和,产物的
为反应式中各气体物质计量系数之和,产物的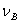 为正,反应物的
为正,反应物的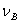 为负。
为负。
因为一定温度下, 固体物质的蒸气压具有定值,与固体的量无关, 因此,平衡系统中氨基甲酸铵的分压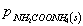 是常数,与平衡常数合并,故在(9.2)式中不出现。
是常数,与平衡常数合并,故在(9.2)式中不出现。
因为温度不高时,固体物质氨基甲酸铵的分压
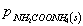 <<
<<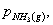
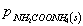 <<
<<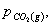
系统的总压等于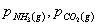 之和,即:
之和,即:
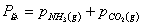 (9.4)
(9.4)
从化学反应计量式可知,1摩尔 分解生成2摩尔
分解生成2摩尔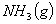 和1摩尔
和1摩尔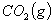 ,则:
,则:
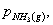 =
=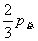 ;
; 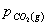 =
=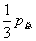 ;
;
将上述关系代入(9.3)式,
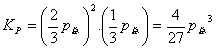 (9.5)
(9.5)
将(9.5)式代入(9.2)式,得标准平衡常数为:
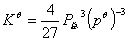 (9.6)
(9.6)
因此,化学反应达到平衡时,测量系统的总压强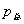 , 由
, 由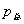 计算出
计算出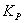 ,进而计算出标准平衡常数
,进而计算出标准平衡常数 。
。
由化学反应等压方程可知,标准平衡常数与温度的关系为:
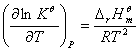 (9.7)
(9.7)
T—绝对温度,K;
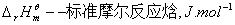 ,当温度在不太大的范围内变化时,
,当温度在不太大的范围内变化时,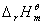 可视为常数.对(9.7)式进行不定积分得:
可视为常数.对(9.7)式进行不定积分得:
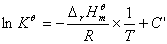 (9.8a)
(9.8a)
或  (9.8b)
(9.8b)
式中C和C’为积分常数。
用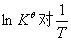 作图,得一直线如(图9.1)所示,直线斜率
作图,得一直线如(图9.1)所示,直线斜率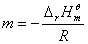 ,由斜率可计算出:
,由斜率可计算出:
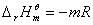
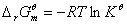
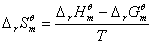
LnKθ
图9.1 lnKθ~1/T 图K/T
三、实验仪器、试剂
仪器:实验装置一套(如图9.2所示);氨基甲酸铵(自制): U型压差计;.玻璃钢水浴;加热器;搅拌器;等压计;温度计;感温元件;缓冲瓶;三通旋塞;毛细管;温度指示控制仪。
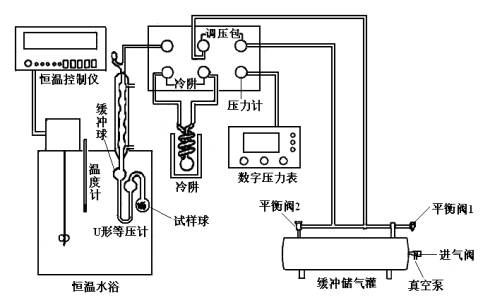 图9.2氨基甲酸铵分解平衡常数测定实验装置图
图9.2氨基甲酸铵分解平衡常数测定实验装置图
试剂:氨基甲酸铵、液体石蜡
四、实验步骤
1. 检漏 按图所示安装仪器。将烘干的小球和玻璃等压计相连,开动真空泵,当测压仪读数约为-94kPa~-95kPa,关闭三通活塞。检查系统是否漏气,待10min后,若测压仪读数没有变化,则表示系统不漏气,否则说明漏气,应仔细检查各接口处,直到不漏气为止。
2. 装样品 确定系统不漏气后,取下干燥的球状样品管装入氨基甲酸铵粉末,与已装好液体石蜡的等压计连好,再按图示装好。
3. 测量 调节恒温槽温度为25℃。开启真空泵,将系统中的空气排出,约1min后,关闭二通活塞,然后缓缓开启三通活塞,将空气慢慢分次放入系统,直至等压计两边液面处于水平时,立即关闭三通活塞,若5min内两液面保持不变,即记下低真空测压仪的读数,即是氨基甲酸胺分解的平衡压力。
4. 重复测量 重复步骤3操作,如果两次测定结果差值小于0.2kPa,可进行下一步实验。
5. 升温测量 调节恒温槽温度,用同样的方法继续测定30℃、35℃、40℃、45℃时的分解压力。
6. 复原 实验完毕,将空气放入系统中至测压仪读数为零,切断电源、水源。
五、数据记录与处理
室温:17.3℃ 大气压:102.02KPa

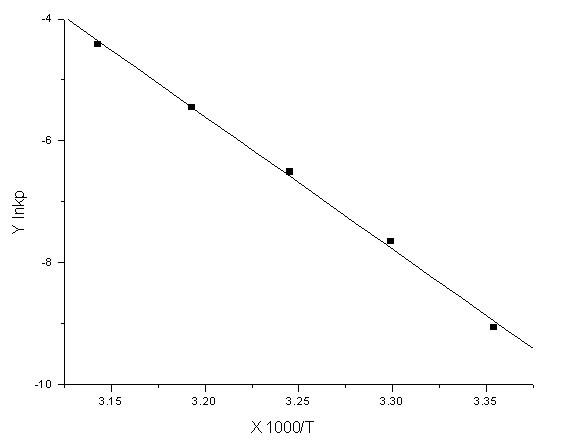
斜率K=-21765
∵ 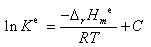
∴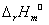 / R = 21765 K
/ R = 21765 K
∴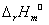 = 21765*8.314 = 180.95*103KJ/mol
= 21765*8.314 = 180.95*103KJ/mol
查阅资料知25℃氨基甲酸铵分解的ΔrH? m=159.32kJ/mol,实验结果偏大
故相对误差=|159.32-180.95|/159.32=0.1358=13.58%
当T=298.17K时
△G= -RTlnK = -2.25*104 J/mol
△S=(△H-△S)/T = (1.81*105-2.25*104)/298.17 = 531.60J/mol
六、结果与讨论
1 . 误差分析:
实验所测得的△Hm 比理论值大,误差产生的主要原因有:开始时系统中空气未完全被抽净;通入空气过量,使读数时液柱未相平,外侧液柱高于内侧液柱;测压仪读数不稳定造成读数误差。
实验讨论:
1、如何检查系统是否漏气?
答:关闭真空泵,关闭阀门,观察平衡常数测定仪的示数是否变化,若变化则说明系统漏气,若变化过快,则需要检查装置重新抽气。
2、为什么要抽净小球泡中的空气?若系统中有少量空气,对实验结果有何影响?
答:需要测定的只是的反应产生的气体的压力,即氨气和二氧化碳的总压,所以空气排除得越干净,得到的数据结果就越准确。如果系统中有少量空气,得到的蒸气压数据就会偏大,平衡常数就会偏大。
3、如何判断氨基甲酸铵分解已达平衡?
答:U型等压计两臂的液面无论是否等高,在1min内,液面不再变化即可认为反应体系已达平衡。
4、根据哪些原则选用等压计中的密封液?
答:应选用蒸气压很小,密度小,粘度小且不与系统中物质发生化学作用的液体。
第二篇:物化-氨基甲酸铵分解反应标准平衡常数的测定
宁波工程学院
物理化学实验报告
专业班级 姓名 序号 实验日期
同组姓名 指导老师
实验名称 氨基甲酸铵分解反应标准平衡常数的测定
一、 实验目的
1、掌握测定平衡常数的一种方法;
2、用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、 实验原理
氨基甲酸铵是白色固体,是合成尿素的中间产物,它很不稳定,易分解成NH3和CO2 。
其分解反应式为:
NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
在常压下其平衡常数可近似表示为:
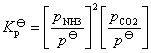
未达到平衡时体系的总压力为p,固体NH2COONH4产生的分压很小,可以忽略不计其中,又体系中的NH3和CO2全部是由氨基甲酸铵分解长生的,所以:
p=pNH3+pCO2
由反应方程式可知
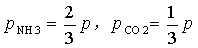
所以:
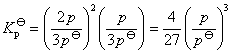
因此可知当体系达平衡后,测量其总压p,即可计算出平衡常数Kθp温度对平衡常数的影响一般都很显著的,其定量关系为:
 (C′为积分常数) (1)
(C′为积分常数) (1)
若以ln Kθp对1/T作图,应为一直线,其斜率为 -ΔrHθm/R。由此可求出ΔrHθm。在一个小的温度区间内,也可用此式计算出此温度区间的平均ΔrHθm。
因为任一温度下的平衡常数与反应的标准自由能变化值间有如下关系:
ΔrGθm =﹣RT ln Kθp (2)
可用平衡常数求出该反应的温度下的ΔrGθm 。
利用实验温度范围内反应的平均等压热效应ΔrHθm和T温度下的标准吉布斯自由能变化ΔrGθm,可近似计算出该温度下的熵变ΔrSθm 。
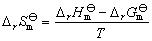 (3)
(3)
三、 实验仪器、试剂
仪器 :循环水泵,低真空数字测压仪,等压计,恒温槽一套,样品管;
试剂 :氨基甲酸铵,液体石蜡。
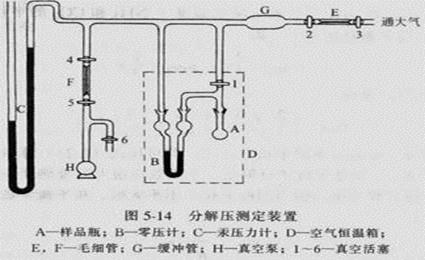
四、 实验步骤
1、由特制的小漏斗将氨基甲酸铵粉末小心装入干燥的球状样品管中,与已装好的液体石蜡的等压计连好。注意不能让液体石蜡进入样品管;
2、开动循环水泵,旋转活塞10与体系相通,旋转活塞10和减压瓶2相通,旋转活塞12至三个方向都通,此时观察到的测压仪数字应不断减小,至低真空测压仪示数为-90KPa以下时,关闭活塞11,检查体系气密性;
3、恒温槽中加水至没过样品管和等压计,调节恒温槽水温至25℃;
4、旋转活塞11,抽吸大约1分钟,把样品管中的空气抽走,然后关闭活塞11.慢慢旋转活塞13,缓慢放入空气进入体系,使U型等压计液面水平。若1分钟内保持液面水平,记下低真空测压仪的读数,即为氨基甲酸铵分解的平衡压力;
5、用同样的方法测25℃,30℃,35℃,40℃,45℃的分解压力;
6、整理实验数据,收拾实验仪器和药品。
五、 数据记录与处理
室温:17.4℃ 大气压力:101.92KPa
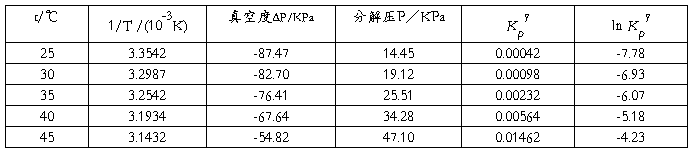

从图中测量所得的斜率为 -1.749×104 ;
ΔrHθm = ﹣(﹣1.749 )× 104 × 8.314 = 145390 J/mol = 145.390 kJ/mol ;
已知25℃时氨基甲酸铵的标准ΔrHθm = 159.32 kJ/mol ;
故相对偏差为 8.74% 。
ΔrGθm =﹣RT ln Kθp = 8.314 × 298.15 × 7.78 = 19285 J/mol = 19.285 kJ/mol ;
ΔrSθm = (ΔrHθm﹣ΔrGθm )/T = (145.390﹣19.285)/298.15 = 0.423 kJ/mol·K =423 J/mol·K
六、 注意事项
1、体系必须平衡后,才能读取数字压力计的压力差;
2、恒温槽温度控制到不相差0.1℃;
3、玻璃等压计中的封闭液一定要选用黏度小,密度小,蒸汽压低。并且与反应体系不 发生作用的液体。
七、 结果与讨论
刚开始实验的时候未能将样品球内的空气完全排尽,对实验有一定的影响;
U型等压计液面等高调节有失误,未能等到液面完全等高便读取数据。
八、 思考题
1、若体系有漏气的地方会发生什么现象?
平衡常数测定仪的示数会一直变大,稳定不下来;
关闭真空泵,关闭阀门,观察平衡常数测定仪的示数是否变化,若变化则说明系统漏气。
2、当空气通入体系时,若通得过多有何现象出现?怎么办?
得到的蒸气压数据就会偏大,平衡常数就会偏大;
开真空包将空气抽出。
