盐酸-氯化铵混合溶液各组分含量的测定
摘要 通过用NaOH溶液测定盐酸-氯化铵混合溶液中各组分的含量。掌握配制NaOH标准溶液的方法,学会用甲醛法进行弱酸的强化,掌握分步滴定的原理与条件。其中HCl为一元强酸,NH4Cl为强酸弱碱盐,两者Ka之比大于105,固可分步滴定。根据混合酸连续滴定的原理,盐酸是强酸,第一步可直接对其滴定,用NaOH滴定,以甲基红为指示剂。氯化铵是弱酸,其Cka≤10-8,无法直接滴定,但可用甲醛将其强化,加入酚酞指示剂,再用NaOH标准溶液滴定。通过两次滴定可分别求出HCl与NH4Cl的浓度。该方法简便易行且准确度高,基本符合实验要求。
关键词 盐酸-氯化铵混合溶液,甲醛法,酸碱滴定法,指示剂
1引言
目前国内外测定盐酸-氯化铵混合溶液中各组分含量的方法有三种:
第一种方案:是蒸汽法:即取一份混合溶液往其中加入适量的NaOH溶液加热使NH4+全部转化为氨气,用2%硼酸溶液吸收,用氢氧化钠标准溶液滴定NH3的体积,再用酸碱滴定法测定HCl的含量,这种方法实验误差较小[1] 。
第二种方案:先测总氯离子的浓度,可用已知浓度的AgNO3溶液滴定待测液,至溶液中出现砖红色沉淀停止,记录所用AgNO3溶液的体积。然后用甲醛法测定NH4+离子的浓度,最后根据计算得盐酸的浓度[2]﹙若对相对误差要求较高,可做空白实验以减小蒸馏水中氯离子带来的系统误差﹚。
第三种方案:先用甲基红作指示剂,用氢氧化钠标准溶液滴至混合溶液呈黄色,即为盐酸的终点。加中性甲醛试剂,充分摇动并放置1分钟,加酚酞指示剂,仍用氢氧化钠滴至溶液由黄色变为金黄色即为氯化铵的终点。根据所消耗NaOH的体积计算各组分的含量,这种方法简便易行,且准确度较高[3]。
本实验采用第三种方案进行盐酸-氯化铵混合溶液中各组分含量的测定。﹙本方法的相对误差约为0.1%,在误差要求范围之内﹚。
2实验原理
HCl和NH4Cl都可以和NaOH反应,反应方程式为:NaOH + HCl= NaCl + H2O 、NH4Cl+NaOH=NH3+H2O+NaCl。又c=0.1mol.L-1 。HCl是一元强酸可用NaOH直接滴定,而NH4Cl是一元弱酸其解离常数太小Ka =5.6´10-10,Ka<104不干扰HCl滴定过程,可以分步滴定,又因为 CKa <10-8,无法用NaOH直接准确滴定,故应该用甲醛强化。反应方程式为:
4NH4++6HCHO = (CH2)6N4H++3H++6H2O
反应生成的(CH2)6N4H+和H+﹙Ka=7.1´10-6﹚可用NaOH标准溶液直接滴定。反应方程式为: (CH2)6N4H++3H++4OH- = (CH2)6N4+4H2O
反应到第一化学计量点时为NH4+弱酸溶液,其中Ka=5.6´10-10,c=0.050mol.L-1 ,由于CKa>10Kw,C/Ka>100,故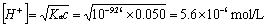 ,pH=5.28故可用甲基红(4.4~6.2)作指示剂,滴定终点为橙黄色。
,pH=5.28故可用甲基红(4.4~6.2)作指示剂,滴定终点为橙黄色。
反应到第二化学计量点时为(CH2)6N4弱碱溶液,其中Kb=1.4´10-9 ,c=0.0250mol.L-1 ,由于CKb>10Kw,C/Kb>100,故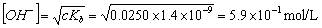 ,pOH=5.23,pH=8.77故采用酚酞(8.2~10.0)作指示剂,滴定终点为橙红色。[4]
,pOH=5.23,pH=8.77故采用酚酞(8.2~10.0)作指示剂,滴定终点为橙红色。[4]
滴定完毕后,各组分的含量为:
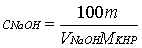
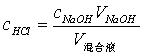

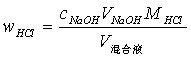

﹙注:因为NaOH溶液不稳定,易与空气中的CO2发生反应,故不能作基准物质,用标定法配制其标准溶液,先粗配成近似于所需浓度的溶液,再用另一种基准物质邻苯二甲酸氢钾配制的标准溶液来标定其准确浓度,指示剂选用酚酞,终点为粉红色。﹚
3实验用品
3.1 仪器:全自动电光分析天平,碱式滴定管﹙50ml﹚,电子秤,移液管(25mL),容量瓶(250mL),3个锥形瓶(250mL),烧杯﹙500 ml,100ml﹚,胶头滴管,玻璃棒,塑料试剂瓶
3.2 药品:0.1 mol/L HCl和0.1 mol/L NH4Cl混合试液,NaOH(s),酚酞指示剂(2g/L),甲基红指示剂(2g/L),甲醛溶液(1:1已中和),邻苯二甲酸氢钾(KHP)基准物质
4实验步骤
4.1 0.1mol/L NaOH标准溶液的配制与标定
4.1.1 0.1mol/L NaOH的配制(有现成配好的NaOH溶液)
4.1.2 0.1mol/L NaOH的标定
在分析天平上用称量瓶称取4-6 g的邻苯二甲酸氢钾于烧杯中,加蒸馏水在使其完全溶解,待溶液完全溶解冷却后,转入250mL容量瓶中,定容。用25.00mL移液管移取3份邻苯二甲酸氢钾,用已配好的NaOH溶液滴定,待锥形瓶中溶液颜色由无色变为微红色,且半分钟不褪色即为终点。平行测定三份,记录数据并根据消耗NaOH溶液的体积计算NaOH标准溶液的浓度和其相对平均偏差(≤0.2%)。
4.2 混合液中各组分含量的测定
4.2.1 HCl含量的测定
用移液管移取20.00mL混合液三份分别置于250mL锥形瓶中,加入2滴甲基红指示剂,充分摇匀,用0.1mol/LNaOH标准溶液滴定至溶液呈现橙黄色,并持续半分钟不褪色即为终点,记录所用NaOH溶液的体积,并计算HCl含量和相对平均偏差(≤0.2%)。
4.2.2 NH4Cl含量的测定
在上述溶液中,继续加入10mL预先中和好的甲醛溶液,加入2滴酚酞指示剂,充分摇匀,放置1分钟,用0.1mol/L NaOH标准溶液滴定至溶液呈现微橙色(黄色与粉红色的混合色),并持续半分钟不褪色即为终点,记录所用NaOH溶液的体积,并计算NH4Cl含量和相对平均偏差(≤0.2%)。
4.3 实验完毕后,将仪器洗涤干净,废液回收到废液桶中,整理好实验台,并登记实验数据。
5实验记录及数据处
5.1 0.1mol/LNaOH溶液标定的数据处理
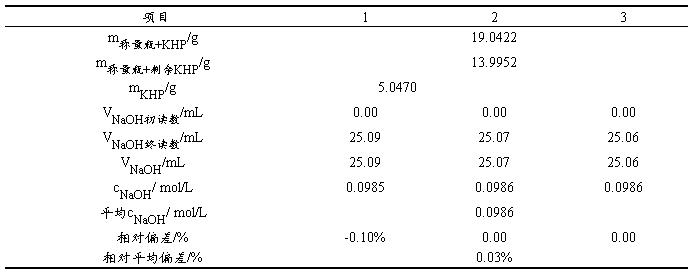
(注:M KHP=204.22g/mol)
5.2 HCl含量的测定

5.3 NH4Cl含量的测定

6实验结果与讨论
6.1 测定结果
本实验采用酸碱滴定法测定0.1 mol/L HCl和0.1 mol/L NH4Cl混合液中各组分的含量,其中所标定NaOH溶液的标准浓度0.09857 mol/L 4;滴定得HCl的浓度为 0.09044mol/L ,含量为:3.297 g/L ;NH4Cl的浓度为 0.09949mol/L ,含量为:5.322g/L 。﹙HCl理论含量是3.646 g/L,NH4Cl的理论含量是5.349 g/L﹚。实验所得结果与理论值较接近,说明此实验方法较好。)
6.2 误差分析
6.2.1 分析天平仪器老化,灵敏度不高,有系统误差;
6.2.2 滴定过程中,有少量溶液滞留在锥形瓶内壁,未用蒸馏水完全冲入溶液中,导致误差;
6.2.3 滴定过程中滴定终点判断有误,读数时有人为误差;
6.2.4 试剂纯度可能不够和蒸馏水中可能含有微量杂质从而引起系统误差。
6.3 注意事项
6.3.1 甲醛溶液对眼睛有很大的刺激,实验中要注意在通风厨中进行;
6.3.2 注意滴定时指示剂的用量,及滴定终点颜色的正确判断;
6.3.3 注意滴定时的正确操作:滴定成线,逐滴滴入,半滴滴入;
6.3.4 确定滴定终点时,要注意在规定时间内不退色再读数;
6.3.5 处理数据时注意有效数字的保留。
6.4 收获体会
分析化学是一门严密的分析课程,对于其每一步,都需要我们认真操作好每一步,认真读取数据并按照其规则准确计算。对待这样一门学科,我们必须严谨认真。而且滴定分析又是分析化学的基础,需要我们掌握好这种滴定方法、滴定终点的判断、以及指示剂的使用等。通过本次实验,我明白了弱酸强化的基本原理,熟练掌握了甲醛法测定铵盐中氮的含量,学会测定混合溶液中相关含量的方法。我相信,通过本次设计性实验,不仅可以熟练分析天平、移液管、滴定管等的使用,还能锻炼我们学会运用已学知识、提高解决问题的综合能力。
参考文献
[1] 蔡维平.基础化学实验(一)[M].北京:科学出版社,2004,298
[2] 武汉大学,吉林大学,中山大学.分析化学实验(第四版)[M].北京:高等教育出版社,2001,181—183
[3] 宋光泉.通用化学实验技术[M].广州:广东高等教育出版社,1999,85
[4] 华中师范大学,东北师范大学,陕西师范大学,北京师范大学编.分析化学实验[M] (第三版).北京:高等教育出版社,2001,58-67
(附英文题目、摘要、关键词)
HCl-NH4Cl mix solution each Component content determination
The abstract Determines the each component in HCl-NH4Cl mix solution, according to the theory of the mixed solution continuous titration. HCl is strong acid , the first steps can by direct titration of NaOH standard solution; But NH4Cl is weak acid , cKa <10-8, therefore being used HCHO to strengthen queen ability by the titration. According to this one principle, and the different indicator choosing,determine the contents blending every liquid middle component thereby. Should determine method , accord with experiment call for basically.
Keywords HCl-NH4Cl mixed acids ,formol-titration method, titrimetry, indicator
(2011.11.21)
第二篇:我的设计实验:HClNH4Cl混合溶液中各组分含量的测定

设计性实验报告
题 目:盐酸-氯化铵混合液中各组分含量的测定
课 程 名 称: 分析化学实验
姓 名:###
学 号: #######
系 别: ###
专 业: ###
班 级:###
指 导 教 师: ###
实 验 学 期:### 至 ### 学年 ### 学期
HCl–NH4Cl混合溶液中各组分含量的测定
###
(系别, 专业,班级,学号)
摘要 通过HCl–NH4Cl混合溶液中各组分含量的测定掌握配制NaOH标准溶液的方法,学会用甲醛法进行弱酸的强化,掌握分步滴定的原理与条件。测定HCl与NH4Cl混合溶液中各组分的含量时,根据混合酸连续滴定的原理。由于HCl是强酸,故第一步可直接对其滴定;而 NH4Cl是弱酸, cKa<10-8, 虽然不能直接对其滴定,但可用甲醛将其强化,再进行滴定,该测定方法简便易行且准确度较高,基本符合实验要求。
关键词 HCl和NH4Cl混合溶液,甲醛法,酸碱滴定法,指示剂,标定
1 引言
测定HCl–NH4Cl混合溶液中各组分的含量的方法有三种:
方法一:先用NaOH标准溶液滴定至酚酞指示剂显微粉色,测定HCl含量,再加KI指示剂, 用AgNO3标准溶液滴定至出现淡黄色AgI沉淀,这是氯离子总量,差减法求出氯化铵的量。该法用酚酞作指示剂,而NH4+显弱酸性 ,最后滴定至终点时,有一部分NH4+与NaOH反应,造成的误差太大[1]。
方法二:使用NaOH标准溶液滴定,用甲基红作指示剂﹙由于滴定终点位于弱酸区﹚出现橙黄色,测定HCl含量。再使用硝酸银进行反应,对沉淀进行称重,测出氯离子总量,差减法求出氯化铵的量。该法对生成的沉淀进行称重,先要分离出沉淀,此时会损失部分沉淀的量,造成的误差也太大[2]。
方法三:使用NaOH标准溶液滴定,先用甲基红作指示剂,滴定至溶液变为橙黄色,测定HCl含量;再用酚酞作指示剂,滴定至溶液变为微粉红色,测定氯化铵的含量。该法操作简便易行且准确度较高,所以我选用方法三进行实验[3]。
2 实验原理
HCl为一元强酸,可直接用NaOH标准溶液滴定;其反应式为:HCl+NaOH=NaCl+H2O
NH4Cl是一元弱酸,其解离常数太小不能用NaOH标准溶液直接滴定,故可用甲醛将其强化,其反应式为:4 NH4+ + 6HCHO = (CH2)6NH4+ +3H+ + 6H2O反应生成的H+和(CH2)6NH4+﹙K=7.1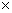 10-6﹚可直接用NaOH标准溶液滴定。
10-6﹚可直接用NaOH标准溶液滴定。
反应到第一化学计量点时为NH4+弱酸溶液,其中Ka=5.6´10-10,c=0.050mol.L-1 ,由于CKa>10Kw,C/Ka>100,故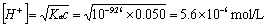 ,pH=5.28故可用甲基红(4.4~6.2)作指示剂,滴定终点为橙黄色。
,pH=5.28故可用甲基红(4.4~6.2)作指示剂,滴定终点为橙黄色。
反应到第二化学计量点时为(CH2)6N4弱碱溶液,其中Kb=1.4´10-9 ,c=0.0250mol.L-1 ,由于CKb>10Kw,C/Kb>100,故 ,pOH=5.23,pH=8.77故采用酚酞(8.2~10.0)作指示剂,滴定终点为橙红色。[4]
,pOH=5.23,pH=8.77故采用酚酞(8.2~10.0)作指示剂,滴定终点为橙红色。[4]
计算公式: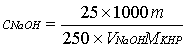
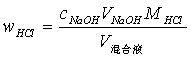
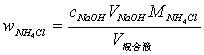
3 试剂仪器
3.1 仪器
全自动分析天平 电子台秤 称量瓶 碱式滴定管(50mL) 移液管(25mL) 烧杯(500mL1个) 锥形瓶(250mL3个) 塑料试剂瓶 玻璃棒 吸耳球
3.2 试剂
0.1mol/LHCl和0.1mol/LNH4Cl混合溶液 邻苯二甲酸氢钾 NaOH固体 酚酞(2g/L) 甲基红(2g/L) 甲醛(1︰1)
4 实验方法
4.1 0.1mol/LNaOH标准溶液的配制和标定
4.1.1 配制
用电子台秤称取NaOH固体2g,放入500mL烧杯中加蒸馏水溶解,继续加蒸馏水至刻度,搅拌摇匀,转入塑料试剂瓶。
4.1.2 标定
在称量瓶中以差减法称量KHC8H4O43份,每份0.4~0.6g,分别倒入250mL锥形瓶中,加入40~50mL蒸馏水,待试剂完全溶解后,加入2~3滴酚酞指示剂,用待标定的NaOH溶液滴定至呈微红色并保持半分钟不褪色即为终点,计算NaOH溶液的浓度和标定结果的相对平均偏差。
4.2 混合溶液中各组分含量的测定
准确移取0.1mol/LHCl和0.1mol/LNH4Cl混合溶液25.00mL置于250mL锥形瓶中,滴加1~2滴甲基红,用已标定的NaOH标准溶液滴定至呈橙黄色,并保持半分钟不褪色即为终点,记录消耗的NaOH溶液的体积。继续加入10mL(1︰1)甲醛溶液,滴加1~2滴酚酞,充分摇匀,放置1分钟后,用NaOH标准溶液滴定至呈微橙红色并保持半分钟不褪色即为终点,记录消耗的NaOH溶液的体积,平行滴定三次。,
4.3 实验完毕后,将仪器洗涤干净并放回原处,废液回收到废液桶中,实验台收拾干净。
5 实验记录与处理
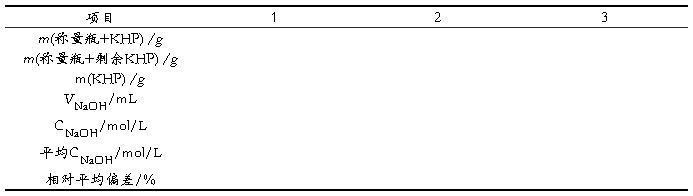
5.1 NaOH溶液标定的数据处理(VKHP=25ml MKHP=204.22 g/mol)
5.2 混合溶液中HCl含量的测定(MHCL=36.46g/mol)
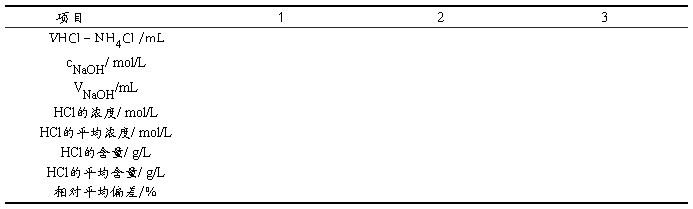
5.3 混合溶液中 NH4Cl含量的测定((MNH4CL=53.49g/mol)
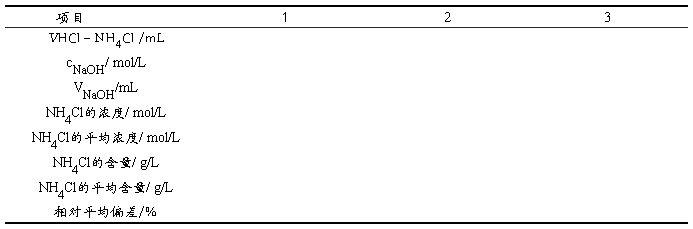
结果与讨论
6.1 结果
6.1.1 NaOH溶液的浓度大于0.1000mol/L,相对平均偏差为0.16%;
测定HCl的含量=4.335 g/L比其理论含量3.646 g/L大,相对平均偏差为0.33%;
测定NH4Cl的含量=5.889比其理论含量5.349 g/L大,相对平均偏差为0.12%。
6.1.2 该测定方法简便易行且准确度较高。
6.2 误差分析
6.2.1 NaOH溶液的浓度大于0.1000mol/L的原因:
1.电子台秤存在系统误差,称得的质量偏大;
2.用烧杯定容时刻度线不准确,体积偏小。
6.2.2 HCl的含量大于3.646 g/L的原因:
1.用移液管移取一定体积时,存在主观误差,量取体积偏小;
2. 滴定过程中尖嘴部分出现气泡,滴定后无气泡,使读数偏大;
3. 滴定终点控制不当,使用NaOH体积偏大。
6.2.3 NH4Cl的含量大于5.349 g/L的原因:
1. 滴定HCl时,NaOH少量,造成滴定NH4Cl时,使用NaOH体积偏大。
6.2.4 由于个人对颜色的变化不敏感,导致终点把握不准。
6.3 注意事项,
6.3.1 注意滴定时指示剂的用量
6.3.2 注意滴定时的正确操作:点滴成线,逐滴滴入,半滴滴入
6.3.3 注意不应过早将NaOH标准溶液装入碱式滴定管,防止NaOH与空气中的CO2反应而部分变质
6.3.4 注意测定混合溶液中各组分含量时,测完一份再移取一份试样进行测定,防止空气中CO2的影响
参考文献
[1] http://zhidao.baidu.com/question/41438089.html
[2] http://ks.cn.yahoo.com/question/1407120104708.html
[3] 武汉大学,吉林大学,中山大学 分析化学实验(第四版)[M] 北京:高等教育出版社,2001,170-172
[4] 蔡维平.基础化学实验(一)[M].北京:科学出版社,2004,298
HCl–NH4Cl mix solution each Component cintent determination
###
(Chemistry department ,applied chemistry specialty,class072,learning numbers 2007122107)
The abstract determines HCl and NH4Cl mix solutionvarious ,according to the principle blending the sour continuous titration blending every solution middle component contents. HCl is strong acid , the first steps but directs on whose titration directly; But NH4Cl is weak acid , the person cKa<10-8 formaldehyde available the person is strengthened , carries out a titration again, that admeasurement method is simple and easy to do and high , basically in keeping with experiment of accurate degree demands.
Keywords HCl–NH4Cl mix solution , formaldehyde models after , sour alkali titrimetric method, indicater, calibrate
收获体会
通过本次实验,我学会了如何对混合酸准确滴定和分步滴定的判别,滴定剂的选择、计量点的计算、指示剂的选择,了解用甲醛法强化NH4+的原理,了解如何用间接法配制标准溶液及其浓度的标定。
