一、选择题:
1、减小偶然误差的方法:( )
A、用标准样作对照实验; B、用标准方法作对照实验;
C、增加平行测定次数,舍去可疑值后,取其余数据平均值;
D、校准仪器。
2、 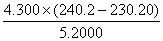 计算式的结果有效数字应为 位?
计算式的结果有效数字应为 位?
A、四位 B、三位 C、二位 D、一位
3、PM= 3.240 的有效数字位数( )
A、四位 B、三位 C、二位 D、一位
4、下列说法正确的是:( )
A、精密度是衡量系统误差大小的尺度;
B、精密度好,则准确度高;
C、精密度好是准确度高的前提;
D、精密度与准确度没有实质性区别。
5、下列四组数据,按Q0.9检验法,只有一组应将逸出值0.2038舍去,这组数据是( )
A、0.2038 0.2042 0.2043 0.2048 0.2052
B、0.2038 0.2048 0.2049 0.2052 0.2052
C、0.2038 0.2046 0.2048 0.2050 0.2052
D、0.2038 0.2044 0.2046 0.2050 0.2052
6、滴定的初读数为(0.05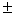 0.01)ml, 终读数为(19.10
0.01)ml, 终读数为(19.10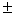 0.01)ml ,滴定剂的体积波动范围:( )
0.01)ml ,滴定剂的体积波动范围:( )
A、(19.05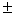 0.01)ml B、(19.15
0.01)ml B、(19.15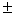 0.01)ml
0.01)ml
C、(19.05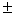 0.02)ml D、(19.15
0.02)ml D、(19.15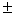 0.02)ml
0.02)ml
7、有五位学生测定同一试样,报告测定结果的相对平均偏差如下,其中正确的是:( )
A、0.1285% B、0.128% C、0.13% D、 0.12850%
8、用差减法从称量瓶中准确称取0.4000g分析纯的NaOH固体,溶解后稀释到100.0ml ,所得 NaOH溶液的浓度为( )
A、小于0.1000mol·l-1 B、等于0.1000mol·l-1
C、大于0.1000mol·l-1 D、上述三种情况都有可能
9、某学生为改善甲基橙指示剂的变色敏锐性,将它与中性染料靛蓝混合,但使用时发现混合指示剂在不同酸度的溶液中具有相近的颜色,对此合理的解释为:( )
A、甲基橙与靛蓝两者颜色没有互补关系
B、靛蓝过量 C、甲基橙过量
D、该混合指示剂在碱性区域变色
10、0.1mol·l-1 NaOH滴定20.00ml 0.1mol·l-1二元酸H2A (Ka1 = 1.0×10-4, Ka2 = 1.0 ×10-6), 要指示可能出现的突跃,应使用的指示剂为( )
A、甲基红和酚酞 B、甲基红或酚酞 C、甲基红 D、酚酞
11、用盐酸标准溶液滴定NH3·H2O—NH4Cl缓冲液中的NH3·H2O的含量,宜采用的方法:
A、先加入甲醛与NH4+作用后,再滴定;
B、先用NaOH标准溶液将NH4+滴定为NH3·H2O,再用HCl滴定NH3·H2O的总量;
C、加入NaOH并加热蒸发NH3用硼酸吸收后滴定;
D、加入甲基红指示剂后直接滴定。
12、某三元酸(H3A)的电离常数Ka1、Ka2、Ka3分别为1.0×10-2、1.0×10-6、 1.0×10-8;当溶液PH = 6.0时,溶液中主要存在形式为:( )
A、H3A B、H2A- C、HA2- D、A3-
13、已知邻苯二甲酸氢钾(KHC8H4O4)的摩尔质量为204.2g/mol , 用它作为基准物质标定0.1mol·l-1NaOH溶液时,如果要消耗NaOH溶液为25ml左右,每份应称取邻苯二甲酸氢钾___________ g左右。
A、0.1 B、0.2 C、0.25 D、0.5
14、已知TNaOH/H2SO4 = 0.004904g/ml ,则NaOH溶液的物质的量浓度为________mol·l-1.
A、0.0001000 B、0.005000 C、0.01000 D、0.05000
15、要使C(HCl)= 0.2000mol·l-1的HCl对NaOH的滴定度为0.005000g/ml ; 应往1升溶液中加入________ml 水。
A、200 B、400 C、600 D、900
16、下列多元酸能被NaOH准确滴定且产生两个突跃范围的是_________ (设浓度均为0.1mol·l-1)
A 、H2C2O4(Ka1=5.6×10-2 , Ka2= 5.1×10-5)
B、H2SO4 (Ka2=1.0×10-2)
C、H2CO3 (Ka1=4.2×10-7, Ka2=5.6×10-11)
D、H2SO3 (Ka1=1.3×10-2, Ka2=6.3×10-7)
17、以NaOH滴定H3PO4 (Ka1=7.5×10-3, Ka2=6.2×10-8 , Ka3=5.0×10-11 )至生成NaH2PO4时溶液的PH值为__________。
A、2.3 B、2.6 C、3.6 D、4.7
18、下列物质中可以作为基准物质的为( )
A、KMnO4 B、Na2B4O7·7H2O C、NaOH D、HCl
19、某弱酸型的酸碱指示剂HIn,指示剂电离常数KHIn , 当溶液PH>1+ KHIn时 , 溶液呈_______( )。
A、无颜色 B、酸式色 C、碱式色 D、混合色
20、用0.1000mol·l-1的HCl标准溶液滴定与其浓度接近的NaOH试液,用中中性红作指示剂,当滴定至溶液呈红色时,终止滴定,此时溶液PH=6.8,则该滴定______________
A、无终点误差 B、有负的终点误差
C、有正的终点误差 D、无法确定
21、在被测溶液中,加入已知量且又过量的标准溶液,当其与被测物质反应完全后,用另一种标准溶液滴定第一种标准溶液的余量,这种滴定法称为____________
A、直接法 B、间接滴定法 C、返滴定法 D、置换滴定法
22、用HCl标准溶液滴定Na2CO3至NaHCO3 , 则用
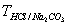 表示C(HCl)的表达式为____________
表示C(HCl)的表达式为____________
A、 B、
B、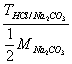 ×10-3
×10-3
C、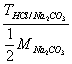 ×103 D、
×103 D、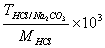
23、为保证滴定分析的准确度,要控制分析过程中各步骤的相对误差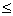 0.1%,用万分之一分析天平差减法称量试样的质量应_________, 用50ml滴定管滴定,消耗滴定剂体积应________
0.1%,用万分之一分析天平差减法称量试样的质量应_________, 用50ml滴定管滴定,消耗滴定剂体积应________
A、≥0.1g , ≥10ml B、≥0.1g , ≥20ml
C、≥0.2g , ≥20ml D、≥0.2g , ≥10ml
24、用HCl标准溶液滴定NaOH试液,该试液在贮存中吸收了CO2,如用酚酞作指示剂,对结果有何影响( )
A、无影响 B、结果偏低 C、结果偏高 D、不好确定
25、滴定分析法主要适用于_____________
A、微量分析 B、痕量成分分析 C、半微量分析 D、常量分析
26、用0.1mol·l-1NaOH滴定0.1mol·l-1的HAc(Pka=4.5)时的PH突跃范围为7.5~9.5 ,由此推论,用0.1mol·l-1NaOH滴定0.1mol·l-1的某一元弱酸(Pka=3.5),其突跃范围为____________
A、6.5~8.5 B、6.5~9.5 C、8.5~10.5 D、8.5~9.5
27、用0.1mol·l-1NaOH滴定0.1mol·l-1的H2C2O4(Ka1=5.9 ×10-2 ,
Ka2= 6.4 ×10-5),则H2C2O4两级离解出来的H+( )
A、分别被准确滴定 B、同时被准确滴定
C、均不能被准确滴定 D、只有第一级电离出来的H+能被准确滴定
28、分析某一试样的含铁量,每次称取试样2.0g ,分析结果报告合理的是( )
A、0.03015% 0.03020% B、0.0301% 0.0298%
C、0.03% 0.03% D、0.030% 0.030%
29、以NaOH标准溶液滴定HCl溶液浓度,滴定前碱式滴定管气泡未赶出,滴定过程中气泡消失,会导致( )
A、滴定体积减小 B、对测定无影响
C、使测定HCl浓度偏大 D、测定结果偏小
30、下列情况使分析结果产生负误差的是( )
A、用盐酸标准溶液滴定碱液时,滴定管内残留有液体;
B、用以标定溶液的基准物质吸湿;
C、测定H2C2O4·2H2O摩尔质量时,H2C2O4·2H2O失水;
D、测定HAc溶液时,滴定前用HAc溶液淋洗了三角瓶。
31、某五位学生测定同一试样,最后报告测定结果的标准偏差,如下数据正确的是( )
A、0.1350% B、0.1358% C、0.14% D、0.136%
32、下列酸碱滴定不能准确进行的是( )
A、0.1mol·l-1的HCl滴定0.1mol·l-1的NH3·H2O (Kb=1.76×10-5)
B、0.1mol·l-1的HCl滴定0.1mol·l-1的NaAc ( K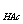 =1.8×10-5)
=1.8×10-5)
C、0.1mol·l-1的NaOH滴定0.1mol·l-1的HCOOH (K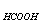 =1.8×10-4)
=1.8×10-4)
D、0.1mol·l-1的HCl滴定0.1mol·l-1的NaCN (K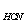 = 6.2×10-10)
= 6.2×10-10)
33、用22.00ml KMnO4溶液恰好能氧化0.1436g Na2C2O4, 则T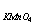 = ________g/ml.
= ________g/ml.
A、0.003079 B、0.001528 C、 0.03452 D、0.01250
(已知M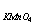 =158.0g/mol ,M
=158.0g/mol ,M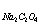 =134.0 g/mol)
=134.0 g/mol)
34、用半自动电光分析天平称量物体时,先调节零点为-0.50mg, 加10.040g砝码后,停点为+0.50mg,则物体重为:______________。
A、10.0410g B、10.0400g C、10.040g D、10.0401g
35、配置NaOH标准溶液,应选择的正确方法:( )
A、分析天平上精确称取一定重量的NaOH于洁净的烧杯中,加蒸馏水溶解后,稀释至所需体积,再标定。
B、分析天平上精确称取一定重量的优质纯NaOH于洁净的烧杯中,加蒸馏水溶解后定容于所需体积的容量瓶中,计算出其准确浓度。
C、台秤上精确称取一定重量的NaOH于洁净的烧杯中,加蒸馏水溶解后定容于所需体积的容量瓶中,计算出其准确浓度。
D、台秤上称取一定重量的NaOH于洁净的烧杯中,加蒸馏水溶解后,稀释至所需体积,再标定。
36、对于酸碱指示剂,下列哪些说法是正确的( )
(1)酸碱指示剂是弱酸或弱碱 (2)随溶液PH值的变化,其颜色会发生变化(3)其变色范围主要取决于指示剂的离解常数(4)指示剂用量越多,则终点变色越明显。
A、[只有(1)、(3)] B、[只有(1)(2)]
C、[只有(1)(2)(3)] D、[(1)(2)(3)(4)都对]
37、用同一NaOH滴定同浓度的一元弱酸HA和二元弱酸H2A(至第一计量点),若Ka(HA)=Ka1(H2A),则下列说法正确的是:( )
A、突跃范围相同; B、滴定一元弱酸的突跃范围大;
C、滴定一元弱酸的突跃范围小; D、突跃范围不能比较大小
38、下列式子中,有效数字位数正确的是:( )
A、[H+]=3.24×10-2 (3位) B、PH=3.24 (3位)
C、0.420 (4位) D、Pka=1.80 (3位)
39、对于系统误差的特性,下列说法不正确的是:( )
A、具有可测性 B、具有单向性 C、具有重复性 D、具有随机性
40、分别用浓度CNaOH=0.1000mol/l和C(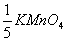 )=0.1000mol/l的两种标准溶液滴定相同质量的KHC2O4·H2C2O4·2H2O, 滴定消耗两种标准溶液的体积关系为:( )
)=0.1000mol/l的两种标准溶液滴定相同质量的KHC2O4·H2C2O4·2H2O, 滴定消耗两种标准溶液的体积关系为:( )
A、4VNaOH = 3VKMnO4 B、VNaOH = 5VKMnO4
C、VNaOH = VKMnO4 D、3VNaOH = 4VKMnO4
41、下列情况中,需用被测溶液漂洗的器皿是( )
A、用于滴定的锥型瓶 B、配置标准溶液的容量瓶
C、移取试液的移液管 D、量取试剂的量筒
42、为0.05mol/L Na3PO4溶液选择OH-浓度的计算公式(H3PO4的Pka1—Pka3=2.12 , 7.21 , 12.66 )
A、[OH-]= 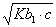 B、[OH-]=
B、[OH-]=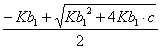
C、[OH-]=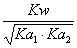 D、[OH-]=
D、[OH-]=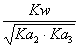
43、等体积的PH=3的HCl溶液和PH=10的NaOH溶液混合后,溶液的PH区间是( )
A、3—4 B、1—2 C、6—7 D、11—12
44、下列定义中不正确的是( )
A、绝对误差是测量值与真实值之差;
B、相对误差是绝对误差在真实值中所占的百分数;
C、偏差是指测定结果与平均结果之差;
D、相对标准偏差是标准偏差与真实值之比。
45、0.1mol·L-1的NaOH溶液的TNaOH/SO2是:( )
A、3.203mg/ml B、6.406mg/ml C、1.602mg/ml D、4.805mg/ml
46、将酚酞指示剂加到某无色溶液中,溶液仍无色,表明溶液的酸碱性为( )
A、酸性 B、中性 C、碱性 D、不能确定其酸碱性
47、下列各酸的酸度相等时,溶液的物质的量浓度最大的是( )
A、HCl B、HAc C、H3BO3 D、H2SO4
48、100ml0.1mol/L的NH3·H20(PKb=4.74)中慢慢滴入等浓度的HCl标准溶80ml时,溶液的PH值为( )
A、1 B、4 C、7 D、8.6
49、0.12mol/L的丙烯酸钠(丙烯酸的Ka=5.6×10-5)的PH值是( )
A、5.33 B、8.66 C、2.59 D、11.41
50、为了防止天平受潮湿的影响,所以天平箱内必须放干燥剂,目前最常用的干燥剂为( )
A、浓硫酸 B、无水CaCl2 C、变色硅胶 D、P2O5
51、已知甲胺PKb=3.38, 苯胺PKb=9.38 甲酸Pka=3.74,以下混合液(各组分浓度为0.1mol/L)中能用酸碱滴定法准确滴定其中强酸(碱)的是( )
A、NaOH—甲胺 B、NaOH—苯胺
C、HCl—甲酸 D、HCl— HAc
52、0.1000mol·L-1EDTA的TEDTA/MgO=( );M(MgO)=40.32g/mol
A、2.016mg/ml B、4.032mg/ml C、1.008mg/ml D、1.344mg/ml
53、某些金属离子(如Ba2+、Mg2+、Ca2+等)能生成难溶的草酸盐沉淀,将沉淀滤出,洗涤后除去剩余的C2O42-后,用稀硫酸溶解,用KMnO4标准溶液滴定与金属离子相当的C2O42-,由此测定金属离子的含量。此滴定方式为( )
A、直接滴定法 B、返滴定法 C、间接滴定法 D、置换滴定法
54、将浓度相同的下列溶液等体积混合,能使酚酞指示剂显红色的溶液时( )
A、氨水+醋酸 B、氢氧化钠+醋酸
C、氢氧化钠+盐酸 D、六次甲基四胺(PKb=8.85)+盐酸
55、以下溶液冲稀10倍PH改变最小的是( )
A、0.1mol·L-1NH4Ac B、0.1mol·L-1NaAc
C、0.1mol·L-1HAc D、0.1mol·L-1HCl
56、0.10mol·L-1NH4Cl(NH3 PKb=4.74)溶液的PH是( )
A、5.13 B、4.13 C、3.13 D、2.87
57、下列溶液中能用NaOH标准溶液直接滴定的是(浓度均为0.1mol·L-1)
A、六次甲基四胺(PKb=8.85) B、吡啶(PKb=8.87)
C、氯化铵(氨水的PKb=4.74) D、盐酸羟胺 (NH2OH·HCl)(NH2OH PKb=8.04 )
58、已知H3PO4的pKa1=2.12 pKa2=7.21 pKa3=12.66,调节溶液pH至6.0时,其各有关存在形式浓度间的关系正确的是( )
A、[HPO42-]>[H2PO4-]>[PO43-] B、[HPO42-] >[PO43-]>[H2PO4-]
C、 [H2PO4-]>[HPO42-]>[H3PO4] D、[H3PO4]>[H2PO4-]>[HPO42-]
59、用0.10mol·L-1NaOH滴定一等浓度的三元酸 (Ka1=6.6×10-3,
Ka2=6.3×10-7 , Ka3=4.0×10-12),若终点误差要求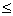
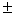 0.2%,则( )
0.2%,则( )
A、有两个滴定终点,第一终点用甲基红,第二终点用酚酞作指示剂
B、有两个滴定终点,第一终点用酚酞,第二终点用甲基红作指示剂
C、只有一个滴定终点,用酚酞做指示剂
D、只有一个滴定终点,用甲基红做指示剂
60、下列结果应以几位有效数字报出( )

A、5位 B、3位 C、4位 D、2位
61、用邻苯二甲酸氢钾标定NaOH溶液浓度时会造成系统误差的是( )
A、用甲基橙作指示剂
B、NaOH溶液吸收了空气中的CO2
C、每份邻苯二甲酸氢钾的质量不同
D、每份加入的指示剂量不同
二、填空题:
1、在未做系统误差校正的情况下,某分析人员的多次测定结果的重复性很好,则他的分析结果准确度____________。
2、减小偶然误差的方法________________________________________。
3、修约下列计算结果,并将结果填入括号内。
(1)12.27 + 7.2 +1.134= 20.064 ( )
(2)(11.124×0.2236 )÷(0.1000×2.0720)= 12.004471( )
(3)0.0025 + 2.5×10-3 + 0.1025 = 0.1075 ( )
4、如要写出NaHCO3水溶液的质子条件,根据零水准的选择标准应确定_________和_______为零水准,质子条件_________________________________________。
5、有一碱液,可能是NaOH或NaHCO3或Na2CO3或它们的混合液,若用标准酸滴定至酚酞终点时,耗去酸的体积为V1ml , 继以甲基橙为指示剂,继续滴定又耗去V2 ml,请依据V1与V2的关系判断该碱液组成:
(1)当V1>V2时,该碱液为_____________________。
(2)当V1<V2时,该碱液为_____________________。
(3)当V1>0 ,V2=0时,该碱液为_____________________。
(4)当V1=0,V2>0时,该碱液为_____________________。
(5)当V1=V2时,该碱液为_____________________。
6、判断下列情况对测定结果的影响(正误差、负误差、无影响)
(1)标定NaOH溶液浓度时,所用基准物质邻苯二甲酸氢钾中含有邻苯二甲酸________
(2)用差减法称取试样时,在试样倒出前后,使用了同一只磨损的砝码___________________
(3)以失去部分结晶水的硼砂为基准物质标定盐酸浓度_ ________________________.
7、以硼砂为基准物质标定盐酸浓度时,反应为:
Na2B4O7 + 5H2O = 2NaH2BO3 + 2H3BO3
NaH2BO3 +HCl = NaCl + H3BO3
则Na2B4O7与HCl反应的物质的量之比为_____________________.
8、计算下列溶液的PH值
(1)0.01 mol·l-1的KOH溶液,PH=____________
(2)PH =4.0 与PH= 10.0的两强电解质溶液等体积混合后,PH =___________
(3)1 mol·l-1 NH3·H2O与1 mol·l-1的HAc等体积混合后PH=________________
9、今有a g 某Na2CO3试样,以甲基橙为指示剂,用浓度为c mol·l-1的HCl溶液滴定,用去b ml (已知Na2CO3的摩尔质量为106.0g/mol) ,则Na2CO3%=__________________。
10、已知吡啶的Kb=1.7×10-9 , 则其共轭酸的Ka=________________。
11、影响酸碱滴定突跃范围的因素有___________________________________,
准确滴定0.1 mol.L-1的某弱酸的条件是__________________________
在酸碱滴定中,选择指示剂的原则__________________________________。
12、用0.1 mol·l-1的NaOH溶液,滴定0.1 mol·l-1的NH4Cl溶液存在下的0.1 mol·l-1的HCl溶液(Kb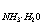 = 1.8×10-5),宜采用________做指示剂,理论终点时PH=______________
= 1.8×10-5),宜采用________做指示剂,理论终点时PH=______________
13、已知T = 0.003284 g/ml ,且M
= 0.003284 g/ml ,且M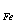 = 55.85 g/mol ,则C(
= 55.85 g/mol ,则C(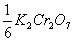 )=__________mol·l-1 .
)=__________mol·l-1 .
14、用0.1mol/l HCl溶液滴定等浓度N2CO3溶液,当滴定至HCO3-时,化学计量点的H+可用__________________公式计算;当继续滴定至H2CO3时,化学计量点的H+可用________________公式计算;如果滴至HCO3-时,消耗HCl溶液体积大于继续滴定至H2CO3时消耗HCl体积,说明N2CO3溶液中含有_________________。
15、某学生标定NaOH所得结果是:0.1010、 0.1014、0.1016,再测定一次所得分析结果不应舍去的界限是____________________________.
(已知 Q0.90 =0.76)
16、已标定好的NaOH标准溶液由于保存不妥吸收了CO2,若用此NaOH滴定H3PO4至第一计量点时,对测定H3PO4浓度有无影响_______________,若用此NaOH滴定H3PO4至第二计量点时,对测定H3PO4浓度有无影响_______________。(偏高、偏低、无影响)
17、 20ml 0.1mol/l的HCl和20ml0.05mol/l的Na2CO3混合,溶液的质子条件式__________________________________________。
18、已知CHCl= 0.2015mol/l ,则THCl =__________________g/ml.
T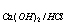 =_____________。(MHCl =36.46g/mol , M
=_____________。(MHCl =36.46g/mol , M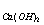 =74.09 g/mol )
=74.09 g/mol )
19、对于一般滴定分析,要求单项测量的相对误差≤0.1%.常用分析天平可以称准至___________mg。用差减法称取试样时,一般至少应称取_______g;50ml滴定管的读数一般可以读准到________ml .故滴定时一般滴定容积控制在________ml 以上,所以滴定分析适用于常量分析。
20、 0.2mol/lHCl溶液滴定20ml0.2mol/l某弱碱BOH(PKb=5.0),当滴定至99.9% 时,溶液的PH值_______________;当滴定至100%时,溶液PH=___________.应选用的指示剂______________(两种)
21、滴定管中所耗滴定剂体积正好是30ml, 应记为_________ ml .读数时眼睛位置高于液面处的刻度,其结果偏__________。
22、实验结果的精密度通常用__________和___________表示,其中用_____________能更好的反映出数据的离散程度。
23、测量样品中Fe3O4含量时,样品经处理先沉淀为Fe(OH)3,再转化为Fe2O3进行称量,则化学因素为______________________ .
24、分析实验中,所用的滴定管、移液管、容量瓶和锥形瓶,在使用前不能用标液或试液漂洗的器皿________________________________。
25、指出下列数字的有效数字位数:
3.0050 是______位有效数字, PH=10.025是____位有效数字,
1.00×10-6是____位有效数字, 6.023×1023(阿佛加德罗常数)是______位有效数字。
26、分析某组分,平行测定四次,结果如下:25.28%、25.29%、 25.30% 、 25.38%,用4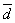 法检验25.38%,应该是否舍弃:____________
法检验25.38%,应该是否舍弃:____________
27、在括号内填入所使用仪器的名称:取称量瓶装入重铬酸钾,称取0.6000g(________)于烧杯中,加蒸馏水40ml,搅拌溶解后定容至250.0ml( ),取出其中25.00ml( )放入锥形瓶中加入10mlH2SO4溶液和10%的KI溶液10ml( ),反应后以Na2S2O3滴定至淡黄色,加入1-2ml( )淀粉溶液,继续滴加Na2S2O3溶液26.52ml( )才达到终点。
28、用NaOH滴定HCl时,若增大两者浓度(温度均为25℃)则计量点的PH值___________________(增大、减小、不变)
29、以HCl标准溶液滴定某碱液浓度,酸式滴定管因未洗干净,滴定时管内挂有液滴,却以错误的体积读数报出结果,则计算碱液浓度______________
30、分光光度法的相对误差一般为_____________;化学分析法的相对误差一般为31、用酸式滴定管滴定时,应用___________手控制活塞,用______手摇锥形瓶。
32、分析实验中,所用的滴定管、移液管、容量瓶和锥形瓶,在使用前不能用标液或试液漂洗的器皿为___________________。、
33、0.01mol·L-1Na2CO3溶液的PH=________________。
(已知H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11)
34、配置NaOH溶液所用的蒸馏水若经过煮沸,冷却后再用可达到____________的目的。
35、(已知H2O2 Pka=12 , C6H5COOH Pka=4.21 , 苯酚 Pka=9.96 , HF Pka=3.14 ) 下列物质(浓度均为0.1mol·L-1)H2O2、C6H5COOH、NaF、苯甲酸钠、苯酚钠,其中能用强碱标准溶液直接滴定的物质为__________________,能用强酸标准溶液直接滴定的物质为__________________。
36、H2CO3 的Pka1=6.37 Pka2 = 10.25, 则Na2CO3的PKb1=___________,
PKb2=________________________.
37、某三元酸(H3A)的离解常数 Ka1 = 1.1 ×10-2 、 Ka2 = 1.0× 10-6、
Ka3=1.2×10-11,则0.1mol·L-1的NaH2A溶液的PH为__________________,
0.1mol·L-1的Na2HA溶液的PH为_______________。
38、H2O、HCOOH、C5H5N(吡啶)中,_____________________是碱,其共轭酸为_
40、用适当位数有效数字表示下列各溶液的PH值:
(1)、[H+] = 1×10-9mol·L-1, PH=________________;
(2) [H+] = 0.50mol·L-1, PH=________________;
41、向0.1mol·L-110ml H3PO4 溶液中加入5ml等浓度的NaOH溶液,溶液的组成是________________,溶液的PH值为____________________。
(已知H3PO4 Pka1— Pka3 2.12、7.21、12.66)
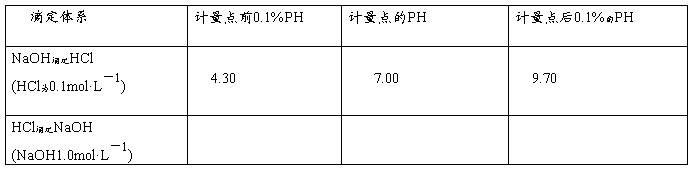
42、根据下表所给的数据判断在以下的滴定中化学计量点以及前后的PH值:
43、H3PO4和Na2C2O4两水溶液的质子条件式分别为
44、0.1mol·L-1NaOH滴定20.00ml相同浓度HAc,写出下表中A、B、C三点滴定体系的组成成分和[H+]的计算公式(以A为例)
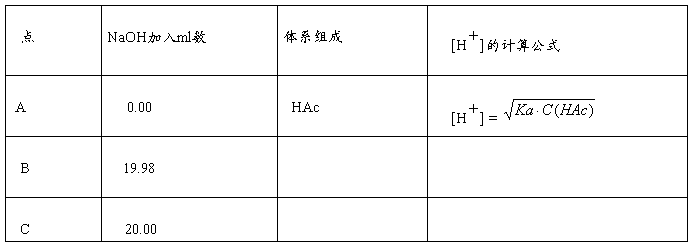
45、某人用HCl标准溶液标定含CO32-的NaOH溶液(以甲基橙作指示剂)然后用该NaOH标准溶液去测定某试样中HAc的含量,则得到HAc含量的结果会______________,又若用以测定HCl—NH4Cl含量,结果会______________。
46、用NaOH标准溶液滴定H3PO4溶液,用酚酞作指示剂的滴定反应式_ ______________________________________。
三、计算题:
1、已知一溶液含有H3PO4 、NaH2PO4、Na2HPO4单独或按不同比例混合,取该试样25.00ml,以酚酞为指示剂,用1.000mol/l的 NaOH 标准溶液滴定至终点,耗NaOH溶液48.36ml ,接着加入甲基橙,以1.000mol/l的HCl标准溶液回滴至终点,耗去HCl33.72ml,问(1)该混合物组成如何?(2)求出各组分含量(g/ml)
(已知H3PO4 : Ka1=7.5×10-3, Ka2= 6.3 ×10-8 , Ka3= 4.4 ×10-13 ,
MH3PO4 =98.00 M NaH2PO4=120.0 M Na2HPO4 =142.0 )
2、计算C(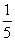 KMnO4) = 0.1000mol·l-1的KMnO4溶液对Fe及Fe2O3的滴定度。
KMnO4) = 0.1000mol·l-1的KMnO4溶液对Fe及Fe2O3的滴定度。
(已知MFe = 55.85 M Fe2O3 =159.69 )
3、在0.2815g含CaCO3及中性杂质的石灰试样中,加入20.00ml0.1175mol/lHCl,然后用5.60mlNaOH滴定剩余的HCl, 已知 1ml NaOH相当于0.9750ml HCl,计算石灰中CaO% 。(已知MCaO =56.00)
4、20.00ml的二元酸H2A,用浓度为0.2000mol/l的NaOH溶液滴定至第一等量点时,用去30.00ml ,测得溶液的PH值为4.90;至第二等量点时,溶液PH=9.70,试计算该二元酸的Ka1和Ka2 。
5、把0.880有机物里的氮转化为NH3 , 然后将NH3 通入20.00ml0.2133mol/l HCl溶液中,过量的酸以0.1962mol/lNaOH溶液滴定,需用5.50ml ,计算有机物中N的百分含量。
(已知 MN = 14.01g/mol )
6、某试样可能是NaOH、NaHCO3 、 Na2CO3及中性杂质或是它们中某二者的混合及中性杂质,现称取该试样0.2000g,用蒸馏水溶解后,用0.1000mol/l的HCl标准溶液20.00ml滴定至酚酞变色,然后加入甲基橙,又用去盐酸溶液10.00ml恰滴定至甲基橙变色,问:(1)该试样组成?(2)求出各组分的百分含量。(已知:M(Na2CO3)=106.0 g/mol M(NaHCO3)= 84.00g/mol M(NaOH)=40.00g/mol )
7、称取2.000g含锰为0.5600%的钢样,溶解后在一定条件下用Na3AsO3-NaNO2标准溶液滴定,用去20.36ml,求Na3AsO3-NaNO2对Mn的滴定度。
8、用0.1mol/lNaOH滴定同浓度的邻苯二甲酸氢钾,计算化学计量点及其前后0.1%的PH值。邻苯二甲酸Pka1= 2.95 , Pka2 = 5.41 .
9、纯净干燥NaOH和NaHCO3以2:1的质量比混合,称取一定量的该混合物溶于水中若使用同一标准盐酸溶液滴定,计算以酚酞作指示剂时所需酸的体积与以甲基橙作指示剂时所需酸的体积之比。M(NaOH)=40.00g/mol M(NaHCO3)=84.01g/mol.
10、酒石酸氢钾(KHC4H4O6)试样2.527g ,溶解后加入25.87ml NaOH与其作用,剩余的NaOH用H2SO4回滴用去1.27ml ,已知1.000 ml H2SO4相当于1.120ml NaOH ,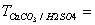 0.02940g/ml , 求KHC4H4O6质量分数。
0.02940g/ml , 求KHC4H4O6质量分数。
已知M(KHC4H4O6)= 188.2 g/mol M(CaCO3) =100.1 g/mol
11、称取0.1891g 纯H2C2O4·2H2O ,用0.1000mol/L的NaOH滴定至终点耗去35.00ml,试通过计算说明该草酸是否失去结晶水?如果按H2C2O4·2H2O的形式计算NaOH浓度会引起多大的相对误差?M(H2C2O4·2H2O)=126.1g/mol
12、用酸碱滴定法测定草酸试样(含H2C2O4·2H2O约90%)中H2C2O4·2H2O的含量,若把试样溶解后在250ml容量瓶中定容,移取25.00ml试样,用0.1mol/L的NaOH滴定,试计算试样的称量范围。
(已知M(H2C2O4·2H2O)=126.1g/mol H2C2O4的 Ka1 = 5.9 × 10-2 Ka2= 6.4× 10-5 )
《定量分析》测试题(B)
班级___________ 姓名___________ 专业____________
一、选择题:
1、莫尔法不适用测定下列哪组离子?( )
A、Cl-和Br- B、Br-和I- C、I-和SCN- D、Cl-和SCN-
2、莫尔法用AgNO3标准溶液滴定NaCl时,所使用的指示剂为( )
A、K2Cr2O7 B、NH4Fe(SO4)2·12H2O C、NH4SCN D、K2CrO4
3 、配位滴定法的直接法终点所呈现的颜色为( )
A、MIn配合物的颜色 B、In的颜色
C、MY配合物的颜色 D、上述A、B的混合色
4 、EDTA的Pka1=2.00, Pka2= 2.67 Pka3=6.18 Pka4 = 10.26,在溶液PH= 5.00的水溶液中,EDTA的主要存在形式( )
A、H4Y B、H3Y- C、H2Y2- D、HY-
5、在PH=9缓冲溶液中,[NH3]=0.1mol/l , lg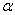 Y(H)=1.28 ,且已知:
Y(H)=1.28 ,且已知:
M Cu2+ Hg2+ Ni2+ Zn2+
LgKf(MY) 18.80 21.70 18.62 16.50
lg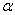 M(NH3) 8.71 15.98 4.34 5.49
M(NH3) 8.71 15.98 4.34 5.49
在金属离子浓度均为0.01mol/l 时,不能被EDTA准确滴定的是( )
A、Cu2+ B、Ni2+ C、Hg2+ D、Zn2+
6、用EDTA滴定金属离子Mn+时,对金属指示剂的要求:( )
A、K MIn/K
MIn/K MY
MY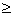 100
100
B、K MIn=K
MIn=K MY
MY
C、K MIn/K
MIn/K MY
MY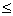 0.01
0.01
D、只要MIn与In颜色有明显差别
7、含Ca2+和Mg2+离子的溶液,调节溶液PH=12后,用EDTA滴定,则可被准确滴定的是( )
A、Ca2+和Mg2+ B、Ca2+
C、Mg2+ D、Ca2+和Mg2+都不能
8、下列因素中可以使配位滴定突跃范围变小的是( )
A、增加氢离子浓度 B、增大EDTA的浓度
C、增大金属离子浓度 D、减小EDTA的酸效应系数
9、金属指示剂的封闭现象是由于( )
A、MIn比MY稳定 B、MY比MIn稳定
C、指示剂变质 D、存在干扰离子
10、已知HF的Ka=6.2×10-4,当PH=3.00时,F-的酸效应系数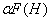 =( )
=( )
A、1.6 B、2.6 C 、 3.6 D、0.6
11、在配位滴定中,常用EDTA二钠盐作标准溶液,下列说法正确的是( )
A、EDTA二钠盐标准溶液应装在碱式滴定管中;
B、EDTA二钠盐标准溶液应装在棕色碱式滴定管中;
C、EDTA二钠盐标准溶液应装在酸式滴定管中;
D、EDTA二钠盐标准溶液应装在棕色酸式滴定管中;
12、取100.0ml水样测定水的硬度时,耗去0.01500mol/lEDTA标准溶液15.75ml,则用CaCO3表示水的硬度(mg/l)为( )已知M(CaCO3)=100.0g/mol
A、23.62 B、236.2 C、2.362 D、2362
13、KMnO4法中一般所用指示剂为( )
A、氧化还原指示剂 B、自身指示剂
C、特殊指示剂 D、金属指示剂
14、下列反应能用于氧化还原滴定反应的是( )
A、K2Cr2O7 与KIO3的反应 B、 K2Cr2O7 与KBrO3的反应
C、K2Cr2O7 与Fe2+的反应 D、K2Cr2O7 与Na2S2O3的反应
15、摩尔吸光系数的单位为( )
A、L/mol·cm B、mol/L·cm C、g/mol·cm D、cm/mol·L
16、分光光度法中,为了减小测量误差,理想的吸光度读数范围为( )
A、0.2—1.2 B、0.5—2.5 C、0.2—0.7 D、0.05—0.9
17、下列表述不正确的是( )
A、吸收光谱曲线表明了吸光度随波长的变化;
B、吸收光谱以波长为纵坐标,吸光度为横坐标;
C、吸收光谱曲线中,最大吸收处的波长为最大吸收波长;
D、吸收光谱曲线表明了吸光物质的光吸收特性。
18、天平的零点是指( )
A、天平没有载重时的平衡位置;
B、天平负载50g时的平衡位置;
C、天平负载100g时的平衡位置;
D、天平负载10g时的平衡位置.
19、用分析天平进行称量的过程中,加减砝码或取放物体时,应先把天平梁托起,这主要是为了( )
A、称量速度减慢 B、减小玛瑙刀口磨损
C、防止天平摆动 D、防止指针跳动
20、某学生在用Na2C2O4标定KMnO4溶液浓度时,所得结果偏高,原因主要是( )
A、将Na2C2O4溶解加H2SO4后,加热至沸,稍冷即用KMnO4溶液滴定,
B、在滴定的开始阶段,KMnO4溶液滴加过快,
C、终点时溶液呈较深的红色;
D、无法判断
21、用K2Cr2O7滴定Fe2+时,常用H2SO4-H3PO4混合酸作介质,加入H3PO4的主要作用是( )
A、增大溶液酸度 B、增大滴定的突跃范围
C、保护Fe2+免受空气氧化 D、可以形成缓冲体系
22、光吸收定律中的比例常数可分别用K、a、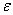 三种符号表示,这三者中,数值的大小与液层厚度和组成量度所取单位有关的是( )
三种符号表示,这三者中,数值的大小与液层厚度和组成量度所取单位有关的是( )
A、K B、a C、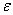 D、K、a、
D、K、a、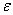
23、下列措施中,与改变吸光光度分析的灵敏度无关的( )
A、改变被测溶液的浓度 B、改变被测溶液的温度
C、改变入射光波长 D、采用不同的显色剂
24、用KMnO4法滴定H2O2时,调节酸性的酸是( )
A、HAc B、HCl C、H2SO4 D、HNO3
25、用间接碘量法测定Cu2+,加入过量KI,可以是(1)作溶剂(2)作标准溶液(3)作还原剂(4)作沉淀剂(5)作指示剂。正确的是( )
A、(1)和(2) B、(2)和(3) C、(3)和(4) D、(4)和(5)
26、某溶液在阳光(白光)下呈兰色,在钠光(黄光)下呈( )
A、黄色 B、兰色 C、无色 D、黑色
27、 下列情况使测定结果偏高的是( )
A、显色时间短、有色物未充分显色;
B、酸度过高,显色剂酸效应严重;
C、干扰离子与显色剂生成有色化合物
D、干扰离子与显色剂生成无色化合物
28、可见吸光光度法中选择参比溶液时,若试液无色,显色剂有色,应选( )
A、溶液空白 B、试剂空白
C、样品空白 D、褪色空白
29、下列标准溶液应装在碱式滴定管中的是( )
A、KMnO4 B、EDTA C、AgNO3 D、Na2S2O3
30、某溶液遵循光吸收定律,当浓度为C时透光率为T,当浓度为2C,液层厚度不变时,透光率为( )
A、2T B、T C、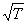 D、T2
D、T2
31、用浓度为C(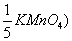 的KMnO4标准溶液测定V1 ml H2O2试液时,耗去KMnO4标准溶液体积为V2 ml,则该试液中H2O2的含量(g/ml)为( )
的KMnO4标准溶液测定V1 ml H2O2试液时,耗去KMnO4标准溶液体积为V2 ml,则该试液中H2O2的含量(g/ml)为( )
(设H2O2的相对分子量为M)
A、 B、
B、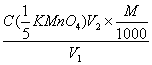
C、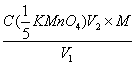 D、
D、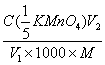
32、对于对称性的氧化还原反应:n2Ox1+ n1Red2 = n2Red1+ n1Ox2,若n1=3, n2=1,
反应的完全程度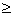 99.9%,则lg
99.9%,则lg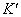
 和
和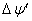 应为( )
应为( )
A、lg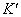
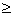 6 ,
6 ,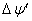
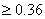 (V)
(V)
B、lg
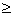 9 ,
9 ,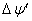
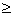 0.27(V)
0.27(V)
C、lg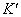
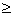 12 ,
12 ,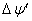
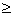 0.24(V)
0.24(V)
D、lg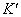
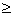 12 ,
12 ,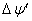
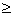 0.15(V)
0.15(V)
33、提高光度分析灵敏度的方法有( )
A、增加显色剂用量 B、增加被测溶液用量
C、选择适当的参比溶液 D、选择合适的入射光
34、用光度法测定某试液时,若A>0.8,为提高其读数的准确度,应采取的最简便的措施是( )
A、减小入射光波长 B、稀释被测液
C、改换厚度较小的比色皿 D、改换厚度较大的比色皿
35、影响摩尔吸光系数的因素有( )
A、比色皿厚度 B、有色物质颜色的深浅
C、入射光波长 D、溶液的酸度
36、已知TK2Cr2O7/Fe = 0.003284 g/ml ,且MFe = 55.85 g/mol ,则C( =
=
( )mol/l
A、0.05880 B、0.3528 C、0.5880 D、0.005880
37、下列物质可采用直接法配置标准溶液的是( )
A、KMnO4 B、K2Cr2O7 C、Na2S2O3 D、EDTA
38、用光度比色计测量CuSO4溶液的吸光度,应选用________颜色的滤光片,该溶液能最大程度的吸收__________颜色的光。
A、兰 兰 B、绿 黄 C、黄 黄 D、黄 兰
39、一束单色光通过厚度为1cm的有色溶液后,强度减弱20%,当它通过厚度为5cm的相同溶液时,强度将减弱( )
A、42% B、 58% C、67% D、78%
40、用22.00ml KMnO4溶液恰能氧化0.1436 gNa2C2O4 ,则TKMnO4 = ______g/ml.
已知MKMnO4= 158.0 g/mol MNa2C2O4 = 134.0 g/mol
A、0.003079 B、0.001526 C、0.03452 D、0.01250
41、间接碘量法中,常用淀粉作指示剂,其终点颜色的变化是:( )
A、黄色到兰色 B、黄色到无色 C、无色到兰色 D、兰色褪去
42、在H3PO4存在下的HCl溶液中,用0.02mol·l-1的K2Cr2O7溶液滴定0.1
mol·L-1 的Fe2+溶液,其计量点的电位为0.86v ,对此滴定最适宜的指示剂为:( )
A、次甲基蓝(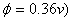 B、邻二氮菲—亚铁(
B、邻二氮菲—亚铁(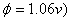
C、二苯胺磺酸钠(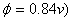 D、二苯胺(
D、二苯胺(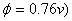
43、用KIO3标定Na2S2O3溶液时,指出下列操作哪步是错误的( )
A、在分析天平上准确称取适量KIO3于碘量瓶中,加蒸馏水溶解
B、加入适量KI及H2SO4,在室温下放置于实验台上一段时间后,用Na2S2O3滴定
C、滴定溶液转化为淡黄色时,加入淀粉指示剂
D、继续滴定终点兰色正好褪去,即为终点
44、配置0.05mol·L-1I2标准溶液500ml时,经过下列四步,哪步操作是错误的( )
A、在台秤上称取6.5g I2及20g KI;
B、放在研钵内,加少量纯水研磨至碘完全溶解;
C、将溶液定量转入500ml容量瓶中,稀释至刻度摇匀;
D、贮藏于暗处备用。
M(I2) = 254 g/mol M(KI)=166g/mol
45、已知EDTA的离解常数分别为10-0.9 , 10-1.6 ,10-2.0 ,10-2.67,10-6.16,10-10.26,则在PH值为2.67—6.16的溶液中,EDTA的最主要存在形式( )
A、H3Y- B、H2Y2- C、HY3- D、 Y4-
二、填空题
1、已知Fe2+的浓度为560ug/l的溶液,显色后在2.00cm的比色皿中测得吸光度为0.2,则有色化合物的摩尔吸光系数为_____________ L·mol-1·cm-1.
(已知Fe的式量为55.85 )
2、用C(KMnO4)=a mol/l 的高锰酸钾溶液滴定某草酸时消耗高锰酸钾Vml,若用C(NaOH)=b mol/l的氢氧化钠溶液滴定该草酸时,消耗NaOH溶液为_________ml 。
3、用Ce(SO4)2标准溶液滴定FeSO4(滴定反应Ce4++Fe2+=Ce3++Fe3+),当滴定至99.9%时溶液的电位是___________伏。滴定至化学计量点时是__________伏。滴定至100.1%又是____________伏。
(已知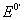 Fe3+/Fe2+=0.68V
Fe3+/Fe2+=0.68V 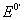 Ce4+/Ce3+=1.44V )
Ce4+/Ce3+=1.44V )
4、滴定管中所耗滴定剂体积正好为30ml,应记为___________ml ,读数时眼睛位置高于液面处的刻度,其结果会偏__________________。
5、测定样品中Fe3O4含量时,样品经过处理先沉淀为Fe(OH)3,再转化为Fe2O3进行称量,则化学因素为_________________________。
6、用EDTA滴定金属离子生成MY配合物时,当介质的PH越高,则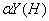 越______,
越______, 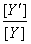 比值越______,生成物MY的稳定性越____________.
比值越______,生成物MY的稳定性越____________.
7、草酸盐标定KMnO4标准溶液的反应式为____________________________,反应条件为____________________、________________、_____________________、________________________。
8、在PH=10时,用EDTA滴定Mg2+,溶液中首先加入铬黑T指示剂,此时溶液呈______色,当滴入EDTA后,先与EDTA反应的是_______________,达到计量点时,溶液呈_____色,其原因__________________________________________。
9、佛尔哈德法测定溶液中的I-离子时,应先加过量的AgNO3标准溶液,再加指示剂,原因____________________________________________________
10、在莫尔法中,一般要控制指示剂用量为2.0×10-3—4.0×10-3mol/l,如指示剂用量偏高,对测定溶液中卤素离子含量结果__________________。
11、EDTA与金属离子配位反应的特点___________________、________________、__________________、________________________。
12、利用佛尔哈德法测定溶液中的Cl-离子时,在滴定前可在溶液中加入硝基苯,其原因___________________________________________________
13、为下列操作选用一种实验室中常用的玻璃仪器,写出名称以及规格。
A、量取8ml浓HCl以配置0.1mol/lHCl标准溶液,用_________量取。
B、用直接法配置250.0ml重铬酸钾标准溶液,用__________________.
C、取25.00ml醋酸未知液(用NaOH标准液滴定其含量)用_____量取.
D、作分光光度法的曲线时,分别移取2.00 4.00 6.00 8.00 10.00ml标准液,用____________
E、间接碘量法中,用重铬酸钾作基准物质标定Na2S2O3,标定时用___________来盛装硫代硫酸钠标准溶液。
14、EDTA配合物的条件稳定常数K 随溶液的酸度而变化,溶液的酸度越高,EDTA的酸效应系数越__________,K
随溶液的酸度而变化,溶液的酸度越高,EDTA的酸效应系数越__________,K 越_________,滴定时PM突跃范围越___________。
越_________,滴定时PM突跃范围越___________。
15、已知lgKf(FeY)=14.32, PH=3.0时,lgaY(H)=10.60,因此在PH=3.0的溶液中,Fe2+_______被EDTA准确滴定。
16、间接碘量法测定胆矾中的Cu2+,若不加KSCN,将会导致测定结果偏________。
17、溶液颜色是由于它对不同波长的可见光具有______________而产生的。
18、用重铬酸钾法测定亚铁盐中的铁(用容量瓶配置样品溶液,以二苯胺磺酸钠为指示剂),如果滴定管未洗净,滴定时管内壁挂有液滴,将导致测定结果偏_________,如果不加H3PO4, 将导致测定结果偏___________.测定操作中需用操作液润洗的仪器有____________________.
19、在盐酸溶液中,用KMnO4标准溶液测定Fe2+时,分析结果往往会偏高,其原因_______________________________________________________
20、在EDTA与金属离子的配位滴定中,需要加入缓冲溶液,其原因_________________________________________________________________
21、为降低某电对的电极电位,可加入能与________形成稳定配合物的配合剂,若要增高电对的电极电位,可加入能与______________形成稳定配合物的配合剂。
22、同一物质,浓度不同,吸收光谱的形状_______________,最大吸收波长__________。
23、溴的测定是将试样分解为Br-后,使其氧化为BrO3-。在除去氧化剂后,加入过量的KI,以Na2S2O3标准溶液滴定反应产生的碘,从而计算溴的含量。Br-与Na2S2O3的物质的量之比____________________。
24、EDTA若保存于软质玻璃瓶中,会使其浓度不断降低,原因是______________________________________________________________,
故EDTA标准溶液应贮存在___________________瓶中。
25、按有效数字规则记录测量结果,得到如下数据,请分别写出所用仪器和规格:称取5.0g试样用的是________________;称取5.0000g试样用的是___________________;量取5.0ml溶液用的是___________________,量取5.00ml溶液用的是______________________。
26、40.00ml H2C2O4溶液,需20.00ml0.2000mol·L-1 NaOH溶液才能完全中和,而同体积的H2C2O4溶液在酸性介质中要加20.00ml KMnO4溶液才能完全反应,此KMnO4____________________________________。
27、(NH4)2HPO4水溶液的质子条件式__________________________________。28、硼砂标定HCl,若选用甲基橙指示滴定终点,会使HCl体积用量_____________,标定HCl溶液浓度_____________________.
29、甲基橙+靛蓝二磺酸钠混合指示剂,与甲基橙比较其优点_ ________________________________,如果用HCl标准溶液滴定Na2CO3时,用该混合指示剂,则滴定终点溶液颜色由______色变为__________色。
30、0.1000mol·L-1NaOH标准溶液,因保存不当吸收了CO2,当用此碱液测定HCl溶液浓度,滴至甲基橙变色时,则测定结果_______________,用它测定HAc溶液浓度时,测定结果______________(填偏高、偏低或无影响)
三、计算题
1、称取纯CaCO30.5005克,溶解后定容至200.00ml,然后用移液管移取20.00ml于锥形瓶中,在PH=12.5时加入钙指示剂,用EDTA标准溶液滴至终点,消耗标准溶液20.00ml,计算C(EDTA)以及TEDTA/Al2O3
(已知M(CaCO3)=100.1g/mol M(Al2O3)=120.0g/mol )
2、称取不纯的KI试样0.5180g,用已知过量的重铬酸钾0.1940g处理后,将溶液煮沸,除去析出的I2,然后加入过量的纯KI与剩余的重铬酸钾作用,这时析出的I2要用C(Na2S2O3)=0.1000mol/L的溶液10.00ml 完成滴定,计算试样中KI%.
( M(KI)=166.0g/mol M(K2Cr2O7)= 294.2g/mol )
3、有一标准的Fe3+离子溶液的浓度为6ug/ml,其吸光度为0.304,有一液体试样,在同一条件下测得其吸光度为0.510,求试样溶液中铁含量为多少毫克/升?
4、对一EDTA溶液,用26.00ml标准钙溶液(每毫升含CaO0.001000g)来标定,用去EDTA25.26ml.现称取含钾的试样0.6842g处理成溶液,将K+全部转化为K2Na[Co(NO3)6]沉淀,沉淀经过滤、洗涤、溶解后,用上述EDTA溶液滴定其中的Co3+,消耗EDTA26.50ml。
(1)求EDTA的物质的量浓度
(2)求试样中K的百分含量
(3)若以K2O的百分含量表示又为多少
(已知McaO=56.08g/mol MK=39.10g/mol MK2O=92.20g/mol)
5、用KIO3标定Na2S2O3溶液的浓度,称取KIO3356.7mg ,溶于水并稀释至100.0ml. 移取所得溶液25.00ml , 加入硫酸和碘化钾溶液,用24.98mlNa2S2O3溶液滴定析出的碘,求Na2S2O3溶液的浓度。(已知MKIO3 = 214.0g/mol)
6、某试样含Ni约0.12%,用丁二酮肟比色法(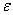 =1.3×104)进行测定,若试样溶解后转入100ml容量瓶中,加水稀释至刻度,在波长470nm处,用1cm比色皿测定,若希望测得的吸光度A的读数在0.2—0.8范围内,应称取试样多少g ?
=1.3×104)进行测定,若试样溶解后转入100ml容量瓶中,加水稀释至刻度,在波长470nm处,用1cm比色皿测定,若希望测得的吸光度A的读数在0.2—0.8范围内,应称取试样多少g ?
(MNi = 58.7 g/mol)
7、在有色配合物MR2的溶液中CM =5×10-5mol/L , CR = 2×10-5 mol/L,在一定波长下用1.00cm比色皿测得吸光度A=0.200,已知摩尔吸光系数为4×104 ,求(1)该配合物MR2的浓度,(2)若lg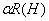 =2 ,lg
=2 ,lg M(L)=0, MR2无副反应,计算该配合物总条件稳定常数和总绝对稳定常数。
M(L)=0, MR2无副反应,计算该配合物总条件稳定常数和总绝对稳定常数。
8、已知氯霉素化学式为C11H12O5N2Cl2 , 现分析眼药膏中氯霉素含量。称取1.18g ,经分解使其中的有机氯转化为无机氯离子后,加入AgNO3试剂的AgCl沉淀0.0150g ,求眼药膏中氯霉素的质量分数。M(氯霉素)=323.1g/mol; M(AgCl)=143.3g/mol
9、欲求KMnO4溶液准确浓度,今称取Fe(NH4)2(SO4)2·6H2 O 0.6411 g ,在一定条件下用KMnO4溶液滴定,终点时耗去KMnO4 20.75ml , 求C(KMnO4)。
M(Fe(NH4)2(SO4)2·6H2 O) = 392.1g/mol
10、血液中钙的测定,采用KMnO4法间接测定钙。取10.0ml血液试样,先沉淀为草酸钙,再以硫酸溶解后,用0.00500mol·L-1KMnO4标准溶液滴定消耗其体积5.00ml,试计算每10ml血液中含钙多少毫克?
11、某有色溶液在2.00cm 吸收池中,测得百分透光率T%=50 ,若改用(1)1cm(2)3cm厚的吸收池时,其T%和A各为多少?
12、某有色溶液置于1cm吸收池中,测得吸光度为0.30 ,则入射光强度减弱了多少?若置于3cm的吸收池中,则入射光强度又减弱了多少?
《定量分析》期终考试模拟试题(一)
专业___________姓名__________成绩__________
一、选择题:(每小题有且只有一个正确答案,将正确答案的序号填写在题后的括号内,每小题2分,共36分)
1、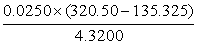 计算式的结果为几位有效数字?( )
计算式的结果为几位有效数字?( )
A、四位 B、三位 C、两位 D、五位
2、下列四组数据,按Q值检验法,只有一组应将逸出值0.2038舍去,这组数据是( )
(已知当n=3、4、5时,Q0.90相应为0.94、0.76、0.64)
A、0.2038 0.2042 0.2043 0.2048 0.2052
B、0.2038 0.2048 0.2049 0.2052 0.2052
C、0.2038 0.2046 0.2048 0.2050 0.2052
D、0.2038 0.2044 0.2046 0.2050 0.2052
3、用HCl标准溶液滴定NH3·H2O-NH4Cl缓冲液中NH3·H2O含量,宜采用的方法( )
A、先加甲醛与NH4+作用后,再滴定;
B、先加NaOH标准溶液将NH4+滴定为NH3·H2O,再用HCl滴定NH3·H2O总量;
C、加入NaOH并加热蒸发NH3用硼酸吸收后滴定;
D、加入甲基红指示剂后直接滴定;
4、以0.1000 mol/L NaOH滴定20.00ml 0.1000mol/LH3PO4溶液(已知H3PO4的Ka1=7.5×10-3, Ka2=6.2×10-8 , Ka3=5.0×10-11)至生成NaH2PO4时溶液的PH值为( )
A、 2.3 B、2.6 C、3.6 D、4.7
5、已知TK2Cr2O7/Fe = 0.003284 g/ml ,且MFe = 55.85 g/mol ,则C(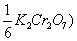 =( )mol/l
=( )mol/l
A、0.05880 B、0.3528 C、0.5880 D、0.005880
6、用0.1000mol·l-1的NaOH标准溶液滴定与其浓度接近的HCl试液,用酚酞作指示剂,当滴定至溶液呈红色时,终止滴定,此时溶液PH=7.2,则该滴定______________
A、无终点误差 B、有负的终点误差
C、有正的终点误差 D、无法确定
7、用HCl标准溶液滴定Na2CO3至NaHCO3 , 则用
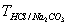 表示C(HCl)的表达式为____________
表示C(HCl)的表达式为____________
A、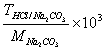 B、
B、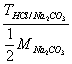 ×10-3
×10-3
C、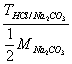 ×103 D、
×103 D、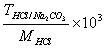
8、下列物质可采用直接法配置标准溶液的是( )
A、KMnO4 B、K2Cr2O7 C、Na2S2O3 D、EDTA
9、配位滴定法的直接法终点所呈现的颜色为( )
A、MIn配合物的颜色 B、In的颜色
C、MY配合物的颜色 D、上述A、B的混合色
10、已知EDTA的离解常数分别为10-0.9 , 10-1.6 ,10-2.0 ,10-2.67,10-6.16,10-10.26,则在PH值为8.0的溶液中,EDTA的最主要存在形式( )
A、H3Y- B、H2Y2- C、HY3- D、 Y4-
11、在PH=10缓冲溶液中,[NH3]=0.1mol/l , lg Y(H)=2.67 ,且已知:
Y(H)=2.67 ,且已知:
M Cu2+ Hg2+ Ni2+ Zn2+
LgKf(MY) 18.80 21.70 18.62 16.50
lg M(NH3) 7.71 15.98 4.34 5.49
M(NH3) 7.71 15.98 4.34 5.49
在金属离子浓度均为0.01mol/l 时,不能被EDTA准确滴定的是( )
A、Cu2+ B、Ni2+ C、Hg2+ D、Zn2+
12、、金属指示剂的封闭现象是由于( )
A、MIn比MY稳定 B、MY比MIn稳定
C、指示剂变质 D、存在干扰离子
13、已知H2C2O4的Ka1=5.90×10-2, Ka2=6.40×10-5,当PH=5.00时,C2O42-的酸效应系数:( )
A、1.16 B、2.16 C、3.16 D、4.16
14、体积相同的两份H2C2O4溶液,一份可与Vml0.1000mol/L的KMnO4溶液完全反应,另一份用NaOH溶液完全中和也需要Vml,则该NaOH溶液浓度为_____________mol/L。
A、0.1000 B、0.2500 C、0.5000 D0.05000
15、用光度比色计测量CuSO4溶液的吸光度,应选用________颜色的滤光片,该溶液能最大程度的吸收__________颜色的光。
A、兰 兰 B、绿 黄 C、黄 黄 D、黄 兰
16、某溶液遵循光吸收定律,当浓度为C时透光率为T,当浓度为C/2,液层厚度不变时,透光率为( )
A、2T B、T C、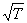 D、T2
D、T2
17、对于对称性的氧化还原反应:n2Ox1+ n1Red2 = n2Red1+ n1Ox2,若n1=2, n2=1,反应的完全程度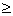 99.9%,则lg
99.9%,则lg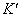
 和
和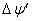 应为( )
应为( )
A、lg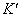
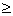 6 ,
6 ,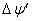
 (V)
(V)
B、lg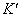
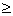 9 ,
9 ,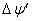
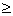 0.27(V)
0.27(V)
C、lg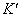
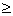 12 ,
12 ,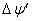
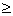 0.24(V)
0.24(V)
D、lg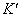
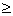 15 ,
15 ,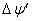
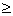 0.15(V)
0.15(V)
18、用浓度为C(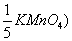 的KMnO4标准溶液测定V2 ml H2O2试液时,耗去KMnO4标准溶液体积为V1 ml,则该试液中H2O2的含量(g/100ml)为( ) (设H2O2的相对分子量为M)
的KMnO4标准溶液测定V2 ml H2O2试液时,耗去KMnO4标准溶液体积为V1 ml,则该试液中H2O2的含量(g/100ml)为( ) (设H2O2的相对分子量为M)
A、 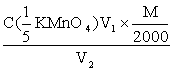
B、 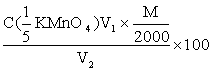
C、
D、 ×100
×100
二、填空题:(共30分,每空2分)
1、如要写出NaHCO3水溶液的质子条件,根据零水准的选择标准应确定_________________为零水准,质子条件___________________________
2、用0.1 mol·l-1的NaOH溶液,滴定0.1 mol·l-1的NH4Cl溶液存在下的0.1 mol·l-1的HCl溶液(Kb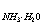 = 1.8×10-5),理论终点时PH=______________。
= 1.8×10-5),理论终点时PH=______________。
3、今有a克某Na2CO3试样,以酚酞作指示剂,用浓度为c mol/L的HCl溶液滴定,耗去b ml,则Na2CO3%=________________。
(已知Na2CO3的分子量为M)
4、用Ce4+标准溶液滴定Fe2+溶液,滴定反应为Ce4++ Fe2+ = Ce3++ Fe3+,当滴定至99.9%时溶液的电位___________伏,滴定至化学计量点时为______________伏,滴定至100.1%时又是______________伏。
5、要使C(HCl)= 0.1000mol·l-1的HCl对NaOH的滴定度为0.002000g/ml ; 应往1升溶液中加入________ml 水。
6、某酸碱指示剂的KHIn=1.0×10-6,则从理论上推算其变色范围PH==_________________,某氧化还原指示剂,其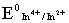 =0.85v,则其理论变色范围E=____________伏。
=0.85v,则其理论变色范围E=____________伏。
7、已知KMnO4溶液浓度为158.0 g/L,此溶液在2.00cm比色皿中测得其吸光度为0.35,则该有色化合物溶液的摩尔吸光系数_________________L·mol-1·cm-1。(已知KMnO4的式量为158.0)
g/L,此溶液在2.00cm比色皿中测得其吸光度为0.35,则该有色化合物溶液的摩尔吸光系数_________________L·mol-1·cm-1。(已知KMnO4的式量为158.0)
8、在HCl溶液中,用KMnO4标准溶液测定Fe2+时,分析结果往往会偏高,其原因____________________________________________________。
9、准确滴定0.01mol/L的某弱酸的条件__________________________;
用EDTA准确滴定1.0×10-2mol/L的某金属离子,应满足的条件_________________________。
10、佛尔哈德法测定溶液中的I-离子时,应先加过量的AgNO3标准溶液,再加指示剂,其原因________________________________________。
三、计算题:(共34分)
1、称取含有NaOH和Na2CO3的试样0.7225g,溶解后稀释定容至100.0ml,取20.00ml以甲基橙作指示剂,用0.1135mol/L的HCl溶液26.12ml滴定至终点,另取一份20.00ml试样,加入过量BaCl2溶液,用酚酞作指示剂,用20.27mlHCl滴定至终点,计算试样中NaOH和Na2CO3的百分含量。(10分)
(已知M(NaOH)=40.00 , M(Na2CO3)=106.0)
2、0.1200g工业甲醇,在H2SO4溶液中与25.00ml C( Cr2O7)=0.1160mol/L的K2Cr2O7作用,反应完成后,以邻苯氨基苯甲酸作指示剂,用0.1000mol/L 的Fe2+溶液滴定剩余的K2Cr2O7,用去10.60ml,求试样中甲醇的百分含量。(10分)
Cr2O7)=0.1160mol/L的K2Cr2O7作用,反应完成后,以邻苯氨基苯甲酸作指示剂,用0.1000mol/L 的Fe2+溶液滴定剩余的K2Cr2O7,用去10.60ml,求试样中甲醇的百分含量。(10分)
(已知M(甲醇)=32.00)
Cr2O72- + CH3OH+ 8H+ = CO2 + 2Cr3+ + 6H2O
Cr2O72- + 6 Fe2+ + 14 H+ = 2 Cr3+ + 6 Fe2+ + 7H2O
3、有一标准的Fe3+离子溶液的浓度为6ug/ml,其吸光度为0.304,有一液体试样,在同一条件下测得其吸光度为0.510,求试样溶液中铁含量为多少毫克/升?(6分)
4、称取钢样1.0000g,将钢样溶解后,将其中的磷沉淀为磷钼酸铵
((NH4)7[P(Mo2O7)6]),用0.1000mol/L的NaOH溶液20.00ml溶解沉淀,过量的NaOH用0.2000mol/L的HNO37.50ml滴定至酚酞刚好褪色,计算钢样中P%以及P2O5%。(已知M(P)=30.97,M(P2O5)=141.94)
《定量分析》期终模拟试卷二
校名___________ 系名__________ 专业____________
姓名___________ 学号__________ 日期____________
一、选择题:在下列各题中,分别有代码为A、B、C、D的4个被选答案,将正确答案的代码填入题末的( )中。
(本大题为18小题,每小题2分,共36分)
1、有四位学生测定同一试样,报告分析结果的相对误差如下,其中正确的是( )
A、0.1020% B、0.102% C、0.10% D、0.101%
2、下列物质在滴定时,应装在碱式滴定管中的是( )
A、K2Cr2O7 B、AgNO3 C、Na2H2Y D、Na2S2O3
3 、下列四组数据,按Q0.9检验法,只有一组应将逸出值0.2052舍去,这组数据是( )
A、0.2038 0.2040 0.2040 0.2047 0.2052
B、0.2038 0.2041 0.2042 0.2042 0.2052
C、0.2038 0.2042 0.2045 0.2048 0.2052
D、0.2038 0.2042 0.2047 0.2048 0.2052
4、要使C(HCl)=0.1000mol·L-1的HCl对NaOH的滴定度为0.002000g/ml , 应向1升溶液中加入___________ml的水。( )
A、600 B、800 C、1000 D、1200
5、下列酸碱滴定不能准确进行的是( )
A、0.1mol·l-1的HCl滴定0.1mol·l-1的NH3·H2O (Kb=1.76×10-5)
B、0.1mol·l-1的HCl滴定0.1mol·l-1的NaAc ( K =1.8×10-5)
=1.8×10-5)
C、0.1mol·l-1的NaOH滴定0.1mol·l-1的HCOOH (K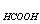 =1.8×10-4)
=1.8×10-4)
D、0.1mol·l-1的HCl滴定0.1mol·l-1的NaCN (K = 6.2×10-10)
= 6.2×10-10)
6、配置NaOH标准溶液,应选择的正确方法:( )
A、分析天平上精确称取一定重量的NaOH于洁净的烧杯中,加蒸馏水溶解后,稀释至所需体积,再标定。
B、台秤上精确称取一定重量的NaOH于洁净的烧杯中,加蒸馏水溶解后定容于所需体积的容量瓶中,计算出其准确浓度。
C、台秤上称取一定重量的NaOH于洁净的烧杯中,加蒸馏水溶解后,稀释至所需体积,再标定。
D、分析天平上精确称取一定重量的优质纯NaOH于洁净的烧杯中,加蒸馏水溶解后定容于所需体积的容量瓶中,计算出其准确浓度。
7、分析实验中,下列哪组实验仪器在使用前不能用标液或试液漂洗的是( )
A、滴定管 移液管 容量瓶 锥形瓶
B、滴定管 移液管
C、容量瓶 锥形瓶 D、 移液管 容量瓶 锥形瓶
8、以HCl标准溶液滴定某碱液浓度,酸式滴定管因未洗干净,滴定时管内挂有液滴,却以错误的体积读数报出结果,则计算碱液浓度( )
A、偏高 B、偏低 C、无影响 D、无法判断
9、下列情况使测定结果偏高的是( )
A、显色时间短、有色物未充分显色;
B、酸度过高,显色剂酸效应严重;
C、干扰离子与显色剂生成有色化合物
D、干扰离子与显色剂生成无色化合物
10、某溶液遵循光吸收定律,当浓度为C时透光率为T;当浓度为C/2时(液层厚度不变),透光率为( )
A、T B、T/2 C、 T2 D、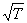
11、已知TK2Cr2O7/Fe = 0.003284 g/ml ,且MFe = 55.85 g/mol ,则C(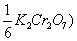 =
=
( )mol/l
A、0.05880 B、0.3528 C、0.5880 D、0.005880
12、一束单色光通过厚度为1cm的有色溶液后,强度减弱20%,当它通过厚度为4cm的相同溶液时,强度将减弱( )
A、59% B、41% C、 36% D、64%
13、下列表述不正确的是( )
A、吸收光谱以波长为纵坐标,吸光度为横坐标;
B、吸收光谱曲线表明了吸光度随波长的变化;
C、吸收光谱曲线表明了吸光物质的光吸收特性。
D、吸收光谱曲线中,最大吸收处的波长为最大吸收波长;
14、用AgNO3标准溶液直接滴定NaCl溶液测定Cl-含量时,所使用的指示剂为( )
A、K2Cr2O7 B、NH4Fe(SO4)2·12H2O C、NH4SCN D、K2CrO4
15 、配位滴定法的直接法终点所呈现的颜色为( )
A、MIn配合物的颜色 B、In的颜色
C、MY配合物的颜色 D、上述A、B的混合色
16、用EDTA滴定金属离子Mn+时,对金属指示剂的要求:( )
A、K MIn/K
MIn/K MY
MY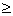 100
100
B、K MIn/K
MIn/K MY
MY 0.01
0.01
C、K MIn=K
MIn=K MY
MY
D、只要MIn与In颜色有明显差别
17、有一碱液,可能是NaOH或NaHCO3或Na2CO3或它们的混合液,若用标准酸滴定至酚酞终点时,耗去酸的体积为V1ml , 继以甲基橙为指示剂,继续滴定又耗去V2 ml,当V1=V2时,该碱液组成为( )。
A、Na2CO3与NaOH B、NaHCO3与Na2CO3 C、Na2CO3 D、NaHCO3
18、100ml0.1mol/L的NH3·H20(PKb=4.74)中慢慢滴入等浓度的HCl标准溶液100ml时,溶液的PH值为( )
A、5.13 B、4.74 C、3.74 D、5.28
二、填空题:(本大题共30)
1、(本小题2分)
某学生标定KMnO4所得分析结果是:0.1025、0.1027、0.1032,再测定一次所得分析结果不应舍去的的界限是:______________________ 。(Q0.90=0.76)
2、(本小题2分)
20ml 0.1mol/l的HCl和20ml0.1mol/l的Na2CO3混合,溶液的质子条件式__________________________________________。
3、(本小题2分)
测定样品中P2O5含量时,样品经处理先沉淀为Mg3(PO4)2,再转化为单质P进行称量,则化学因素为________________________。
4、(本小题4分)
采用K2Cr2O7法测定绿矾中铁含量时,常采用_______________作指示剂,终点时颜色变化_____________________,除了用H2SO4 作酸性介质外,还加入一定量的H3PO4 ,主要原因_______________________________________________。
5、(本小题4分)
在HCl介质中,用KMnO4测定Fe2+的含量时,结果往往偏______,其原因___________________________________________________________________ 。
6、(本小题3分)
用Ce(SO4)2标准溶液滴定FeSO4(滴定反应Ce4++Fe2+=Ce3++Fe3+),当滴定至99.9%时溶液的电位是___________伏;滴定至化学计量点时是__________伏;滴定至100.1%又是____________伏。
(已知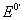 Fe3+/Fe2+=0.80V
Fe3+/Fe2+=0.80V 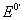 Ce4+/Ce3+=1.60V )
Ce4+/Ce3+=1.60V )
7、(本小题3分)
用EDTA滴定金属离子生成MY配合物时,当介质的PH越高,则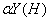 越______,
越______, 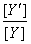 比值越______,生成物MY的稳定性越____________.
比值越______,生成物MY的稳定性越____________.
8、(本小题4分)
在PH=10时,用EDTA滴定Mg2+, 溶液中首先加入铬黑T指示剂,此时溶液呈______色,当滴入EDTA后,先与EDTA反应的是_______________,达到计量点时,溶液呈_____色,其原因_________________________________________________________________。
9、(本小题4分)
对于一般滴定分析,要求单项测量的相对误差≤0.1%.常用分析天平可以称准至___________mg,用差减法称取试样时,一般至少应称取_______g;
50ml滴定管的读数一般可以读准到________ml ,故滴定时一般滴定容积控制在________ml 以上,所以滴定分析适用于常量分析。
10、(本小题2分)
用强碱滴定0.10mol·L-1的某弱酸,准确滴定的前提条件___________________ ;
用EDTA滴定0.010mol·L-1的某金属离子,可以被准确滴定的条件__________。
三、计算题:(本大题共4小题,共计34分)
1、(本小题8分)称取纯NaHCO31.008g溶于适量水中,然后往此溶液中加入纯固体NaOH0.3200g,最后将此溶液移入250ml容量瓶中。移取上述溶液50.00ml,以0.1000mol·L-1HCl溶液滴定。计算(1)以酚酞为指示剂滴定至终点时,消耗HCl溶液多少毫升?(2)继续加入甲基橙指示剂滴定至终点时,又消耗HCl溶液多少毫升?(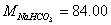 ,
, = 40.00 )
= 40.00 )
2、(本小题8分)称取含氟矿样0.5000g,溶解,在弱碱性介质中加入0.1000
mol·L-1 Ca2+溶液50.00ml ,将沉淀过滤,收集滤液和洗液,然后于PH=10.00时用0.05000mol·L-1EDTA返滴定过量的Ca2+至化学计量点,消耗20.00ml.计算矿样中氟的百分含量。(MF = 19.00 )
3、(本小题10分)准确称取铁矿样0.2000g , 用HCl分解后,加预处理剂SnCl2将Fe3+还原为Fe2+,需22.50mlKMnO4与之反应。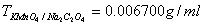 ,求铁矿样中Fe的百分含量。
,求铁矿样中Fe的百分含量。
(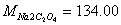
 )
)
4、(本小题8分) 现取某含铜试液2.00ml定容至100.00ml.从中吸取2.00ml显色定容至50.00ml ,用1cm的吸收池测得吸光度为0.400。已知显色络和物的摩尔吸光系数为1.1×104L·mol-1·cm-1。求该含铜试液中铜的含量(以g·L-1计)。 ( 已知MCu=63.50 )
参考答案
《定量分析》测试题A
一、选择题:
1、 C 2、B 3、B 4、C 5、B 6、C 7、C 8、A
9、 B 10、D 11、D 12、C 13、D 14、C 15、C 16、D
17、D 18、B 19、C 20、C 21、C 22、A 23、C 24、B
25、D 26、B 27、B 28、C 29、C 30、C 31、C 32、D
33、A 34、A 35、D 36、C 37、B 38、A 39、D 40、A
41、C 42、B 43、A 44、D 45、A 46、D 47、C 48、D
49、B 50、C 51、B 52、B 53、C 54、B 55、A 56、A
58、C 59、A 60、D 61、B
二、填空题:
1、不一定高
2、取多次测定的平均值
3、(1)20.1 (2)12.00 (3)0.1
4、HCO3- H2O [H2CO3] + [H+] = [CO32-] +[OH-]
5、(1) NaOH + Na2CO3
(2) Na2CO3 + NaHCO3
(3) NaOH
(4) NaHCO3
(5) Na2CO3
6、(1)负误差 (2)无影响 (3) 负误差
7、1:2 8、(1)12 (2) 7.0 (3) 7.0
9、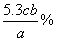 10、5.8×10-6
10、5.8×10-6
11、Ka(Kb) 以及C , Ka≥10-7 , 指示剂的变色范围应全部或部分位于滴定突跃范围内
12、 甲基红 5.28
13、 0.05880 14、 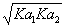
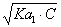 NaOH
NaOH
15、0.09910< x < 0.1036
16、 无 偏高
17、[ H+] = [HCO3-] +2[CO32-] +[OH-]
18、0.007347 0.007465
19、0.1 0.2 0.01 20
20、6.0 5.0 甲基红或甲基橙
21、30.00 大
22、偏差 标准偏差 标准偏差
23、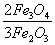 24、容量瓶 锥形瓶
24、容量瓶 锥形瓶
25、5 3 3 不确定 26、不舍弃
27、分析天平 容量瓶 移液管 量筒 量筒 滴定管
28、不变 29、偏大
30、2—5% 0.1—0.2%
31、左 右 32、容量瓶 锥形瓶
33、11.13 34、除去 CO2的目的
35、C6H5COOH 苯酚钠
36、3.75 7.63
37、3.98 8.46
38、 C5H5N C5H5N+H
40、(1)9 (2)0.30
41、H3PO4-NaH2PO4 2.12
42、10.70 7.00 3.30
43、[H+]=[H2PO4-]+2[HPO42-]+3[PO43-]+[OH-]
[H+]+[HC2O4-]+2[H2C2O4]=[OH-]
44、HAc—NaAc PH=PKa-l g
NaAc [OH-] =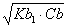
45、偏高 无影响
46、2NaOH + H3PO4 =Na2HPO4 + 2 H2O
三、计算题
1、
(1)该混合物组成为H3PO4和 NaH2PO4
(2)H3PO4的含量为0.05739 g/ml
NaH2PO4的含量为0.09158 g/ ml
2、T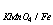 =
=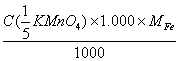 =
=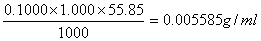
T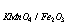 =
=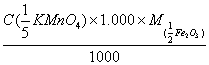 =
=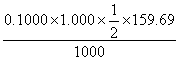
=0.007984g/ml
3、CaO%=17.0%
4、Ka1= 5.2× 10-4 Ka2 = 3.01 ×10-7
5、N% = 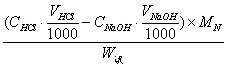
=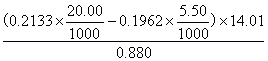
= 5.07%
6、(1)试样组成为NaOH与Na2CO3
(2)NaOH%= 20.00% Na2CO3%= 53.00%
7、T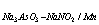 =0.0005501 g/ml
=0.0005501 g/ml
8、计量点前0.1% PH=8.41
计量点时 PH=9.05
计量点后0.1% PH= 9.70
9、 4.2:1
10、 KHC4H4O6% = 95.50%
11、(1)该草酸失去1分子结晶水。
(2)
12、 2.8< m< 4.2
《定量分析》测试题B
一、选择题:
1、C 2、D 3、B 4、C 5、C 6、C 7、B 8、A
9、A 10、B 11、C 12、B 13、B 14、C 15、A 16、C
17、B 18、A 19、B 20、A 21、B 22、A 23、A 24、C
25、C 26、D 27、C 28、C 29、D 30、D 31、A 32、C
33、D 34、C 35、C 36、 A 37、B 38、D 39、C 40、A
41、D 42、C 43、A 44、C 45、B
二、填空题:
1、9973 2、5aV/b 3、0.86 1.06 1.26
4、30.00 高 5、 6、小 小 大
6、小 小 大
7、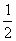 C2O42- +
C2O42- + 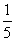 MnO4- +
MnO4- +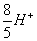 =CO2 +
=CO2 + 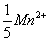 +
+
加热到75—80℃,酸性条件,
8、酒红 Mg2+ 蓝 , 计量点时滴入的EDTA夺取MgIn中的Mg2+,使指示剂In游离出来,故显示兰色
9、防止反应 2I- + 2 Fe3+ = I2 + 2 Fe2+ 的发生。
10、偏小 11、普遍性、组成一定 、稳定性高、形成可溶性配合物
12、防止反应 AgCl + SCN- = AgSCN + Cl- 的发生。
13、A、10ml 量筒 B、250ml容量瓶
C、25 ml移液管 D、10 ml 移液管
E、50ml碱式滴定管
14、严重 小 小
15、不能 16、偏小
17、选择吸收 18、大 小 移液管 滴定管
19、产生诱导效应 20、金属离子与EDTA发生配位反应时,有H+产生,加入缓冲溶液来控制酸度
21、氧化态物质 还原态物质
22、相同 不变 23、1:6
24、EDTA与玻璃瓶中的钙发生配位反应 塑料瓶
25、台秤 分析天平 量筒 移液管
26、C(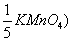 =0.2000mol·L-1
=0.2000mol·L-1
27、[H+] +[H2PO4-]+2[H3PO4]=[NH3] + [PO43-]+[OH-]
28、偏大 偏小
29、变色明显 变色范围小 绿色 无色
30、无影响 偏高
三、计算题:
1、C(EDTA)=0.02500mol·L-1
T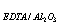 =0.001500g/ml
=0.001500g/ml
2、KI%=
=94.74%
3、 C=10.1mg/L
4、(1) C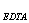 =0.01835 mol·L-1
=0.01835 mol·L-1
(2) K% = 5.558%
(3) K2O%= 6.553%
5、C(Na2S2O3)= 0.1001 mol·L-1
6、m = 0.075~ 0.3 g
7、(1)C = 5.0×10-6 mol·L-1 (2) Kf=2.5×108
= 5.0×10-6 mol·L-1 (2) Kf=2.5×108 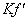 =2.5 × 106
=2.5 × 106
8、氯霉素%=14.3%
9、C(KMnO4) =0.01576 mol·L-1
10、m(Ca2+) = 2.50 mg/10ml.
11、T1% = 50% A1= 0.30
T2%= 70% A2= 0.15
T3% = 35% A3 =0.45
12、(1)入射光的强度减弱一半
(2)入射光的强度减弱了87.4%
