蛋壳中钙镁含量的测定
1 前言
随着人们生活水平的不断提高,鸡蛋的消耗量不断增加,因此产生了大量的鸡蛋壳。鸡蛋壳中含有大量的钙、镁、铁、铝等元素,其中钙(CaCO3)含量高达93%~95%。测定蛋壳中钙镁含量的方法包括:配位滴定法、酸碱滴定法、高锰酸钾滴定法等。本实验用配位滴定法、酸碱滴定法、高锰酸钾滴定法分别对蛋壳中的钙镁含量进行了测定并对三种方法进行了比较,不仅提高了大家的基本操作能力,而且由于是实物分析,能较全面的提高大家的分析问题、解决问题的能力,同时也能大大激发大家的实验兴趣。
2 实验方法
2.1方法Ⅰ 配合滴定法测定蛋壳中Ca、Mg含量
2.1.1实验目的
1.进一步巩固掌握配合滴定分析的方法与原理。
2.学习使用配合掩蔽排除干扰离子影响的方法。
3.训练对实物试样中某组分含量测定的一般步骤。
2.1.2实验原理
鸡蛋壳的主要成分为CaCO3,其次为MgCO3、蛋白质、色素以及少量的Fe、Al。由于试样中含酸不溶物较少,故可用盐酸将其溶解制成试液。试样经溶解后,Ca2+、Mg2+共存于溶液中。为提高络合选择性,在pH=10时,加入掩蔽剂三乙醇胺使之与Fe3+,Al3+等离子生成更稳定的配合物,以排除它们对Ca2+,Mg2+离子测量的干扰。调节溶液的酸度至pH≥12,使Mg2+生成氢氧化物沉淀,以钙试剂作指示剂,用EDTA标准溶液滴定,可单独测定钙的含量。另取一份试样,调节其酸度至pH=10,用铬黑T作指示剂,EDTA标准溶液可直接测定溶液中钙和镁的总量。由总量减去钙量即得镁量。
2.1.3仪器与试剂
锥形瓶(250mL),滴定管(50 mL),移液管(25 mL),容量瓶(250 mL),分析天平(0.1mg)。
6mol·L-1HCl,铬黑T指示剂,1?2三乙醇胺水溶液,NH4Cl-NH3·H2O缓冲溶液(pH=10),100g·L-1NaOH溶液,0.01 mol·L-1EDTA标准溶液。
2.1.4实验步骤
1.蛋壳的预处理
先将蛋壳洗净,加水煮沸5~10min,去除蛋壳内表层的蛋白薄膜,然后把蛋壳放于烧杯中用小火(或在105℃干燥箱中)烤干,研成粉末。
2.试样的溶解及试液的制备
准确称取上述试样0.25~0.30g(精确到0.1mg),置于250mL烧杯中,加少量水润湿,盖上表面皿,从烧杯嘴处用滴管滴加HCl 5mL左右,使其完全溶解,必要时用小火加热(少量蛋白膜不溶)。冷却,转移至250mL容量瓶中,稀释至接近刻度线,若有泡沫,滴加2~3滴95%乙醇,泡沫消除后,滴加水至刻度线摇匀。
3.Ca,Mg总量的测定
用移液管准确吸取试液25.00mL,置于250mL锥形瓶中,分别加去蒸馏水20mL,三乙醇胺5mL,摇匀。再加NH4Cl-NH3·H2O缓冲液10mL,摇匀。放入少许铬黑T指示剂,用EDTA标准溶液滴定至溶液由酒红色恰变纯蓝色,即达终点。根据EDTA消耗的体积计算Ca2+,Mg2+总量,以CaO的含量表示。
4.钙含量的测定
用移液管准确吸取25.00 mL上述待测试液于锥形瓶中,加入20mL蒸馏水和5mL三乙醇胺溶液,摇匀。再加入NaOH 10mL,钙指示剂约0.01g,摇匀后,用EDTA标准溶液滴定至由红色恰变为蓝色,即为终点。根据所消耗EDTA标准溶液的体积计算Ca2+含量,以CaO的含量表示。
2.2 方法Ⅱ 酸碱滴定法测定蛋壳中CaO的含量
2.2.1实验目的
1.学习用酸碱滴定方法测定CaCO3的原理及指示剂选择。
2.巩固滴定分析基本操作。
2.2.2实验原理
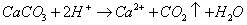 鸡蛋壳中的钙主要以CaCO3的形式存在。同时也有MgCO3。碳酸盐能与HCl发生如下反应:
鸡蛋壳中的钙主要以CaCO3的形式存在。同时也有MgCO3。碳酸盐能与HCl发生如下反应:
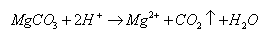
因此可以CaO的含量表示蛋壳中Ca、Mg的总量。过量的酸可用NaOH标准溶液回滴。据实际与CaCO3反应的盐酸标准溶液的体积可求得蛋壳中CaCO3的含量,以CaO的质量分数表示。
2.2.3仪器与试剂
锥形瓶(250mL),滴定管(50.00mL),移液管(25.00mL),容量瓶(250.00mL),分析天平,干燥箱。
浓HCl(分析纯),NaOH(分析纯),0.1% 甲基橙,基准物质Na2CO3。
2.2.4实验步骤
1.0.5mol/L NaOH溶液的配制
称取10gNaOH固体于小烧杯中,加H2O溶解后移至试剂瓶中,用蒸馏水稀释至500mL,加橡皮塞,摇匀。
2.0.5mol/L HCl盐酸的配置
用量筒量取浓盐酸21mL于500mL容量瓶中,用蒸馏水稀释至刻度,加盖,摇匀。
3.酸碱溶液的标定
准确称取基准物质Na2CO3 0.55~0.65g(精确到0.1mg)3份于锥形瓶中,分别加入50mL煮沸去CO2并冷却的蒸馏水,摇匀,温热使溶解,加入1~2滴甲基橙指示剂,用以上配置的HCl溶液滴定至橙色为终点。计算HCl的准确浓度。再用该HCl标准溶液标定NaOH溶液的浓度。
4.钙镁总量的测定
准确称取经预处理的蛋壳0.3g(精确到0.1mg)于3个锥形瓶中,用酸式滴定管逐滴加入已标定好的HCl标准溶液40 mL左右(需精确读数),小火加热溶解,冷却,加甲基橙指示剂1~2滴,以NaOH标准溶液回滴至橙黄色。
2.3方法Ⅲ 高锰酸钾法测定蛋壳中CaO的含量
2.3.1实验目的
1.学习间接氧化还原测定CaO的含量。
2.巩固沉淀分离、过滤洗涤与滴定分析基本操作。
2.3.2实验原理
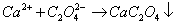 利用蛋壳中的Ca2+与草酸盐形成难溶的草酸盐沉淀,将沉淀经过滤洗涤分离后溶解,用高锰酸钾法测定C2O42-含量,换算出CaO的含量,反应如下:
利用蛋壳中的Ca2+与草酸盐形成难溶的草酸盐沉淀,将沉淀经过滤洗涤分离后溶解,用高锰酸钾法测定C2O42-含量,换算出CaO的含量,反应如下:
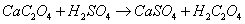
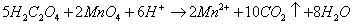
某些金属离子(Ba2+、Sr2+、Mg2+、Pb2+、Cd2+等)与C2O42-能形成沉淀,对测定Ca2+有干扰,可通过陈化等操作来消除或减弱其对实验的影响。
2.3.3仪器与试剂
锥形瓶(250mL),滴定管(50mL),移液管( 25.00mL ),分析天平。
0.01mol·L-1KMnO4,2.5%(NH4)2C2O4,10%氨水,浓盐酸,1mol·L-1H2SO4溶液,1+1盐酸溶液,0.2%甲基橙,0.1mol·L-1AgNO3。
2.3.4实验步骤
1.0.01mol·L-1KMnO4溶液的配制:
称取稍多于计算量的KMnO4,溶于适量的水中,加热煮沸20~30分钟(随时加水补充因蒸发而损失的水)。冷却后在暗处放置7~10天(如果溶液经煮沸并在水浴中保温1h,放置2~3天也可),然后用玻璃砂芯漏斗(或玻璃纤维)过滤除去MnO2等杂质。滤液贮存于棕色玻璃瓶中,待测定。
2.KMnO4溶液浓度的标定:
精确称取烘干后的分析纯草酸钠晶体0.06~0.08于250mL锥形瓶中,加10mL蒸馏水使之溶解,再加30mL 1mol·L-1的H2SO4溶解,加热至75℃左右,立即用待标定的KMnO4溶液标定。开始滴定时反应速度慢,每加入一滴KMnO4溶液,都摇动锥形瓶,使KMnO4溶液颜色退去后,再继续滴定。待溶液中产生Mn2+后,滴定速度可加快,临近终点时减慢速度,同时充分摇匀,至溶液突变为浅红色并持续半分钟不退色即为滴定终点,平行滴定三次,计算KMnO4溶液的浓度。
3.蛋壳中CaO含量的测定:
准确称取蛋壳粉0.07~0.08g,放在250 mL烧杯中,加1+1盐酸溶液3mL,加蒸馏水20mL,加热溶解,若有不溶解蛋白质可过滤除去。滤液置于烧杯中,然后加入2.5%(NH4)2C2O4溶液50mL,若出现沉淀,再滴加浓盐酸使之溶解,然后加热至70~80℃,加入2~3滴甲基橙,溶液呈红色,逐滴加入10%氨水,不断搅拌,直至变黄并有氨味溢出为止。将溶液放置陈化,沉淀经过滤洗涤,直至无Cl-。然后将带有沉淀的滤纸洗入烧杯中,再用洗瓶吹洗1~2次,然后稀释溶液至体积约为100mL,加热至70~80℃,用高锰酸钾标准溶液滴定至溶液呈浅红色,再把滤纸推入溶液中,再滴加高锰酸钾至浅红色在30s内不退色为终点。
4.根据上述方法平行滴定三次,计算相关数据。
3 结果与讨论
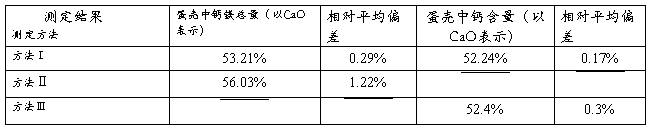
三种不同方法的测定结果:
3.1配合滴定法
1.在配合滴定中,必须控制好酸度。在以EDTA进行配合滴定的过程中,随着配合物的生成,不断有H+释放,使溶液酸度增大;同时,配合滴定所用指示剂的变色点也随pH而变化。因此,在配合滴定中需用适当的缓冲溶液来控制溶液的pH。
2.用EDTA滴定钙离子和镁离子时,若有Fe3+、Al3+存在,会发生指示剂的封闭现象,可用三乙醇胺或硫化物掩蔽Fe3+、Al3+而加以消除。
3.在用EDTA单独滴定钙离子与滴定钙镁离子时,需要控制在不同的酸度条件下进行滴定。
4.三种滴定方法中配合滴定法相对平均偏差最小,与其他两种方法的结果也较为接近,其结果最为可信。
3.2酸碱滴定法
1.该法相对平均偏差最大,且结果与其他两种方法也相差较大。
2.酸碱滴定法在溶解蛋壳时酸浓度较低,溶解需要加热一定时间,该时间和温度均需要适当,很难把握。否则,加热时间过长,加热温度过高,都可能造成HCl的挥发,从而造成较大的实验误差。
3.3高锰酸钾法
1.在同样条件下,小晶粒的溶解度比大晶粒的大,同一溶液中,对大晶粒为饱和溶液时,对小晶粒则为未饱和,因此小晶粒就要溶解,这样溶液中的构晶离子就在大晶粒上沉淀,沉淀到一定程度后,溶液对大晶粒为饱和溶液时,对小晶粒则为未饱和,又要溶解,如此反复进行,小晶粒逐渐消失,大晶粒不断长大。这便是陈化的原理,通过加热可以缩短陈化的时间。
2.沉淀要洗至无Cl-离子为止,因为在酸性条件下,Cl-离子会被KMnO4氧化,使测定结果偏大。沉淀的洗涤要做到多次少量,既要洗去氯离子,又要保证沉淀不会因溶解而损失过多。
3.用(NH4)2C2O4沉淀Ca2+,需要先在酸性溶液中加入沉淀剂,然后在70~80℃时滴加氨水至甲基橙变黄,这样做的目的是为了在特定的溶液环境下使CaC2O4沉淀,从而消除或减弱其它沉淀对实验的干扰。
4.KMnO4本身带有颜色,不用指示剂即可判断滴定终点,这是本实验的一大优点,但是用氧化还原法来进行滴定存在着一些缺陷,最主要的一条就是草酸受热易分解,导致实验难以控制,引起误差,另外,在读数时视线应与液面和管壁的交线相平。
5.用此法滴定时,较复杂,耗时较长,做实验应当耐心。
第二篇:蛋壳中钙镁含量的测定
20xx年第11期 内蒙古石油化工
15
蛋壳中钙镁含量的测定
?
张振英,解从霞
(青岛科技大学化学与分子工程学院,青岛 266042)
摘 要:分别采用酸碱滴定法、配位滴定法和氧化还原滴定法测定了普通鸡蛋壳的钙镁总量,并对上述三种方法进行了比较,从中选择出较适合教学的方法为配合滴定法。采用配位滴定法分别测定了普通鸡蛋壳、山鸡蛋壳和乌鸡蛋壳的钙镁总量分别为95.34%、97.03%、83.28%,从中选择出较适合教学的鸡蛋壳为普通鸡蛋壳。
关键词:鸡蛋壳;钙镁总量;滴定
1 前言
随着人们的生活水平不断提高,鸡蛋的消耗量与日俱增,因此产生了大量的鸡蛋壳。鸡蛋壳在医
〔1〕〔2〕
药、日用化工及农业等方面都有广泛的应用。在教学中开设“蛋壳中钙镁含量的测定”实验,不仅能使学生的基本操作得到训练,而且由于是实物分析,能较全面地提高学生的分析问题、解决问题的能力,同时也能大大激发学生的实验兴趣。另外,还可以对学生进行变废为宝、充分利用资源的教育。
人们已发现鸡蛋壳中含有大量的钙、镁、铁、钾
〔1〕〔3〕
等元素,其中钙(CaCO3)含量高达93%和95%。测定蛋壳中钙镁的含量方法包括:配位滴定法、酸碱
4〕5〕
滴定法、高锰酸钾滴定法〔、原子吸收法〔等,本实验对配位滴定法、酸碱滴定法、高锰酸钾滴定法进行了比较,从中选择出较适合教学的方法为配位滴定法。采用配位滴定法分别测定了普通鸡蛋壳、山鸡蛋壳和乌鸡蛋壳的钙镁总量分别为95.34%、97.03%、83.28%,从中选择出较适合教学的鸡蛋壳为普通鸡蛋壳。2 实验部分
2.1 配位滴定法测定蛋壳中钙镁总量2.1.1 试剂
6mol?L-1HCl,铬黑T指示剂;1∶2三乙醇胺水溶液;pH=10的NH4Cl—NH3?H2O缓冲溶液;乙二胺四乙酸二钠(Na2H2Y?2H2O)(AR)。2.1.2 实验方法
-1
?0.01mol?LEDTA的配制与标定按文4〕献〔;
〔6〕
?Ca、Mg总量的测定按文献。2.2 酸碱滴定法测定蛋壳中钙镁总量2.2.1 试剂
NaOH(AR);浓HCl(AR);Na2CO3固体;0.1%甲基橙指示剂;邻苯二甲酸氢钾。
?
2.2.2 具体方法
-1-1
?0.5mol?LNaOH和0.5mol?LHCl溶
〔4〕
液的配制与标定按文献;
〔6〕
?蛋壳中Ca、Mg总量的测定按文献。2.3 高锰酸钾法测定蛋壳中钙镁总量2.3.1 试剂
KMnO4(CP);5%(NH4)2C2O4;10%NH3?
-1
H2O;1mol?LH2SO4;1∶1HCl;0.1%甲基橙;
-1
Na2C2O4(AR);3mol?LH2SO4。2.3.2 具体方法
-1
?0.01mol?LKMnO4溶液的配制与标定按4〕
文献〔;
6〕
?蛋壳中Ca、Mg总量的测定按文献〔。2.4 采用配位滴定法测定普通鸡蛋壳、乌鸡蛋壳、山鸡蛋壳中钙镁含量方法同2.13 结果与讨论
3.1 配位滴定法测定蛋壳中钙镁总量
配位滴定法测定鸡蛋壳中钙镁总量的结果例于表1。
表1
W试样(g)0.2706
配位滴定法测定蛋壳中钙镁总量(CaCO3的质量分数)结果
cEDTA(mol?L
-1
序号1#2#3#
VEDTA)(mL)26.3126.2726.29
WCaCO3(%)95.4295.2795.34
平均值(%)
相对平均偏差(%)
0.00980495.340.05
从表1可知,采用配位滴定法测定鸡蛋壳中
精密度较高,所得Ca、Mg总量,相对平均偏差较小。3〕
结果与文献报道的结果相符〔。
此方法数据较稳定,并且容易操作可用于教学实验。通过EDTA的配制与标定,蛋壳的处理,蛋壳中Ca、Mg总量的测定可使学生较全面地掌握配位滴定的分析方法和原理,学习用配位掩蔽法排除干
收稿日期:2006-09-12
:
16
内蒙古石油化工 20xx年第11期
表4
配位滴定法测定不同种鸡蛋壳中钙镁总量(CaCO3的质量分数)结果
W试样(g)
cEDTA(mol?L
-1
扰离子影响的方法,用较短的时间训练了学生对实物试样中某组份含量测定的一般操作。3.2 酸碱滴定法测定蛋壳中钙镁总量
酸碱滴定法测定鸡蛋壳中钙镁总量的结果例于表2。
表2
酸碱滴定法测定蛋壳中钙镁总量
(CaCO3的质量分数)结果
cHCl(mol?L
-1
蛋壳种类
VEDTA(mL)26.3126.2726.2927.6327.6327.5923.1223.0823.10
WCaCO3(%)95.4295.2795.3497.0897.0896.9483.3583.2183.28
平均值(%)95.34
普通鸡蛋壳0.2706,0.009804
山鸡蛋壳
相对平均偏差(%)
0.279397.03
序号
W试样(g)
cNaOH)mol?L
-1
VHClVNaOHWCaCO3平均值(mL)40.00
(mL)15.0313.3314.68
(%)83.6983.5583.44
83.56(%)
1#2#3#
0.68390.70200.6945
0.4681
乌鸡蛋壳
0.15
0.272283.28
0.484940.14
39.94
从表4可知,配位滴定法测定的普通鸡蛋壳、山鸡蛋壳和乌鸡蛋壳的钙镁总量分别为95.34%、97. 从表2中可知,酸碱滴定法测定的鸡蛋壳中钙
03%、83.28%,实验中发现乌鸡蛋壳比较脆,难以剥镁总量以CaCO3表示为83.56%,远低于文献报道
去蛋白膜;而山鸡蛋的价格较贵,不适合在教学实验值95%,误差较大。这可能是由于该法反复用酸碱
中大批量采用。因此,较适宜教学的蛋壳为普通鸡蛋滴定标定NaOH与HCl,造成误差的传递而导致误
壳。差增大。另外,由于溶解蛋壳时酸较稀,溶解时需要
4 结论加热一定的时间,该时间和温度应适当,否则,温度
4.1 分别采用酸碱滴定法、配位滴定法和高锰酸钾过高,时间过长,都可能造成HCl物质的量的减少
滴定法测定了普通鸡蛋壳的钙镁总量,并对上述三而导致误差。因此,该法要求蛋壳在预处理时,一定
种方法进行了比较,从中选择出较适合教学的方法要研细且均匀。
为配位滴定法,该方法具有准确度高、耗时短、训练此方法步骤较为繁琐,需要反复滴定,并且与理
基本操作全面等特点。论数据相差较大,不适宜作为教学实验方法采用。
4.2 采用配位滴定法分别测定了普通鸡蛋壳、山鸡3.3 高锰酸钾法测定蛋壳中钙镁总量
蛋壳和乌鸡蛋壳的钙镁总量分别为95.34%、97.KMnO4法测定蛋壳中钙镁总量(CaCO3的质量
03%、83.28%,从中选择出较适合教学的鸡蛋壳为分数)结果列于表3。
普通鸡蛋壳。表3 KMnO4法测定蛋壳中钙镁总量(CaCO3的质量分数)结果
〔参考文献〕CKMnO4VKMnO4WCaCO3W试样平均值相对平均
序号[1] 李桂英,张尚恒.鸡蛋壳的综合利用.化学世(%)偏差(%)(g)(mol?L-1(mL)(%)
界,1992(11):522-524.
1#0.071413.6095.71
[2] 田萍,杨蓉.鸡蛋壳制备葡萄糖酸钙的研究.化
2#0.05350.0200810.0894.6895.200.5
学研究与应用,2000,12(5):572-574.
[3] 张建忠,汪久根,马家驹等.鸡蛋壳研究的现状 从表3可知,高锰酸钾法测定蛋壳中Ca、Mg总
〔3〕
与进展.功能材料,2005,36(4):503-506.量,所得结果与文献报道的结果基本相符。但此方
[4] 分析化学实验.成都科技大学分析教研组、浙法过程较为复杂,耗时较长。
江大学分析教研编 高等教育出版社,第二综上所述,较适合教学的测定蛋壳中Ca、Mg总
版,1988,11月.量方法为配位滴定法。
[5] 纪萍,朱文红.原子吸收法测定蛋壳中的钙、3.4 配位滴定法测定三种不同蛋壳中的Ca、Mg总
镁、铁、钾.辽宁高职学报,2001,3(1):56-量
58.采用配位滴定法测定普通鸡蛋壳、乌鸡蛋壳、山
[6] 周其镇,方国女,樊行雪.大学基础化学实验鸡蛋壳中钙镁总量(CaCO3的质量分数)结果列于表
[M].北京:化学工业出版社,2000.4。
MensurationoftheTotalContentofCalciumandMagnesiumofEggshell
ZhenyingZhang,CongxiaXie
(Collegeofchemistryandmolecularengineering,Qingdaouniversityofscienceandtechnology,Qingdao266042)
Abstract:Thetotalcontentofcalciumandmagnesiumofcommoneggshellwasmensuratedusingacid-basetitration,ligandtitrationandoxida-tion-reductiontitrationrespectivelywhichwerecomparedandtheresultsindicatethatligandtitrationisthebestforteaching.Then,thetotalcon-tentofcalciumandmagnesiumofeggshellcomingfromhen,pheasantandsilkefowlwasmeasuredwithligandtitrationandtheresultswere95.34%,97.03%and83.28%respectively.Itshowsthatthecommoneggshellcomingfromhenissuitableforexperimentalteaching.
Keywords:eggshell;thetotalofmand
