《药品不良反应/事件报告表》 的填写上报,质量要求与评估
北京市药品不良反应监测中心 第一部分 药品不良反应报告表填写 第二部分 群体不良事件基本信息表 第一部分 药品不良反应报告表填写 1. 药品不良反应/事件报告表法规依据 2.药品不良反应/事件报告表填写注意事项 3.药品不良反应/事件报告表填写的详细要求 国家药品不良反应监测系统网址
?6?1http://114.255.93.220/联通用户 ?6?1http://211.103.186.220电信用户 ?6?1老ADR系统中用户名导入到新系统中后用户名改为“adr-原用户名”密码统一为“111111” 例如在老系统中的登录名为“3701051088” 导入到新系统中后登录名为
“adr-3701051088” 密码为“111111”老系统中密码不变。 ?6?1如有问题请联系北京中心药品科。 电话010-65769003。 新的《药品不良反应报告和监测管理办法》 针对不同报告类型提供了三份表格 1 《药品不良反应/事件报告表》 2 《群体不良事件基本信息表》 3 《境外发生的药品不良反应/事件报告》 1. 药品不良反应/事件报告表法规依据 《药品不良反应报告和监测管理办法》 第十九条 药品生产、经营企业和医疗机构应当主动收集药品不良反应获知或者发现药品不良反应后应当详细记录、分析和处理填写《药品不良反应/事件报告表》见附表1并报告。 第二十条 新药监测期内的国产药品应当报告该药品的所有不良反应其他国产药品报告新的和严重的不良反应。 进口药品自首次获准进口之日起5年内报告该进口药品的所有不良反应满5年的报告新的和严重的不良反应。 第二十一条 药品生产、经营企业和
医疗机构发现或者获知新的、严重的药品不良反应应当在15日内报告其中死亡病例须立即报告其他药品不良反应应当在30日内报告。有随访信息的应当及时报告。 2.药品不良反应/事件新报告表格 新报告表将报告分为 1.基本情况 2.患者基本情况 3.使用药品情况 4.不良反应过程描述 5.关联性评价 6.报告人和报告单位信息 方便填写 名称规范 有效信息提取 新增 新增 新增 新增 食物、花粉 新增方便上报和名称规范 去激发 再激发 新增 3.药品不良反应/事件报告表填写注意事项 《药品不良反应报告和监测管理办法》第十五条要求 《药品不良反应/事件报告表》的填报内容应真实、完 整、准确。 4.1《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料手工报表需要长期保存因此务必用钢笔书写填写内容、签署意见包括有关人员的签字字迹要清楚不得用报告表中未规定的符号、代号、不通用的缩写形式和花体式签名。其中选择项画“√” 叙述项应准确、完整、简明不得有缺漏项。 4.2 每一个病人填写一张报告表。 4.3 个人报告建议由专业人员填写可以是诊治医务人员、生产企业、经营企业专职人员及专业监测机构人员。 4.4 尽可能详细地填写报告表中所要求的项目。有些内容无法获得时填写“不详”。 4.5 对于报告表中的描述性内容如果报告表提供的空间不够可另附A4白纸说明。并将“附件”写在一张纸的顶部。所有的附件应按顺序标明页码。附件中必须指出继续描述的项目名称。 3.药品不良反应/事件报告表填写注意事项 4.药品不良反应
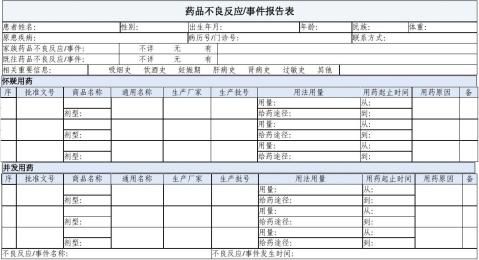
/事件报告表填写的详细要求 4.1报告的基本信息 首次报告□ 跟踪报告□新增 如果报告的是跟踪报告搜索到原始报告后在原始报告上进行修改补充资料后保存。 编码 是报告单位内部编码电子上报后系统自动形成的电子编码报告单位要记录在纸制报告上 报告类型 新的□ 严重□ 一般□ 新的新的药品不良反应 严重严重药品不良反应 一般新的、严重的药品不良反应 以外的所有不良反应 选择药品不良反应报告表的填报单位的类型 医疗机构□ 生产企业□ 经营企业□ 个人□ 其他 医疗机构指从事预防、诊断、治疗疾病活动并 使用药品的机构。 生产企业、经营企业指药品的生产企业和药品的销售企业 个人指作为消费者本人 其他:以上来源之外的如CRO公司 报告单位类别 4.2 患者相关情况 患者姓名一 ?6?1填写患者真实全名。 ?6?1当新生儿被发现有出生缺陷时如果报告者认为这种出生缺陷可能与孕妇在怀孕期间服用药品有关时患者是新生儿。 患者姓名二 ?6?1如果不良反应涉及胎儿/乳儿或者母亲或者两者均涉及报 告人认为不良反应的发生与母亲在怀孕、哺乳期间服药有关时 ①如果不良反应没有影响胎儿/乳儿患者是母亲。 ②如果不良反应是胎儿死亡或自然流产患者是母亲。 ③如果只有胎儿/孩子出现不良反应除了胎儿自然流产/胎儿死亡患者是胎儿/乳儿将母亲使用的可能引起胎儿/孩子出现不良反应的药品列在可疑药品栏目中。 ④ 如果胎儿/乳儿和母亲都有不良反应发生应填写两张报告表并且注明两张报告表的相关性。 4.2 患者相关情况 性别
按实际情况选择 出生日期 患者的出生年应填写4位如19xx年5月13日。 如果患者的出生日期无法获得应填写发生不良反应时的年龄。 民族 应正确填写如回族。 体重 注意以千克公斤为单位。 如果不知道准确的体重请做一个最佳的估计。 4.2 患者相关情况 联系方式 最好填写患者的联系电话或者手提电话。 如果填写患者的通信地址请附上邮政编码。 原患疾病 即病历中的诊断诊断疾病应写标准全称。如急 性淋巴细胞白血病不能写ALL。 4.2 患者相关情况 常见的不规范疾病名称大隐静脉曲张大腿静脉曲张心肌梗塞心梗慢性肾小球肾炎慢性肾炎风湿性心瓣膜病风心病输尿管结石右输尿管结石房性早搏房早椎间盘脱出椎间盘突出慢性肺原性心脏病肺心病慢性乙型肝炎乙肝胃肠炎肠胃炎泌尿道感染泌尿系统感染慢性支气管炎慢支肾功能衰竭肾衰上呼吸道感染上感ICD-10不规范名称ICD-10不规范名称病例号/门诊号企业填写医院名称 认真填写患者的病历号门诊号以便于对详细 病历详细资料的查找。 企业需填写病例发生的医院名称。 4.2 患者相关情况 既往药品不良反应/事件情况 包括药物过敏史。 如果需要详细叙述请另附纸说明。 家族药品不良反应/事件 选择正确选项。 如果需要详细叙述请另附纸说明。
4.2 患者相关情况 相关重要信息 吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□ 比如食物、 花粉 其他□ 4.2 患者相关情况 4.3 使用药品情况 怀疑药品 报告人认为可能与不良反应发生有关的药品。 批准文号 这是一个新增栏目增加的目的是
减少电子报表录入的工作量。因为药品批准文号是药品生产合法性的标志。药品生产企业的每种药品的每一规格有一个批准文号。也就是说每个批准文号是与药品生产企业、药品名称、规格对应的。 商品名称 填写药品的商品名。如果没有或者不知道商品名填写不详。 通用名称含剂型 填写完整的通用名不可用简称如“氨苄”等。 生产厂家 填药品说明书上的药品生产企业的全称不可用简称如“上五”、“白云”等 批号 填写药品包装上的生产批号如980324。注意不要与生产日期、有效期相混淆。 用法用量 包括每次用药剂量、给药途径、每日给药次数例如5mg口服每日2次。 如系静脉给药需注明静脉滴注、静脉推注或者“小壶”给药等。对于规定要缓慢静脉注射的药品应在报告表“其它”栏内注明是否缓慢注射。 4.3 使用药品情况 容易出现的问题 1通用名、商品名混淆或填写混乱剂型不清 2生产厂家缺项填写药厂简称 3把产品批号写成药品批准文号如“国药准字H2000150”
4.3 使用药品情况 用药起止时间 指使用药品的同一剂量的开始时间和停止时间。如果用药过程中改变剂量应另行填写该剂量的用药起止时间并予以注明。 用药起止时间大于一年时填写xxxx年Ⅹ月Ⅹ日xxxx年X月X日的格式用药起止时间小于一年时填写Ⅹ月Ⅹ日X月X日的格式如果使用某种药品不足一天可填写用药持续时间。例如一次或者静脉滴注一小时。 4.3 使用药品情况 用药原因 填写使用该药品的具体原因。注意用药原因与原患疾病的差别。 如患者既往高血压病史此次因肺部感染
而注射氨苄青霉素引起不良反应用药原因栏应填肺部感染。 4.3 使用药品情况 容易出现的问题 ?6?1将用药原因作为ADR或原患疾病的诊断术后预防感染胆囊炎术后用药原因错误。 ?6?1用药原因表现为“抗感染”、“抗病毒”等目的性描述而非用药原因。 ?6?1粗心大意导致的编辑性错误、错别字。 ?6?1预防用药如发热待查、结核病待查普遍不知如何正确填写在原患疾病栏填写无/没病/健康 4.3 使用药品情况 并用药品 指发生此药品不良反应时患者除怀疑药品外的其他用药情况包括患者自行购买的药品或中草药等。 不良反应发生时患者同时使用的其他药品不包括治疗不良事件的药品而且报告人并不认为这些药品与不良反应发生有关。 并用药品的信息可能提供以前不知道的药品之间的相互作用的线索或者可以提供不良反应的另外的解释故请列出与怀疑药品相同的其他信息。 4.3 使用药品情况 填写怀疑药品和并用药品时须参考已知文献报道信息如不良反应表现形式ADR的发生时间、发生率与病人情况进行比较在客观分析以后填写并决定怀疑药品和并用药品的排序。 填报时还应注意不要忽略慢性病长期服药因素。 4.3 使用药品情况 4.4 不良反应/事件相关情况 不良反应/事件名称 对明确药源性疾病的填写疾病名称 不明确的填写不良反应中最主要、最明显的症状。例如不良反应表现患者从Ⅹ年Ⅹ月Ⅹ日开始使用Ⅹ1.0g1次/日静滴Ⅹ日患者胸腹部出现斑丘疹有瘙痒感。继续使用后丘疹面积增大。不良反应名称可填写皮疹。 不良反应名称的选取参考《WHO
药品不良反应术语集》 不良反应/事件发生时间 填写不良反应发生的确切时间。 —当一个新生儿被发现有出生缺陷不良事件的 发生时间就是孩子的出生日期。 —当一个胎儿因为先天缺陷而发生早产或流产 时不良反应的发生时间就是怀孕终止日期。
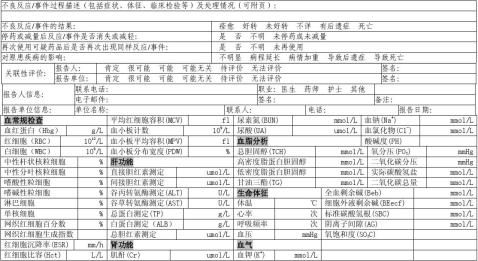
4.4 不良反应/事件相关情况 不良反应过程描述 3个时间 ①不良反应发生的时间 ②采取措施干预不良反应的时间 ③不良反应终结的时间。 3个项目 ①第一次药品不良反应出现时的相关症状、体征和相关检查 ②药品不良反应动态变化的相关症状、体征和相关检查 ③发生药品不良反应后采取的干预措施结果。 2个尽可能 ①不良反应/事件的表现填写时要尽可能明确、具体 ②与可疑不良反应/事件有关的辅助检查结果要尽可能明确填
写。 3个时间3个项目和2个尽可能 4.4 不良反应/事件相关情况 总结 一句话 “三个时间三个项目两个尽可能。” 套用格式 “何时出现何不良反应两个尽可能何时停药采取何措施何时不良反应治愈或好转。” 要求 相对完整以时间为线索重点为不良反应的症状、结果 目的是为关联性评价提供充分的信息。 不良反应过程描述 4.4 不良反应/事件相关情况 药品不良反应/事件过程及处理 常见的错误 三个时间不明确。 没有写不良反应的结果。 干预措拖过于笼统。如“对症治疗”、“报告医生”。 过于简单。如“皮疹停药。”。 严重病例没有体温、血压、脉搏、呼吸的记录。 多余写原患疾病症状 。 案 例 分 析 1 患者因败血症静滴万古霉素1g Bid6月5日发生ADR时间患者尿量明显减
少300ml/d。急查肾功Cr440μmol./LBUN21.6mmol/L。第一次ADR出现时的相关症状、体征和相关检查。患者用药前肾功能及尿量均正常。即干预时间停用万古霉素。采取的干预措施。停药后患者尿量逐渐增多至6月10日终结时间尿量恢复复正常。6月11日复查肾功能Cr138μmol/LBUN7.2mmol/L 。采取干预措施之后的结果。 案 例 分 析 2 患者因真菌性败血症热带念珠菌用5GS二性霉素B脂质体25mg缓慢静滴于13:15结束。1320发生ADR时间出现寒战心率增至160次/分Bp160/106mmHg R加深至40次/分。第一次ADR出现时的相关症状、体征和相关检查。立即干预时间予非那根25mg im安定、吗啡静推。采取的干预措施。于1400终结时间上述症状缓解。采取干预措施之后的结果。 患者因“衣原体尿路感染”于1月27日予注射用阿奇霉素0.5g qd当天10:00静滴完该药后出现轻微药疹未作处理。28日患者早上静滴完该药后颈部、胸、大腿出现散在红色丘疹瘙痒予扑尔敏4mg口服下午症状缓解。29日患者早上静滴完该药后使用后再次出现红色丘疹遍及全身瘙痒。不良反应动态变化。立即给予给予非那根25mg im 扑尔敏4mg Tid并停止使用阿奇霉素。于2月1日皮肤基本恢复正常。 案 例 分 析 3 不良反应结果 痊愈□ 好转□ 未好转□ 不详□ 有后遗症□ 表现死亡□ 直接死因 本次不良反应经采取相应的医疗措施后的结果不是指原患疾病的后果。例如患者的不良反应已经痊愈后来又死于原患疾病或与不良反应无关的并发症此栏仍应填痊愈。 不良反应经治疗后明显
减轻在填写报告表时没有痊愈但是经过一段时间可以痊愈时选择“好转”。 不良反应经治疗后未能痊愈而留有后遗症时应注明后遗症的表现。后遗症即永久的或长期的生理机能障碍应具体填写其临床表现注意不应将恢复期或恢复阶段的某些症状视为
“后遗症” 。 患者因不良反应导致死亡时应指出直接死因和死亡时间。 去激发/再激发 停药或减量后反应/事件是否消失或减轻 是□ 否□ 不明□ 未停药或未减量□ 再次使用可疑药品是否再次出现同样反应/事件 是□ 否□ 不明□ 未再使用□ 对原患疾病的影响 不明显□ 病情延长□ 病情加重□ 导致后遗症□ 导致死亡□ 不良反应对原患疾病产生的影响依据实际情况选择。 4.5 关联性评价 ADR分析 主要遵循以下五条原则 1.用药与不良反应/事件的出现有无合理的时间关系 除了先因后果这个先决条件外原因与结果的间隔时间也应符合已知的规律 2.反应是否符合该药已知的不良反应类型 3.停药或减量后反应是否消失或减轻 4.再次使用可疑药品是否再次出现同样反应/事件 5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释 不良反应/事件分析及关联性评价 1 2 3 4 5 肯定 很可能 可能 ± ± 可能无关 ± ± 待评价需要补充材料才能评价 无法评价评价的必需资料无法获得 注表示肯定 表示否定 ±表示难以肯定或否定 表示不明 案 例 分 析 某患者因糖尿病于X日予灯盏细辛注射液2支NS250ml静滴当还剩余10ml时病人出现寒战、恶心、胸闷、剧烈呕吐发热立即停药继而出现抽搐、面色苍白、
大小便失禁呼之不应。予肌注非那根等处理后病人逐渐好转。血压75/48mmHg 脉搏120次/分呼吸26次/分体温38.8度。 符合
1、时间合理 2、符合已知反应类型 3、不能用病程进展等因素解释排除输液反应 评价结论可能 4.6 报告人信息 联系电话 职业 报告人职业医疗机构依据实际情况做出选择。 医生□ 药师□ 护士□ 其他□ 电子邮箱 报告人签名报告人签名应字迹清晰容易辨认。 单位名称 联系人 电话 报告日期年月日 生产企业请填写信息来源 医疗机构□ 经营企业□ 个人□ 文献报道□ 上市后研究□ 其他□ 备注 报告单位信息 报表填写常见的错误 1.不良反应名称填写不够规范、不正确 2.不良反应过程描述过于简单 3.治疗后效果描写不全、不良反应发生后动态变化描写不够 4.不良反应分析理解错误或者忘记选择
第二篇:最新药品不良反应事件报告表