食品防腐剂丙酸钙的制备
实验报告
组号:13
指导老师:贺萍
班级 :应091-4
成员: 张 琳 :200921501445
赵 勇: 200921501447
周学荣 :200921501448
一.实验目的
1.了解丙酸钙性质和制备原理及方法。
2.掌握减压过滤,蒸发浓缩和高温煅烧的实验方法。
3..掌握重结晶的实验方法。
二.实验原理
丙酸钙是我国近些年来发展起来的一种食品防腐剂。丙酸钙不仅可以延长食品的保质期,而且可以在体内水解成丙酸和钙离子,其中丙酸是牛奶和牛羊肉中常见脂肪酸成分,钙离子有补钙的作用,它们都可以作为营养物质被人体吸收。
丙酸钙分子式Ca(CH3CH2COO)2,性状白色结晶性粉末,熔点400℃以上(分解),无臭或具轻微特臭。可制成一水物或三水物,为单斜板状结晶,可溶于水(1g约溶于3mL水),微溶于甲醇、乙醇,不溶于苯及丙酮。10%水溶液pH等于7.4。对热和光稳定。在200~210℃无水盐发生相变,在330~340℃分解为碳酸钙。
随着人们生活水平的提高和食品工业的发展,大量含有钙源的生活废弃物如蛋壳、贝壳,动物骨类等会造成环境污染。利用这些生活废弃物来生产丙酸钙可以起到变废为宝。以蛋壳为例其中含有93%CaCO3、1.0%MgCO3、2.8%MgHPO4及3.2%有机物。所以贝类可以利用来制备丙酸钙。利用经过物理粉碎的贝壳粉和丙酸钙反应其反应的方程式是:
CaCO3 + 2 CH3CH2COOH → Ca(CH3CH2COO)2 + H2O + CO2 ↑
然后经过一系列的减压过滤,蒸馏等过程进行分离即可得到产物丙酸钙。
EDTA的标定所需的基准物质有Ca、Zn等金属,及其金属氧化物,盐类,一般选用待测元素的金属或金属盐作为基准物质。所以本次试验用的基准物质是CaCO3, 指示剂为钙指示剂,控制PH=12左右。用标定好的EDTA滴定丙酸钙中的钙离子,来检验丙酸钙的纯度。
三.仪器试剂
仪器:HH-S6数显恒温水浴锅、电子调温万用电炉、抽滤瓶、布氏漏斗、SHZ-D(Ⅲ)循环水式真空泵、烧杯(250mL)、玻璃棒、电子天平、量筒、表面皿、容量瓶(100mL)、锥形瓶(250mL)、移液管(25mL)、碱式滴定管、坩埚、石棉网、烘箱、滤纸、粉碎机、筛子、玻璃珠。
试剂:钙指示剂、10%的氢氧化钠、EDTA、去离子水、1:1盐酸。
原料:丙酸、牡蛎粉。
四.实验步骤
1. 丙酸钙的制备
① 选择原料牡蛎,将准备好的原料利用粉碎机进行粉碎,然后用100目筛子过筛,得到所需牡蛎粉末。
② 分别称取两份8.0g左右的牡蛎粉,放在2个250mL的烧杯里,然后向两个烧杯里分别加入100mL的去离子水,搅拌。一个烧杯放入50℃水浴锅中,另一个烧杯在常温条件下,分别取约12mL的丙酸逐滴加入两个烧杯中。边滴加边搅拌。反应70min。反应过程中要不断搅拌。
③ 反应时间结束后,冷却至室温,常温滤纸过滤。得到的滤渣(连同滤纸)转移至表面皿,放入烘箱中110℃烘干,并称量其质量。常温条件下的记为W1(常温),50℃水浴条件下的记为W1(50℃)。
④ 得到的滤液分别倒入两个250mL烧杯中,加入玻璃珠,放在电炉上蒸发浓缩至出现晶膜时转移至坩埚中继续结晶至粘稠状。冷却至室温,进行减压抽滤。用乙醇洗涤(注意勿用水去洗固体以免溶解),分别转移至已知质量的表面皿中,放入110℃烘箱中烘干,常温条件下固体质量记为W2(常温),50℃水浴条件下记为W2(50℃)。
⑤ 将滤液分别转移至烧杯中,加入玻璃珠,放在电炉上蒸发浓缩至出现晶膜时,转移至蒸发皿中继续炒干,称重并记录。常温下质量记为W3(常温), 50℃水浴下记为W3(50℃)。
2.EDTA的标定
①称取0.5g左右的基准物质CaCO3于烧杯,将1:1的盐酸逐滴加入烧杯,并不断用玻璃棒搅拌,至CaCO3全部溶解。用玻璃棒转移溶液至250mL的容量瓶,定容至250mL。
②用25mL的移液管准确移取25mL上述标准CaCO3溶液于250mL的锥形瓶,并向其中依次加入5mLNaOH溶液、10mg左右的钙指示剂,摇匀。用待标定的EDTA溶液滴定标准CaCO3溶液,至溶液有紫红色突变为蓝色,且半分钟不褪色,即滴定终点到达。记下此时体积V。平行滴定2次。算出EDTA浓度。几个小组求得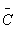 (EDTA) 。
(EDTA) 。
3. 纯度分析
① 选择50℃水浴条件下得到的固体产品称量约1.0 g,放入烧杯中,加入去离子水搅拌溶解,转移到250mL容量瓶中,继续加入去离子水,定容至250mL。
② 用移液管准确移取25.00mL溶液,转移至250mL锥形瓶中,加入5mL的10%的氢氧化钠溶液,25mL去离子水,再加入10mg钙指示剂。取已知浓度的EDTA对其进行滴定,到达滴定终点时,溶液由紫红色变为纯蓝色,且半分钟不褪色。平行滴定两次,记录两次消耗的体积V1(50℃),V2(50℃)。
③ 按照上述实验步骤,滴定常温下得到的固体产品,记录两次消耗EDTA的体积V1(常温),V2(常温)。
五.数据处理
1. 产率计算
常温条件下

丙酸钙的产率α= 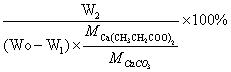
=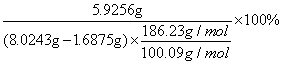
= 50.26%
参考产率α= 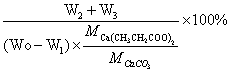
=
=88.50%
50℃水浴条件下

丙酸钙的产率α=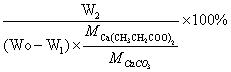
= 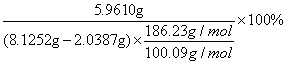
= 52.64%
参考产率α=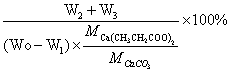
=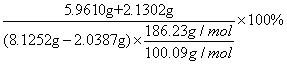
=71.45%
2.DETA的标定
我们组负责滴定的部分数据如下:
m(CaCO3)=0.5390 g, V(EDTA)=30.85mL
所以c(EDTA)= 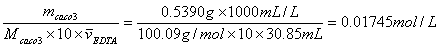
同学们求得的浓度
2.产品纯度检测:
①取50℃水浴条件下的产品质量W=1.0099g

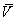 EDTA =30.05mL,已知其浓度为CEDTA=0.01742mol/L,
EDTA =30.05mL,已知其浓度为CEDTA=0.01742mol/L,
则丙酸钙的质量m=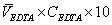
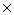 186.23g/mol
186.23g/mol
=30.05mL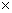 10-3L/mL
10-3L/mL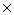 0.01742mol/L
0.01742mol/L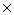 10
10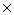 186.23g/mol
186.23g/mol
=0.9749g
则可得50℃水浴条件下得到的丙酸钙的纯度=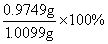 =96.53%
=96.53%
②取常温条件下的产品质量W=1.0067g
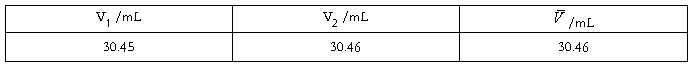
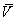 EDTA =30.46mL,已知其浓度为CEDTA=0.01742mol/L,
EDTA =30.46mL,已知其浓度为CEDTA=0.01742mol/L,
则丙酸钙的质量m=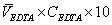
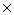 186.23g/mol
186.23g/mol
=30.46mL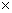 10-3L/mL
10-3L/mL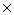 0.01742mol/L
0.01742mol/L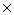 10
10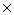 186.23g/mol
186.23g/mol
=0.9882g
则可得50℃水浴条件下得到的丙酸钙的纯度= 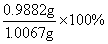 =98.16%
=98.16%
六.注意事项
① 向溶液中加入丙酸时要逐滴加入,并且边滴加边搅拌。反应过程要一直搅拌。
② 加入丙酸时,要在通风橱内进行。
③ 常压过滤时,注意防止玻璃棒捅破滤纸,引入杂质。
④ 在蒸发浓缩时,不能浓缩至粘稠度过大,防止产品变质。
⑤ 减压抽滤时,用少量乙醇洗涤滤渣,切忌用大量的去离子水冲洗,否则产品溶会解到水中进入滤液。
⑥ 在滴定丙酸钙时由于是络合滴定,反应速度较慢,所以滴定的速度要慢,边滴定边快速摇动,使其充分反应,减小滴定误差。
⑦ 在纯度检测中,配制待标定液时,要先加NaOH溶液,再加入水。若先加水,后加NaOH溶液不产生沉淀。
七.误差分析
① 在搅拌反应过程中,加入丙酸过快、反应时间不足,造成了丙酸钙反应不彻底,导致丙酸钙的产率降低。
② 在抽滤时,产品在移入表面皿时有损失,故造成了丙酸钙的产率下降。
③ 在滴定丙酸钙时,由于对滴定终点的判断存在偏差,进而给实验带来一定的误差。
④ 实验过程中,有少量固体残留在玻璃仪器壁上,导致丙酸钙的产率下降。
附录:
实验分工:
张琳:50℃制备丙酸钙
赵勇:常温制备丙酸钙
周学荣:标定EDTA,滴定钙离子
建议成绩:
张琳 95 周学荣 95 赵勇 93
第二篇:丙酸钙的制备实验报告
食品防腐剂丙酸钙的制备
一、实验目的
1、通过查阅文献、综述文献,了解食品防腐剂丙酸钙的制备方法及原理;
2、掌握从样品采集、烘干、试样研磨、过筛、混匀和缩分等样品处理过程;
3、通过丙酸钙的制备,综合掌握搅拌反应、真空抽滤、除杂脱色、蒸发浓缩、洗涤烘干、高温焙烧等操作;
4、对产品进行纯度检测、杂质分析等训练;
5、巩固合成基本操作、滴定分析基本操作,学会用科学的思维来观察分析问题和解决问题,学会以科学论文形式提交实验报告。
二、实验原理
丙酸钙是一种酸性食品防腐剂,广泛应用于面包、西点、酱油及水果等食品的防腐保鲜,对霉菌、好气型芽孢杆菌、革兰氏阴性菌等食品工业菌类有很好的杀灭作用,还可抑制黄曲霉素的产生,其防腐作用良好,且无毒、安全。丙酸钙不仅可以延长食品的保质期,而且可以在体内水解成丙酸和钙离子,其中丙酸是牛奶和牛羊肉中的常见脂肪酸成分,钙离子有补钙的作用,它们都可以作为用那个样物质被人体吸收,这一优点是其他防霉剂所无法相比的。
丙酸钙Ca(CH3CH2COO)2,性状白色结晶性粉末,熔点400℃以上(分解),无臭或具轻微特臭。可制成一水物或三水物,为单斜板状结晶,可溶于水(1g约溶于3mL水),微溶于甲醇、乙醇,不溶于苯及丙酮。10%水溶液pH等于7.4。对热和光稳定。在200~210℃无水盐发生相变,在330~340℃分解为碳酸钙。随着人们生活水平的提高和食品工业的发展,大量含有钙源的生活废弃物如蛋壳、贝壳,动物骨类等会造成环境污染。利用这些生活废弃物来生产丙酸钙可以起到变废为宝。利用经过物理粉碎的贝壳粉和丙酸钙反应其反应的方程式是:CaCO3+2CH3CH2COOH=Ca(CH3CH2COO)2+H2O+CO2 然后经过一系列的减压过滤,蒸馏等过程进行分离即可得到产物丙酸钙。
随着人们生活水平的提高和食品工业的发展,大量含有钙源的生活废弃物,如蛋壳、贝壳、动物骨头类等会造成环境污染。利用这些生活废弃物来生产丙酸钙可以起到变废为宝。以蛋壳为例,其中含有约93%CaCO3、1.0%MgCO3、2.8%MgHPO4及3.2%有机物,有害元素含量极微,主要杂质元素是镁,处理成本较低,容易制得合格产品。
利用CaCO3制Ca(CH3CH2COO)2的反应方程式为
CaCO3+2 CH3CH2COOH= Ca(CH3CH2COO)2+CO2+H2O
在经过一系列的过滤、加热浓缩、减压抽滤等操作就可以得到产物丙酸钙。
产品验纯是利用EDTA与钙离子结合形成配合物来滴定测得Ca2+浓度进而求得丙酸钙的量。为避免镁离子等的干扰,用1%NaOH将PH调至12。
三、实验仪器及设备
仪器:烧杯(250ml,50ml),玻璃棒,量筒(100ml,10ml),碱滴定管一支,容量瓶两个(100ml),表面皿,锥形瓶(250ml),移液管(25ml),石棉网,烘箱,滤纸,粉碎机,水泵,布氏漏斗,抽滤瓶,电炉,分析天平,筛子,玻璃珠,布氏漏斗,水浴锅。
试剂:钙指示剂,10%氢氧化钠,0.02mol/LEDTA,去离子水,1:1盐酸
原料:丙酸,扇贝壳
四、实验步骤
1.制备产品
a. 选择原料扇贝壳,将准备好的原料利用粉碎机进行粉碎,然后用100目筛子过筛,得到所需扇贝粉末,提前准备工作。
b. 分别称取6.0390g、6.0133g扇贝粉,放在2个250mL的烧杯里,然后向两个烧杯里分别加入80mL的去离子水。将后一个烧杯编为2号,放入50℃水浴锅中,另一个即为1号烧杯在常温条件下。分别取9mL的丙酸两份,分批逐滴加入两个烧杯中。每次加入适量,约10min中内加完。过程中不断搅拌,便于CO2逸出加快反应。反应70min。
c. 反应时间结束后,冷却至室温,对两种溶液进行抽滤。烧杯的内壁和玻璃棒用滤纸擦拭,得到的滤纸上的杂质(连同滤纸)放在表面皿上,于105℃烘箱中烘干,并称其质量。 分别记为W1(常温)、W1(50℃)。得到的母液分别倒入两个250mL烧杯中,各加8粒玻璃珠,于电炉上蒸发浓缩,剧烈沸腾时把温度调低,当液体浓缩出现晶膜至粘稠状,冷却结晶,进行减压抽滤。
d. 抽滤得到的固体产品放在表面皿中(滤纸与产品一同取下),放入120℃烘箱中烘干,得到白色鳞片状结晶产品。冷却后称其质量,分别记为W2(常温)、W2(50℃)。滤液分别倒入50ml小烧杯中,在电炉上蒸干,冷却后称重,分别记为W3(常温)、W3(50℃)。
2.(1)0.02mol/L EDTA的标定:
a.准确称取0.6176gCaCO3基准试剂放入50ml小烧杯中,逐滴加入1:1的盐酸至固体消失且无气泡。将溶解后的溶液移入250ml容量瓶中定容
b.用移液管移取25mL于250mL锥形瓶中,加入5mL10%NaOH溶液,25mL去离子水,10mg钙指示剂,用EDTA进行标定。平行标定3次,取平均值。
(2)分析纯度:
a .选择常温条件下得到的固体产品称量0.4270g,放入烧杯中,加入去离子水溶解,转移到100mL容量瓶中,然后定容。
b. 用移液管取25mL定容好的溶液于100mL锥形瓶中,加入5mL10%NaOH, 25mL去离子水,约10mg钙指示剂。用碱式滴定管取EDTA(已标定浓度)对其进行滴定,滴定终点溶液颜色由紫红色变为蓝色。平行滴定2次,记录2次消耗的体积V1,V2。
c.选择50℃水浴条件下得到的固体产品称量0.4117g,重复步骤a、b。记录2次消耗的体积V1’,V2’。
五、实验数据处理
1.产品性状描述:



产品性状:白色结晶性粉末
2.产率计算

常温下理论丙酸钙质量:
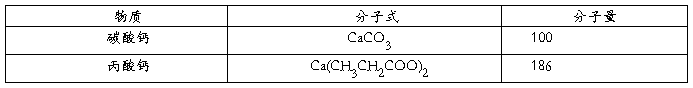
2CH3CH2COOH +CaCO3→Ca(CH3 CH2COO)2+H2O+CO2
100 186
(6.0390-2.8768) x
100x=186×(6.0390-2.8768)
解得x=5.8817g
产率1=W2/理论丙酸钙质量=2.4662/5.8817×100%=41.93%
产率2=(W2+W3)/理论丙酸钙质量=(2.4662+2.03)/5.8817×100%=76.44%
50℃水浴条件下理论丙酸钙质量:
2CH3CH2COOH +CaCO3→Ca(CH3CH2COO)2+H2O+CO2
100 186
(6.0133-2.7990) x
100x=186×(6.0133-2.7990)
解得 x=5.9786g
产率1=W2/理论丙酸钙质量=2.1639/5.9786×100%=36.19%
产率2=(W2+W3)/理论丙酸钙质量=(2.1639+1.72)/5.9786×100%=64.96%
3.纯度计算
称量的样品质量列表

用EDTA分别滴定两种条件下的丙酸钙所用的体积

用EDTA滴定丙酸钙,其滴定比例为1:1
已知EDTA的浓度为0.02306mol/L
n(丙酸钙)=n(EDTA)
m(丙酸钙)/M(丙酸钙)=C(EDTA)V
m(丙酸钙)= C(EDTA)V M(丙酸钙)
所以m1(丙酸钙)= 0.02306×23.695/1000×186×4=0.4065(g)
m2(丙酸钙)= 0.02306×23.345/1000×186×4=0.4005(g)
则可求得样品中丙酸钙的质量列表如下:

样品纯度=实际求得的质量/样品质量×100%,则:
常温纯度=0.4065/0.4270×100%=95.20%
50℃纯度=0.4005/0.4117×100%=97.28%
则得不同条件下丙酸钙纯度列表如下:

六.误差分析:
1.产率偏低的原因:
a.样品称量完成向烧杯转移的过程中不小心将样品损失;
b.丙酸的滴加速度较快,搅拌不均匀,导致反应不完全从而造成产率降低;
c.减压抽滤时烧杯内壁上会残留产品,及抽滤完毕将产品移入表面皿时的损失都会降低产率;
d.在产品及滤渣烘干后称量时,由于滤纸和玻璃珠上沾有部分产品,导致二者质量均偏小,滤渣质量偏小会导致计算的理论产值增大,而产品质量又偏小,这就是计算的产率进一步减小;
e.称量表面皿质量时用未用分析天平(W3)及数据处理时有效数字的取舍,带来部分误差。
2.产品纯度分析
a.在EDTA标定及产品滴定时,读数误差影响最后的纯度计算;
b.在产品制备过程中,过滤、加热浓缩、减压抽滤及最后产品称量时均会引入杂质;
c.在滴定产品时,由于加的指示剂太少及对终点判断不够准确从而导致滴定有误差,影响产品纯度;
d.实验所用仪器及所用方法均具有一定的系统误差,实验数据处理时有效数字的取舍也会导致一定的误差;
七.注意事项
1.向溶液中加入丙酸时要不断搅拌,使CO2快速逸出加快反应。
2.在蒸发浓缩时,粘稠度不宜太大以免混入杂质。
3.在抽滤前要确保滤纸大小合适,防止在倾倒液体时将滤纸冲起,将残渣进入滤液,引入杂质。
4.在重结晶时,出现晶膜之后要立即快速搅拌,并且降低加热温度。
5.在滴定丙酸钙时,滴定速度要慢,边滴定边快速摇动,使其充分反应,减小滴定误差。
八.实验心得
1.实验前必须要做好实验预习工作,提前查好资料,了解实验的大致原理及操作过程,带着问题去做实验,这样才能真正提高自己的实验能力,丰富自己的知识,将理论与实践结合起来;
2.实验操作要严谨、规范律己,对每一个环节应做到“为什么”知道其原理部分,将实验与理论进一步的结合,更加成分的理解其理论部分,熟悉操作步骤。
3. 实验过程中必须细心、耐心,例如在加丙酸钙时,切勿加入速度快,否则反应不充分,还有在滴定时更要有耐心,慢慢滴定,还要细心的观察溶液颜色变化,这样才能避免不必要的误差,达到理想的实验结果
4. 团队合作要默契,分工明确,不易疏漏其重要环节,混淆使用仪器。
九、实验分工
