第一章 第1节 化学反应的热效应(第一课时)
【学习要求】
1. 了解化学反应中能量变化的实质,知道化学能与热能的转化是化学反应中能量转化的主要形式。
2.了解化学能与热能之间的转化,了解吸热反应,放热反应,反应热等概念,
3.了解热化学方程式的含义,
教学重点:热化学方程式的书写
【温故而知新】
1、化学反应的特征是 ,从化学键的角度看,化学反应的本质是:
2、常见的放热反应有哪些?
3、常见的吸热反应有哪些?
【课前预习区】
1、为什么化学反应中总伴随着能量的变化?
2、反应热的定义
反应热的大小与反应放热吸热之间是什么关系?
3、什么是焓?什么是反应的焓变?
4、反应的焓变大小与反应放热吸热之间是什么关系?
5、什么是热化学方程式?
【课堂互动区】
【思考引入】氢气在氧气中燃烧放出热量,如何定量地描述该反应释放的热能呢?
【问题组1】
(1) 已知反应X+Y=M+N为放热反应,则X的能量一定高于M, 对吗?
(2) 解释铝和氧化铁、氯化铵与消石灰反应有能量变化的原因。
【归纳整理1】一、化学反应的反应热:
(一)反应热
1、定义:
2、符号:
反应热与吸热放热的关系:放热反应 ,反应物的能量总和 (“大于”或“小于”)生成物的能量总和;吸热反应 ,反应物的能量总和 (“大于”或“小于”)生成物的能量总和
二、化学反应的焓变
【问题组】1、什么是焓?什么是反应的焓变?
2、反应焓变与反应热有什么关系?
【归纳整理2】(一)、焓与焓变:
1、焓(H):用来描述 的物理量。
2、焓变(△H):是 与 之差。
单位: ;表达式:
ΔH>0,反应产物的焓 反应物的焓,为 反应。
ΔH<0,反应产物的焓 反应物的焓,为 反应。
画出焓变与放热反应和吸热反应的关系图:
【设疑】怎样能同时表示出某一化学反应中的物质变化和能量变化呢?
【问题组2】阅读课本第6页“资料在线”
(1)比较两个反应,⊿H为什么不同?哪个反应放出的热量多?哪个反应的⊿H大?
(2)相同的反应物,⊿H的大小由哪些因素决定?
(3)谈谈你对⊿H的单位“mol-1”的理解
(二)热化学方程式:把一个化学反应中 和 同时表示出来。
【归纳整理3】2、热化学方程式表示的意义:
2H2(g) + O2 (g)=2H2O(l) △H(298K)=-571.6 kJ·mol-1表示的意义是
2H2(g) + O2 (g)=2H2O(g) △H(298K)=-483.6 kJ·mol-1表示的意义是
【交流与讨论】:观察下列热化学方程式,分析其与化学方程式有何不同,并总结书写热化学方程式应注意什么问题。
2H2( g )+O2( g ) =2H2O( l ) ΔH= -571.6 kJ/mol
2H2( g )+O2( g ) =2H2O( g ) ΔH= -483.6 kJ/mol
H2( g )+1/2O2( g )= H2O( l ) ΔH= -285.8 kJ/mol
H2( g )+1/2O2 ( g )= H2O ( g ) ΔH= -241.8 kJ/mol
2H2O( l ) =2H2( g )+O2( g ) ΔH= +571.6 kJ/mol
【归纳整理4】3、书写热化学方程式的注意事项:
(1)
(2)
(3)
(4)
练习:1、完成P6交流.研讨1
2、式子H2(g)+ 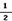 O2(g)=H2O(g);△H(298K)= -285.8 kJ/mol表示什么意义?
O2(g)=H2O(g);△H(298K)= -285.8 kJ/mol表示什么意义?
3、沼气是一种能源,它主要是CH4。0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ的热量,则热化学方程式为:
[课后巩固区]
1.下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应 B.放热的反应常温下一定很易发生
C.反应是放热还是吸热取决于反应物和生成物所具有的总能量相对大小。
D.吸热反应在一定的条件下也能发生
2、已知(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) = 2H2O ( g ) ΔH2 = b kJ/mol
(3) H2 ( g )+1/2 O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2 ( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 ( )
A、a<c<0 B、b>d>0 C、2a=b< 0 D、2c=d>0
3、已知:H2(g)+F2(g) 2HF(g);△H= -270 kJ·mol-1,下列说法正确的是( )
2HF(g);△H= -270 kJ·mol-1,下列说法正确的是( )
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
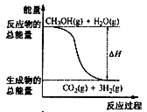
4、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= + 49.0 kJ·mol-1
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
 A.CH3OH的燃烧热为192.9 kJ·mol-1
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)△H>-192.9kJ·mol-1
5、下列各组热化学方程式程中,化学反应的△H前者大于后者的是 ( )
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A ① B ④ C ②③④ D ①②③
6、化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是 ( )
 A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C.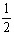 N2(g)+
N2(g)+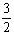 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
D. 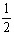 N2(g)+
N2(g)+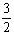 H2(g)=NH3(g); △H=(a+b)kJ·mol-1
H2(g)=NH3(g); △H=(a+b)kJ·mol-1
第二篇:第一节 化学反应的热效应(第一课时)
第一章 化学反应与能量变化
第一节 化学反应的热效应(第一课时)
【使用说明】
1、认真阅读教材P2-4页,独立完成该导学案。
2、以极度的热情投入课堂,全力以赴,体验学习的快乐。
【学习目标】
1. 通过反应热定义的学习,了解反应热效应的定量描述与反应条件有关。 2.通过中和反应的反应热的实验,了解反应热效应的定量测定原理和方法。 【重、难点】反应热概念的含义 【知识回顾】
1、化学反应中为什么有能量变化?
2、常见的放热反应有: ;
常见的吸热反应有: 。 【自主学习】
一、化学反应的反应热
1、定义:化学上规定,当化学反应在一定的 的热量称为该反应在此温度下的 ,简称 。 2、表示符号:用
反应放热时,反应体系能量 ,Q 0; 反应吸热时,反应体系能量 ,Q 0。 3、测量方法
?反应热的数据可以用 测量。
?在测量反应热的实验中,反应吸收或放出的热量可以通过反应前后 的变化来计算。
?公式为 。其中,C代表 ,T2 、T1 分别代表 ?量热计由 、 两个筒组成, 筒的外壁覆盖着 层。测定时,将反应物加入 筒并将之迅速混合,测量反应前后溶液的 ,并计
算出反应前后的 变化值。
强酸、强碱反应生成可溶性盐的中和反应的离子方程式为 ,
当参加反应的n(H+)和n(OH-)相同时,中和反应的反应热是 二、燃烧热和中和热
由于反应的情况不同,反应热可分为许多种,如燃烧热、中和热等等。 1、燃烧热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
2、中和热:在稀溶液中,酸和碱发生中和反应生成1mol水,这时的反应热叫做中和热。 【合作探究】 测定中和反应的反应热 1、该实验的原理是什么?
2、为保证测定结果的准确性,在测定过程中应注意什么?
【巩固练习】
1、下列变化中,属于吸热反应的是
①液态水汽化 ②浓硫酸稀释 ③生石灰与水反应 ④石灰石高温分解 ⑤灼热的炭与二氧化碳的反应 ⑥氢氧化钡晶体与氯化铵固体混合 ⑦水蒸气与焦炭高温制水煤气 ⑧锌粒与稀硫酸制氢气 ⑨硝酸铵溶于水 ⑩干冰气化 2、下列各项与反应热的大小无关的是( )
A.反应物的状态 B.温度 C.反应物的多少 D.表示反应热的单位 3、下列说法正确的是 ( )
A、物质发生反应时放出的热量来源于对反应的加热 B、化学反应除了生成新物质外,还发生能量变化。
C、化学反应中放出的热才是反应热
D、需要加热方能发生的反应一定是吸热反应
★4、若测得盐酸和氢氧化钠溶液反应生成l mol水时放出的热量为Q,则下列各反
应在溶液中生成l mol 水时放出的热量也为Q的是( ) ①醋酸和氢氧化钠溶液 ②氨水和盐酸 ③氢氧化钾溶液和硝酸 ④浓硫
酸和氢氧化钠溶液
A.①②③ B.①③ C.③④ D.③
5、40mL2mol/L的氢氧化钠溶液和40mL2mol/L盐酸在19℃时混合,混合后测得溶液
的温度为32.6℃。求反应的中和热【混合后溶液的比热容为4.18J/(g·℃)】
6、在101KPa时, 0.5 molCH4完全燃烧生成和液态,放出445.15kJ的热量,CH4

的
燃烧热是多少?1000L(标准状况)CH4燃烧后所产生的热量是多少?
【当堂检测】
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反
应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是 。 (2)烧杯间填满碎纸条的作用是 。 (3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。 (4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。 (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”) 【课堂小结】(总结出本节课重要解题方法及技巧)
