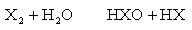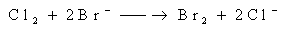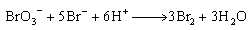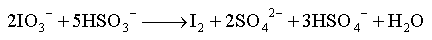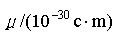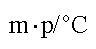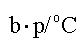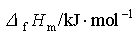第十章 非金属元素(一)氢
稀有气体 卤素
第一节 氢
第二节 稀有气体
第三节 卤族元素
第四节 拟卤素
第一节 氢
.氢在自然界中的分布
三种同位素:11H;12H; 13H
.氢的成键特征
1.离子键;2.共价键;3.独特的键形
1-1 氢的性质
物理性质:H2是无色、无臭的气体,易燃,难液化。
化学性质:
(1)与卤素或氧的反应
2H2 + O2 → 2H2O
(2)与金属氧化物或金属卤化物的反应
WO3 + 3H2 → W + 3H2O
(3)与CO的反应
CO + 2H2 → CH3OH
1-2 氢的制备
1. 实验室制备 Zn + H2SO4 →ZnSO4 + H2↑
2. 电解法
阴极 2H2O +2e- → H2 ↑ + 2OH-
阳极 4OH- → O2 ↑ + 2H2O +4e-
3. 工业生产
C(赤热) + H2O(g) → H2(g) + CO(g)
4. 石油化学工业 C2H6(g)→ CH2=CH2(g) + H2(g)
第二节 稀有气体
.稀有气体: He Ne Ar Kr Xe Rn
.价电子构型:ns2np6
.稀有气体的物理性质
He Ne Ar Kr Xe Rn
 第一电离能 大 小
第一电离能 大 小
 mp. bp. 小大
mp. bp. 小大
 水中溶解度 小大
水中溶解度 小大
 气体密度 小 大
气体密度 小 大
第三节 卤族元素
卤素(VIIA) F Cl Br I
价电子构型: 2s22p5 3s23p5 4s24p5 5s25p5
共价半径/pm 58 99 114 133
电负性: 4.00 3.00 2.80 2.50
第一电离能: 1681 1251 1440 1008
3-1 卤素单质
1. 物理性质:
F2 Cl2 Br2 I2
室温聚集态 g g l s
 分子间力 小 大
分子间力 小 大
b.p./℃ -188 -34.5 59 183
m.p/℃ -220 -101 -7.3 113
颜色 浅黄 黄绿 红棕 紫
2. 化学性质
卤素单质性质变化:
F2 Cl2 Br2 I2
2.87 1.36 1.065 0.535
 单质氧化性: 大 小
单质氧化性: 大 小
 X-还原性:小 大
X-还原性:小 大
结论: 1).体现非金属性
2).单质呈双原子分子
(1) 一金属、非金属作用
F2能与所有的金属、以及除O2和N2以外的非金属直接化合,它与H2在低温暗处也能发生爆炸。
Cl2能与多数金属和非金属直接化合,但有些反应需要加热
Br2和I2要在较高温度下才能与某些金属或非金属化合
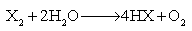 (2)与水、碱的反应 卤素与水可发生两类反应:
(2)与水、碱的反应 卤素与水可发生两类反应:
F2与水反应主要按①式进行,能激烈放出O2。Cl2与水主要按②式发生歧化反应,生成盐酸和次氯酸,后者在日光照射下可以分解出O2。Br2和I2与纯水的反应极不明显,只是在碱性溶液中才能显著发生类似②的歧化反应。
Br2 + 2KOH → KBr + KBrO + H2O
I2 + 6NaOH → 5NaI + NaIO3 + H2O
注:氯水、 溴水、碘水的主要成分是单质。
(3) 卤素间的置换反应
卤素单质从F2到I2氧化性质逐渐减弱,前面的卤素可以从卤化物中将后面(非金属性较弱)的卤素置换出来。例如:

Cl2 + Br- → 2Cl- + Br2
另一类置换反应:
I2 + ClO3- → IO3-+ Cl2↑
Br2 + ClO3-, → BrO3- + Cl2↑
3. 卤素单质的制备(氧化手段的选择)
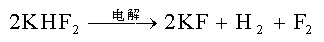 . F2 (g)电解:
. F2 (g)电解:
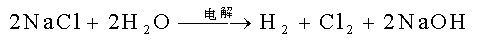
. Cl2 (g)的电解(工业):
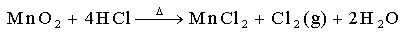
氧化还原法(实验室):
. Br2 (l)
氧化剂:
反歧化:
. I2 (s)
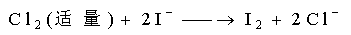
氧化剂:
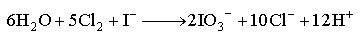
工业上:
3-2 卤化氢和氢卤酸
常温下,卤化氢都是无色具有刺激性气味的气体。
卤化氢性质的比较
HF HCl HBr HI 分子极性↓
6.37 3.75 2.76 1.49
-83.55 -114.22 -86.88 -50.80 熔点↑
-19.51 -85.05 -66.73 -35.36 沸点 ↑
-271 -92.3 -36.4 -26.5 稳
定↓
分解温度/℃ >1500 1000 300 性
键能/kJ·mol-1 565 431 364 299
 (1)氢卤酸的酸性 弱 强
(1)氢卤酸的酸性 弱 强
(2)氢卤酸的还原性
F-< Cl-< Br- <I-
(3) HF的特殊性
氢氟酸能与二氧化硅或硅酸盐反应生成气态SiF4
SiO2 + 4HF = SiF4 + 2H2O
CaSiO3 + 6HF = CaF2 + SiF4 + 3H2O
利用这一特性,氢氟酸被广泛用于分析化学上来测定矿物或钢板中SiO2的含量。用于在玻璃器皿上刻蚀标记和花纹。
2.氢卤酸的制备
(1) HCl
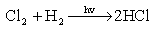 直接合成法
直接合成法
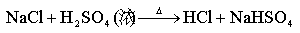
(2) HF
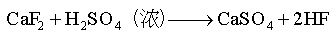
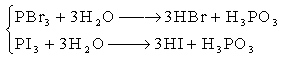 (3)HBr和HI
(3)HBr和HI
卤化物水解
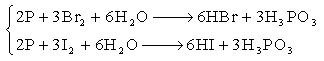
不能用复分解反应
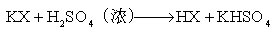 (X=Br,I)
(X=Br,I)
3-3卤化物
.卤化物: 卤素与电负性比较小的元素生成的化合物。
?卤化物又可分为金属卤化物和非金属卤化物两大类。
(1) 键型与熔、沸点
非金属如硼、碳、硅、氮、磷等的卤化物它们都是以共价键结合,具有挥发性,有较低的熔点和沸点。
.金属卤化物 : 随着金属离子半径减小和氧化数增大,同一周期各元素的卤化物自左向右离子性依次降低,共价性依次增强。而且,它们的熔点和沸点也依次降低。
.同一金属的卤化物随着卤离子半径的增大,变形性也增大,按F--CI--Br--I-的顺序其离子性依次降低,共价性依次增加。例如:卤化钠的熔点和沸点的变化

(2)其它性质:
性质: 离子型 共价型
熔点: 高 低
溶解性: 大多易溶于水 易溶于有机溶剂
导电性: 水溶液,熔融导电 无导电性
水解性: 对应氢氧化物不是强碱的 易水解,产物为两种酸,如
都易水解,产物为氢氧化物或碱式盐 BX3,SiX4,PCl3
此外,卤离子能与多数金属离子形成配位化合物。
2. 卤化物的制备
(1)金属与卤素直接化合 要求金属和生成物的熔点、沸点都比较低,或易于升华。如制备HgCl2、AlCl3等。
(2)金属与氢卤酸反应 适于制取金属活泼顺序表中位于前面的金属卤化物。
(3)氧化物、氢氧化物或无机盐与氢卤酸反应
这是利用中和反应或复分解反应制备卤化物的有效方法。
3-4 氯的含氧酸及其盐
次氯酸及其盐
将Cl2通入水中可生成次氯酸(HClO),次氯酸是一种弱酸,且很不稳定,只能以稀溶液存在。它可按三种方式分解:
(1) 2HClO → 2HCl + O2↑
(2) 2HClO → Cl2O + H2O
(3) 2HClO → 2HCl + HClO3
次氯酸钠(NaClO) 做漂白剂
制备: 6NaOH + Cl2 → NaClO + NaCl + H2O
漂白粉是Ca(ClO)2 .2H2O和CaCl2 .Ca(OH)2. H2O的混合物
制备: Cl2 + 3Ca(OH)2 + H2O → Ca(ClO)2 .2H2O + CaCl2. Ca(OH)2. H2O
2. 亚氯酸及其盐
亚氯酸HClO2很不稳定,但氯酸盐比HClO2稳定得多,工业级NaClO2为白色结晶,也是一种高效漂白剂及氧化剂。
3. 氯酸及其盐
HClO3是强酸,也是一种强氧化剂,但氧化能力不如HClO2和HClO。
KClO3是最重要的氯酸盐。它在碱性或中性溶液中氧化作用很弱,在酸性溶液中则为强氧化剂。
△
2KClO3 → 2KCl + 3O2↑
催化剂
△
4KClO3 → 3KClO4 + KCl
△
KClO4 → KCl + 2O2↑
注: KClO3与有机物或可燃物混合,受热、特别是受到撞击极易发生燃烧或爆炸。它做火柴头中的氧化剂。
4. 高氯酸及其盐
HClO4是已知酸中最强的酸,浓热的HClO4是强的氧化剂,遇到有机物质会发生爆炸性反应,但稀冷的HClO4溶液几乎不显氧化性。
HClO4的制备:
KClO4 + H2SO4(浓)→ KHSO4 + HClO4
高氯酸盐一般是可溶的,但Cs+、Rb+、K+及NH4+的高氯酸盐的溶解度都很小。高氯酸盐的水溶液几乎没有氧化性,但固体盐在高温下能分解出氧。
小结:氯的各种含氧酸性质的比较
HClO HClO2 HClO3 HClO4
酸性:↑
稳定性:↑不稳 不稳 相对稳定 稳定
可得40%溶液 可得固体
 1.49 1.57 1.45 1.38
1.49 1.57 1.45 1.38
氧化性↓(除HClO2)
第四节 拟卤素
某些由非金属元素形成的原子例如CN、OCN、SCN等,它们能自相结合成分子如氰(CN)、氧氰(OCN)、硫氰(SCN),这些物质与卤素的性质相似,故称为拟卤素或类卤素。
自学:
拟卤素与卤素的性质异同点
第二篇:必修一《非金属元素及其化合物》测试题
一、选择题(每小题3分,每小题只有1个选项符合题意,13小题,共39分。)
1.检验氯化氢气体中是否混有Cl2,可采用的方法是( )。
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
2.只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是( )。
A.AgNO3 B.NaOH C.BaCl2 D.Ba(OH)2
3.下列说法正确的是( )。
A.SiO2溶于水且显酸性 B.CO2通入水玻璃可得硅酸
C.SiO2是酸性氧化物,它不溶于任何酸 D.SiO2晶体中存在单个SiO2分子
4.利用废铜屑制取CuSO4溶液的最好的方法是( )。
A.铜屑与浓硫酸混合加热 B.铜屑在空气中灼烧后再溶于稀H2SO4
C.铜屑与稀硫酸混合加热 D.铜屑在空气中灼烧后再溶于浓H2SO4
5.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )。
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
6.下列表述正确的是( )。
A.玛瑙的主要成分是硅酸盐
B.人造刚玉的熔点很高,可用作高级耐火材料,主要成分为二氧化硅
C.三峡大坝使用了大量的水泥,水泥是硅酸盐材料
D.太阳能电池可用二氧化硅制作,其应用有利于环保、节能
7.下列说法正确的是( )。
A.雷雨天气时空气中能生成少量的氮氧化物
B.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
C.铵盐化学性质都很稳定
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
8.下列反应中硝酸既表现出了强氧化性又表现了酸性的是( )。
A.氧化铁与硝酸反应 B.氢氧化铝与硝酸反应
C.木炭粉与浓硝酸反应 D.铜与硝酸反应
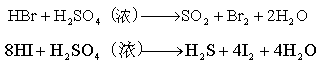
9.已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、
乙的判断正确的是( )。
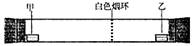
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
10.下列说法正确的是( )。
①漂白粉的有效成分是氯化钙和次氯酸钙
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫增白的食品对人体健康产生损害
④使用氯气对自来水消毒可能生成对人体有害的有机氯化物
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A.①②③ B.②③④ C.①③④ D.①②④
11.下列变化中可以说明SO2具有漂白性的是( )。
A.SO2通入高锰酸钾酸性溶液中红色褪去
B.SO2通入品红溶液中红色褪去
C.SO2通入溴水溶液中红棕色褪去
D.SO2通入氢氧化钠与酚酞的混合溶液中红色褪去
12.下列各组中的离子能大量共存的是( )。
A.H+、Na+、NO3-、SiO32- B.NH4+、K+、Cl-、OH-
C.Mg2+、NH4+、NO3-、SO42- D.K+、H+、SO32-、ClO-
13.把足量的铁粉投入到硫酸与硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉的质量相等,则原溶液
中H+和SO42-的物质的量之比为( )。
A.1:4 B.2:7 C.1:2 D.8:31
二、选择题(每小题4分,每题有1~2个选项符合题意,5小题,错选0分,漏选2分,共20分。)
14.氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )。
A.该反应属于复分解反应 B.该反应利用了Cl2的强氧化性
C.若管道漏气遇氨就会产生白烟 D.生成1 mol N2有6 mol电子转移
15.氯水中存在多种分子和离子。下列实验现象和结论一致且正确的是( )。
A.加入有色布条,有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
16.下面有关硅的叙述中,正确的是( )。
A.硅原子既不易失去电子又不易得到电子,主要形成四价的化合物
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是最重要的半导体材料
17.如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,
石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )。
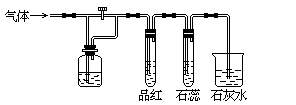
A.HCl和浓H2SO4
B.Cl2和氯水
C.Cl2和NaHCO3溶液
D.SO2和NaHCO3溶液
18.下列说法正确的是( )。
A.液氯能使干燥的有色布条褪色
B.氯气与其他物质发生反应后,氯元素化合价变为-1价
C.新制氯水呈黄绿色是因为其中存在氯气
D.久置氯水遇AgNO3溶液会产生白色沉淀
第二部分 非选择题(共41分)
三、填空题(共41分)
19.(6分)酸雨的形成与大气中二氧化硫及氮氧化物的含量有关。某火力发电厂为除去有害气体SO2,并变废为宝,采用尾气脱硫
新工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式:
。
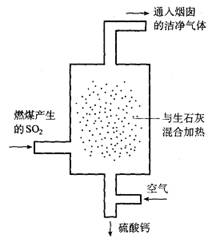
20.(8分)在某NaOH溶液里加入几滴酚酞试液,溶液显红色,向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。
回答下列问题:
(1)产生该现象的原因可能有:
① ;② 。
(2)简述怎样用实验证明红色褪色的原因是①或者是②:
。
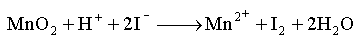
21.(12分)实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中
毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)
。
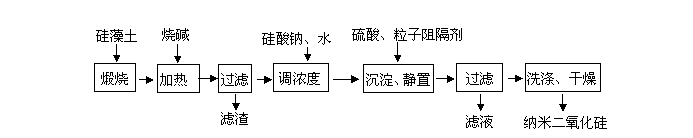
22.(15分)硅藻土由无定形的SiO2组成,含有少量Fe2O3、Al2O3及有机物等杂质。通常呈浅黄色或浅灰色,质软多孔。工业上可
按如下流程,用硅藻土制备纳米二氧化硅。
(
1)煅烧硅藻土的目的是 。
(2)在加热条件下加入烧碱时反应的化学方程式为 。
(3)加入过量硫酸后生成沉淀的反应方程式为
。
(4)上述流程中,有助于控制二氧化硅粒子直径的措施有
(至少写出一个)。
人教版必修1第四章《非金属元素及其化合物》测试题(A卷)参考答案
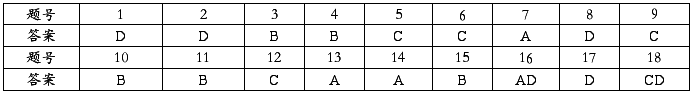
一、选择题(每小题3分,每小题只有1个选项符合题意,13小题,共39分。)
二、选择题(每小题4分,每小题有1~2个选项符合题意,5小题,错选0分,漏选2分,共20分。)
三、填空题(共41分)
19.(6分)
CaO+SO2 △ CaSO3 (3分) 2CaSO3+O2 △ 2CaSO4 (3分)
20.(8分)
(1) ①氯水中H+(或Cl2)与OH-反应(2分)
②氯水中HClO使酚酞褪色(2分)
(2)向褪色后的溶液中再滴加NaOH溶液,若红色再现,则是①的原因造成的;若红色不再出现,则是②的原因造成的。(4分)
21.(12分)
(1)2 (2分) 2 (2分)
(2)4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O (4分)
(3)Cl-+ClO-+2H+== Cl2↑+H2O (4分)
22.(15分)
(1)除去有机杂质。(3分)
(2)SiO2 + 2NaOH === Na2SiO3 + H2O(3分),Al2O3 + 2NaOH === 2NaAlO2 + H2O(3分)
(3)Na2SiO3 + H2SO4=== Na2SO4+ H2SiO3 (3分)
(4)沉淀时加入粒子阻隔剂(或加入硅酸钠和水调浓度)(3分)