酶促反应动力学实验的设计
【实验目的】
酶促反应动力学研究酶促反应的速度以及影响酶促反应速度的各种因素。影响酶促反应的因素主要包括酶浓度、底物浓度、温度、pH、抑制剂和激活剂。本实验的目的即是通过设计一定的实验方案,以分析研究各种因素对酶促反应速度的影响。各实验小组可在以下实验项目中选择一项,通过检索参考文献资料,组织课堂讨论,设计完成实验方案,并通过具体实验操作以检验实验方案的可行性和正确性。
(一)温度对唾液淀粉酶活性的影响
【实验原理】
酶作为生物催化剂与一般催化剂一样呈现温度效应,酶促反应开始时,反应速度随温度升高而增快,达到最大反应速度时的温度称为某种酶的最适温度。由于绝大多数酶是有活性的蛋白质,当达到最适温度后,继续升高温度,引起蛋白质变性,酶促反应速度反而逐步下降,以至完全停止。
酶的最适温度不是一个常数,它与作用时间长短有关。测定酶活性均在酶促反应最适温度下进行。常用恒温水浴保持温度恒定。大多数动物来源的酶最适温度为37~40℃。 本设计性实验以人唾液淀粉酶为例,观察高温(沸水浴)、最适温度(37℃水浴)和低温(冰水浴)环境对酶活性的影响,并根据底物即淀粉水解的快慢来判断酶活性的高低。 淀粉经淀粉酶催化水解为葡萄糖的不同阶段,与碘试剂作用的颜色反应如下:淀粉(蓝色)→紫色糊精(紫色)→红色糊精(红色)→无色糊精(不显色)→麦芽糖(不显色)→葡萄糖(不显色)。
【实验试剂和器材】
1. 试剂
⑴ 1/15 mol/LpH6.8磷酸盐缓冲液(phosphate-bufferedsaline,PBS):称取NaH2PO4·2H2O10.4 g,溶于1000 mL蒸馏水中,即为1/15 mol/L NaH2PO4液。称取Na2HPO4·12H2O23.88 g,溶于1000 mL蒸馏水中,即为1/15 mol/L Na2HPO4液。
取1/15mol/LNaH2PO4液51 mL,加1/15 mol/L Na2HPO4液49 mL,混匀,即为1/15 mol/L pH 6.8磷酸盐缓冲液。
⑵ 1%淀粉液。
⑶ 0.3%稀碘液:溶解2 g KI于20 mL蒸馏水中,加入1g碘,于量筒中稀释到300 mL。
⑷ 0.9%NaCl。
2. 器材
⑴ 试管及试管架。
⑵ 滴管。
⑶ 刻度吸量管。
⑷ 恒温水浴、冰水浴、沸水浴。
⑸ 白瓷比色盘。
【设计提示】
1. 本实验所用的酶是唾液淀粉酶,底物是淀粉。怎样收集并稀释人唾液淀粉酶?
2. 淀粉水解后的产物是什么?怎样才能判断淀粉的水解程度?
3. 将设计的不同温度组、所用试剂、操作步骤等,以表格形式列出。
4. 讨论并确定最佳实验设计方案。
【实验注意事项】
1. 在磷酸盐缓冲液中,人唾液淀粉酶在pH6.8时具有最大活性。Cl-为其激活剂。
2. 观察不同温度对酶活性的影响时,温度之间的差别应较大。
(二)pH对唾液淀粉酶活性的影响
【实验原理】
酶的催化活性与环境pH有密切关系,通常各种酶只在一定pH范围内才有活性,酶活性最高时的pH称为酶的最适pH。高于或低于此pH时酶的活性逐渐降低。不同的酶最适pH也不同,如胃蛋白酶的最适pH为1.5~2.5,胰蛋白酶的最适pH为8.0。
酶的最适pH不是酶的特征性物理常数。对于同一种酶,其最适pH因缓冲液和底物的性质不同而有差异。如人唾液淀粉酶最适pH为6.8,但在磷酸盐缓冲液中,其最适pH为6.4~6.6,而在乙酸缓冲液中则为5.6。
本实验以人唾液淀粉酶为例,观察不同pH环境对酶活性的影响,并根据底物即淀粉水解的快慢来判断酶活性的高低。
【实验试剂和器材】
1. 试剂
⑴ 磷酸氢二钠-柠檬酸缓冲液:称取Na2HPO4·2H2O35.61 g,溶于1000 mL蒸馏水中,即为0.2 mol/L Na2HPO4液。称取柠檬酸(C6H8O7·2H2O)21.01 g,溶于1000 mL蒸馏水中,即为0.1 mol/L柠檬酸液。
取0.2 mol/L Na2HPO4液10.30 mL,加0.1 mol/L柠檬酸液9.70 mL,混匀,即为pH5.0磷酸氢二钠-柠檬酸缓冲液。
取0.2 mol/L Na2HPO4液11.37 mL,加0.1 mol/L柠檬酸液8.63 mL,混匀,即为pH5.5磷酸氢二钠-柠檬酸缓冲液。
取0.2 mol/L Na2HPO4液12.63 mL,加0.1 mol/L柠檬酸液7.37 mL,混匀,即为pH6.0磷酸氢二钠-柠檬酸缓冲液。
取0.2 mol/L Na2HPO4液13.85 mL,加0.1 mol/L柠檬酸液6.15 mL,混匀,即为pH6.4磷酸氢二钠-柠檬酸缓冲液。
取0.2 mol/L 中国卫生人才网Na2HPO4液15.45 mL,加0.1 mol/L柠檬酸液4.55 mL,混匀,即为pH6.8磷酸氢二钠-柠檬酸缓冲液。
取0.2 mol/L Na2HPO4液18.17 mL,加0.1 mol/L柠檬酸液1.83 mL,混匀,即为pH7.4磷酸氢二钠-柠檬酸缓冲液。
取0.2 mol/L Na2HPO4液19.45 mL,加0.1 mol/L柠檬酸液0.55 mL,混匀,即为pH8.0磷酸氢二钠-柠檬酸缓冲液。
⑵ 1%淀粉液。
⑶ 0.3%稀碘液:溶解2 g KI于20 mL蒸馏水中,加入1 g碘,于量筒中稀释到300 mL。
⑷ 0.9%NaCl。
2. 器材
⑴ 试管及试管架。
⑵ 滴管。
⑶ 刻度吸量管。
⑷ 恒温水浴。
⑸ 白瓷比色盘、秒表。
【设计提示】
1. 本实验所用的酶是唾液淀粉酶,底物是淀粉。怎样收集并稀释人唾液淀粉酶?
2. 淀粉水解后的产物是什么?怎样才能判断淀粉的水解程度?
3. 将设计的不同pH组、所用试剂、操作步骤等,以表格形式列出。
4. 讨论并确定最佳实验设计方案。
【实验注意事项】
1. 在磷酸盐缓冲液中,人唾液淀粉酶在pH6.8时具有最大活性。Cl-为其激活剂。
2. 观察不同pH对酶活性的影响时,pH之间的差别应较大。
(三)琥珀酸脱氢酶的竞争性抑制
【实验原理】
在化学结构上与底物类似的抑制剂,能与底物竞争和酶分子的活性中心结合,抑制酶的活性。抑制的程度随抑制剂与底物两者浓度的对比而定。如果底物浓度不变,酶活性的抑制程度随抑制剂的浓度增加而增加。反之,如果抑制剂的浓度不变,则酶活性随底物浓度的增加而逐渐恢复,这种类型的抑制称为竞争性抑制。 本设计性实验的目的是观察丙二酸对琥珀酸脱氢酶的竞争性抑制。琥珀酸脱氢酶的活性,在隔绝空气的条件下,可从加入的甲烯蓝(methelene blue)的褪色情况来判断。
【实验试剂和器材】
1. 试剂
⑴ 1/15 mol/LpH 7.4磷酸盐缓冲液:称取9.078 g KH2PO4溶于蒸馏水中,1000 mL容量瓶中稀释到刻度,为1/15 mol/L KH2PO4溶液。称取23.87 g
Na2HPO4·12H2O溶于蒸馏水中,于1000 mL容量瓶中稀释到刻度,为1/15 mol/L Na2HPO4溶液。
取1/15 mol/L KH2PO4溶液175 mL,1/15 mol/L Na2HPO4溶液825 mL,混合,即为1/15 mol/L pH7.4磷酸盐缓冲液。
⑵ 0.2mol/L琥珀酸。
⑶ 0.02mol/L琥珀酸。
⑷ 0.2mol/L丙二酸。
⑸ 0.02mol/L丙二酸。
⑹ 0.02%甲烯蓝(methelene blue)。
2. 器材
⑴ 试管及试管架。
⑵ 滴管、漏斗、纱布。
⑶ 刻度吸量管。
⑷ 高速组织捣碎机。
⑸ 烧杯、研钵。
⑹ 恒温水浴箱。
【设计提示】
1. 本实验以大鼠骨骼肌为实验材料以提取琥珀酸脱氢酶,底物是琥珀酸,竞争性抑制剂是丙二酸。
2. 怎样才能判断琥珀酸脱氢酶活性的高低?
3. 将设计的不同浓度比组、所用试剂、操作步骤等,以表格形式列出。
4. 讨论并确定最佳实验设计方案。
【实验注意事项】
1. 琥珀酸脱氢酶在pH7.4的磷酸盐缓冲系统中有较高活性。
2. 设计时应使琥珀酸与丙二酸的浓度比有较大的差异。
实验设计 成员:
胡克维 20xxxxxxxxxxxx 蔡蒋伟 20xxxxxxxxxxxx 庞一为 20xxxxxxxxxxxx 张鑫宇 20xxxxxxxxxxxx 李针 20xxxxxxxxxxxx
第二篇:第九章 酶促反应动力学
第九章 酶促反应动力学
一、是非判断题
1.酶促反应的初速度与底物浓度无关。( )
2.当底物处于饱和水平时,酶促反应的速度与酶浓度成正比。( )
3.某些酶的Km由于代谢产物存在而发生改变,而这些代谢产物在结构上与底物无关。( )
4.在非竞争性抑制剂存在下,加入足量的底物,酶促的反应能够达到正常Vmax。( )
5.碘乙酸因可与活性中心-SH以共价键结合而抑制巯基酶,而使糖酵解途径受阻。( )
6.从鼠脑分离的己糖激酶可以作用于葡萄糖(Km=6×10-6mol/L)或果糖(Km=2×10-3mol/L),则己糖激酶对果糖的亲和力更高。( )
7.Km是酶的特征常数,只与酶的性质有关,与酶浓度无关。( )
8.Km是酶的特征常数,在任何条件下,Km是常数。( )
9.Km是酶的特征常数,只与酶的性质有关,与酶的底物无关。( )
10.一种酶有几种底物就有几种Km值。( )
11.当[S]>>Km时, V趋向于Vmax,此时只有通过增加[E]来增加V。( )
12.酶的最适pH值是一个常数,每一种酶只有一个确定的最适pH值。( )
13.酶的最适温度与酶的作用时间有关,作用时间长,则最适温度高,作用时间短,则最适温度低。( )
14.金属离子作为酶的激活剂,有的可以相互取代,有的可以相互拮抗。( )
15.增加不可逆抑制剂的浓度,可以实现酶活性的完全抑制。( )
16.竞争性可逆抑制剂一定与酶的底物结合在酶的同一部位。( )
答案
1.错。 2.对。 3.对。 4.错。 5.对。 6.错。 7.对。 8.错。
9.错。 10.对。 11.对。 12.错。 13.错。 14.对。 15.对。 16.错。
二、填空题
1.影响酶促反应速度的因素有 、 、 、 、 和 。
2.丙二酸和戊二酸都是琥珀酸脱氢酶的 抑制剂。
3.通常讨论酶促反应的反应速度时,指的是反应的 速度,即 时测得的反应速度。
4.pH值影响酶活力的原因可能有以下几方面:影响 ,影响 ,影响 。
5.温度对酶活力影响有以下两方面:一方面 ,另一方面 。
6.酶促动力学的双倒数作图(Lineweaver-Burk作图法),得到的直线在横轴的截距为 ,纵轴上的截距为 。
7.磺胺类药物可以抑制 酶,从而抑制细菌生长繁殖。
答案
1.[E];[S];pH;T(温度);I(抑制剂);A(激活剂)
2.竞争性
3.初;底物消耗量<5%
4.底物分子的解离状态;酶分子的解离状态;中间复合物的解离状态
5.温度升高,可使反应速度加快;温度太高,会使酶蛋白变性而失活
6.-1/Km;1/Vmax
7.二氢叶酸合成酶
三、选择题
1.竞争性抑制剂作用特点是:
A.与酶的底物竞争激活剂 B.与酶的底物竞争酶的活性中心
C.与酶的底物竞争酶的辅基 D.与酶的底物竞争酶的必需基团;
E.与酶的底物竞争酶的变构剂
2.竞争性可逆抑制剂抑制程度与下列那种因素无关:
A.作用时间 B.抑制剂浓度 C.底物浓度
D.酶与抑制剂的亲和力的大小 E.酶与底物的亲和力的大小
3.哪一种情况可用增加[S]的方法减轻抑制程度:
A.不可逆抑制作用 B.竞争性可逆抑制作用 C.非竞争性可逆抑制作用
D.反竞争性可逆抑制作用 E.无法确定
4.酶的竞争性可逆抑制剂可以使:
A.Vmax减小,Km减小 B.Vmax增加,Km增加
C.Vmax不变,Km增加 D.Vmax不变,Km减小
E.Vmax减小,Km增加
5.下列常见抑制剂中,除哪个外都是不可逆抑制剂:
A 有机磷化合物 B 有机汞化合物 C 有机砷化合物
D 氰化物 E 磺胺类药物
6.对于下列哪种抑制作用,抑制程度为50%时,[I]=Ki :
A.不可逆抑制作用 B.竞争性可逆抑制作用
C.非竞争性可逆抑制作用 D.反竞争性可逆抑制作用 E.无法确定
7. 利用恒态法推导米氏方程时,引入了除哪个外的三个假设?
A.在反应的初速度阶段,E+P→ES可以忽略
B.假设[S]>>[E],则[S]-[ES]≈[S]
C.假设E+S→ES反应处于平衡状态
D.反应处于动态平衡时,即ES的生成速度与分解速度相等
8. 用动力学的方法可以区分可逆、不可逆抑制作用,在一反应系统中,加入过量S和一定量的I,然后改变[E],测v,得v~[E]曲线,则哪一条曲线代表加入了一定量的可逆抑制剂? 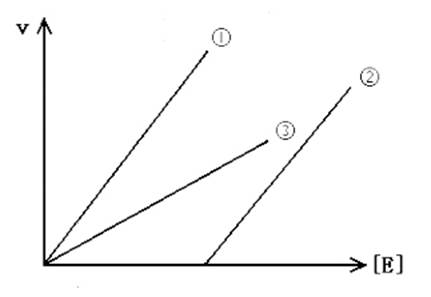
A.1
B.2
C.3
D.不可确定
9. 在一反应体系中,[S]过量,加入一定量的I,测v~[E]曲线,改变[I],得一系列平行曲线,则加入的I是: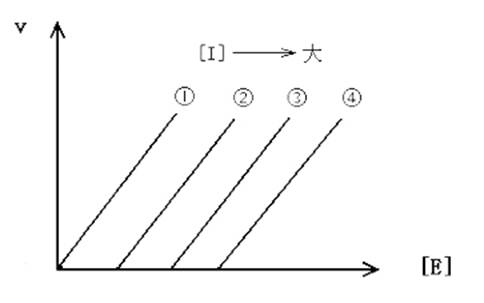
A.竞争性可逆抑制剂
B.非竞争性可逆抑制剂
C.反竞争性可逆抑制剂
D.不可逆抑制剂
10. 竞争性可逆抑制剂抑制程度与下列哪种因素无关?
A.作用时间
B.抑制剂浓度
C.底物浓度
D.酶与抑制剂的亲和力的大小
E.酶与底物的亲和力的大小
11. 酶的竞争性可逆抑制剂可以使:
A.Vmax减小,Km减小
B.Vmax增加,Km增加
C.Vmax不变,Km增加
D.Vmax不变,Km减小
E.Vmax减小,Km增加
12. 丙二酸对琥珀酸脱氢酶的影响属于:
A.反馈抑制
B.底物抑制
C.竞争性可逆抑制
D.非竞争性可逆抑制
E.反竞争性可逆抑制
13. 测定酶活性时,通常以底物浓度变化小于多少时测得的速度为反应的初速度?
A.0.1%
B.0.5%
C.1%
D.2%
E.5%
答案
1.B。 2.A。 3.B。 4.C。 5.E。 6.C。7.C。 8.C。 9.D。 10.A。 11.C。 12.C。 13.A。
