酶促反应动力学综合实验
实验(一)——碱性磷酸酶Km值的测定
【目的要求】
1.了解底物浓度对酶促反应速度的影响
2.了解米氏方程、Km值的物理意义及双倒数作图求Km的方法。
【实验原理】
1、碱性磷酸酶:
碱性磷酸酶是广泛分布于人体各脏器器官中,其中以肝脏为最多其次为肾脏,骨骼、肠、和胎盘等组织。但它不是单一的酶,而是一组同功酶。本实验用的碱性磷酸酶是从大肠杆菌中提取。
2、米氏方程:
Michaelis-Menten 在研究底物浓度与酶促反应速度的定量关系,导出了酶促反应动力学的基本公式,即:
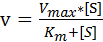 (1)
(1)
式中:v表示酶促反应速度,
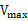 表示酶促反应最大速度,
表示酶促反应最大速度,
[S]表示底物浓度,
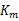 表示米氏常数。
表示米氏常数。
3、 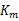 值的测定主要采用图解法,有以下四种:
值的测定主要采用图解法,有以下四种:
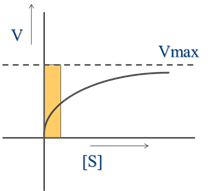
①双曲线作图法(图1-1,a)
根据公式(1),以v对[s]作图,此时1/2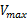 时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测
时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测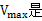 一个近似值,因而1/2
一个近似值,因而1/2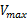 不精确。此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。
不精确。此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。
② Lineweaver- Burk作图法双倒数作图法(图1-1,b)
实际工作中,常将米氏方程(式(1))作数学变换,使之成为直线行驶,测定要方便、精确地多。其中之一即取(1)式的倒数,变换为Lineweaver- Burk方程式:
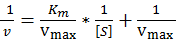 (2)
(2)
以 对
对 作图,即为y=ax+b形式。此时斜率为
作图,即为y=ax+b形式。此时斜率为 ,纵截距为
,纵截距为 。把直线外推与横轴相交,其截距相交,其截距即为—
。把直线外推与横轴相交,其截距相交,其截距即为—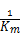 。
。
③Hofstee作图法(略)
把(2)式等号两边乘以 ,得:
,得:

 (3)
(3)
以v对 作图,这时斜率为
作图,这时斜率为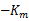 ,纵截距为
,纵截距为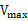 ,横截距为
,横截距为 。
。
④Hanas作图法(略)
把(2)式等号两边乘以[S],得:
 (4)
(4)
以v对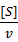 作图,这时斜率为
作图,这时斜率为 ,纵截距为
,纵截距为 。
。

(a) (b)
本实验主要以双倒数法,即Lineweaver- Burk作图法来测定碱性磷酸酶Km值。具体原理如下:
本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯二钠产生酚和磷酸,在适宜条件下(PH10.0,和60℃),准确反应13分钟。在碱性条件下酚可与酚试剂生成蓝色化合物,以波长620nm比色。在一定条件下色泽深浅与光密度成正比。反应式如下:
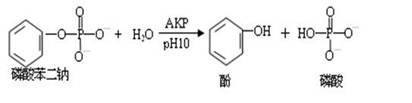

然后以光密度直接表示不同底物浓度时的酶反应速度,即以光密度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver- Burk作图法来测定碱性磷酸酶Km值。
【仪器与试剂】
仪器:
1. 恒温水浴
2. 721型分光光度计
试剂:
1.酚试剂:称钨酸钠( W
W ·2
·2 O)100g,钼酸钠(
O)100g,钼酸钠( Mo
Mo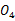 ·2
·2 O)25g置1500mL磨口回流装置内,加蒸馏水700mL,85%磷酸50mL和浓硫酸100mL。充分混匀,使其溶解。小火加热,回流10h(烧瓶内加小玻璃珠数颗,以防溶液溢出),再加入硫酸锂(LiSO4)150g,蒸馏水50mL及液溴数滴。在通风橱中开口煮沸15min,以除去多余的溴。冷却后定容至1000mL,过滤即成,此液应为鲜黄色,不带任何绿色。置棕瓶中,可在冰箱长期保存。若此贮存液使用过久,颜色由黄变绿,可加几滴液溴,煮沸几分钟,恢复原色仍可继续使用。使用时用蒸馏水稀释一倍,最后酸度为1N。
O)25g置1500mL磨口回流装置内,加蒸馏水700mL,85%磷酸50mL和浓硫酸100mL。充分混匀,使其溶解。小火加热,回流10h(烧瓶内加小玻璃珠数颗,以防溶液溢出),再加入硫酸锂(LiSO4)150g,蒸馏水50mL及液溴数滴。在通风橱中开口煮沸15min,以除去多余的溴。冷却后定容至1000mL,过滤即成,此液应为鲜黄色,不带任何绿色。置棕瓶中,可在冰箱长期保存。若此贮存液使用过久,颜色由黄变绿,可加几滴液溴,煮沸几分钟,恢复原色仍可继续使用。使用时用蒸馏水稀释一倍,最后酸度为1N。
2.2.5mM磷酸苯二钠基质液:称取625g磷酸苯二钠(C6H5PO4Na2?2H2O),用煮沸后冷却的蒸溜水溶解,并稀释至1,000ml,加数滴氯仿防腐,贮于棕色瓶内,置冰箱内保存,可用一周。
3.碱性缓冲液(pH10.0): 称取无水碳酸钠6.36g及碳酸氢钠3.36g,溶解于蒸馏水中,并稀释至1,000ml.
4.碱性磷酸酶液:称取碱性磷酸酶1mg,加水3~4ml,冰箱内可保存五周左右。
【实验步骤】
取6支试管按下表加入试剂:
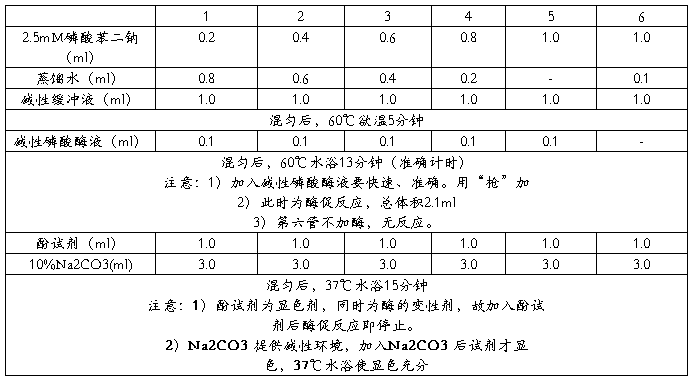
以6管为调零点,在620nm波长处比色。
【结果处理】
1 将各管光密度和底物浓度记入下表

2以1/O.D为纵坐标,1/[s]为横坐标,按Lineweaver- Burk作图,求出碱性磷酸酶的Km值。
【注意事项】
1) 加入碱性磷酸酶的量要准确
2) 保温时间要准确
提供方法:如从第一管加入酶液开始计时,每隔1分钟向下一只试管加酶液,直至加完,到准确13分钟立即向第一管加酚试剂,以终止其反应,并每隔1分钟向下一只试管加酚试剂,直至加完止,这样保证每管准确保温13分钟。
【思考题】(待定)
1) Km 的意义
2) 为什么酶促反应速度以初速度表示
3)为什么O.D可直接代替V作图
4)分析自己的实验数据
实验(二)——温度对酶活性的影响
【实验目的】
了解温度对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
每种酶都有其最适温度,高于或低于此温度酶的活性都降低。一般而言,若酶处于过高的温度环境中,会使酶活性永久丧失;而若处于极低温度的环境中只会使酶活性受到抑制,一旦温度适宜,酶又会全部或部分的恢复其活性。
【仪器与试剂】
仪器:
1.冰箱 2.恒温水浴锅 3.试管和试管架
4.吸量管及吸量管架 5.移液枪及枪头 6.胶头滴管
7.烧杯
试剂:
1. PH6.8的缓冲液:量取15.45ml的0.2M磷酸氢二钠和4.55ml的柠檬酸混合摇匀即可。
2.0.5%淀粉的0.5%氯化钠溶液:0.5g可溶性淀粉和0.5g氯化钠,溶于100ml蒸馏水(需加热)。
3.0.03175g/L碘液
4.1M HCl溶液 5.1M NaOH溶液 6.稀释100倍的唾液
【实验步骤】
1.制管和预温
实验开始时,并不是将下表三种试剂直接混合加入同一试管,而是每个温度梯度使用两支试管,分别标记为A管和B管。A管加入PH6.8的缓冲液和0.5%淀粉液;B管使用移液枪加入稀释100倍的唾液,相对应的两支试管置于设定的温度下预温5min。
取12支洁净试管,参照下表加入试剂:
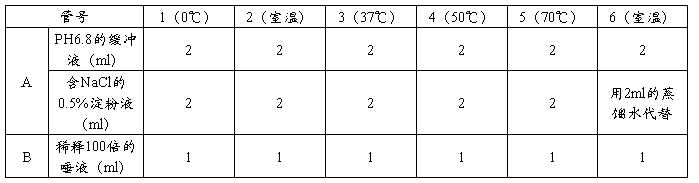
*6号管为对照组(比色时作为0号管),置于室温,且淀粉液用蒸馏水代替
2.混合A、B管
将一号A管试剂迅速加入温度对应的B管中(为了最大限度保证酶的量),此时为计时的起点(使用秒表),摇匀后放回对应温度继续水浴。这一步应注意:转移A管试剂前需将其摇匀。
3.时间控制
然后每隔1min或2min(时间自定)按上步操作依次把2、3、4、5、6号的A、B管混合 ,控制好时间。
4.中止反应
准确反应13min,向1号管加入2滴1M HCl溶液,立即混匀,中止反应,按上一步的顺序和时间间隔依次对各管进行操作,并移至试管架。后再各用2滴1M NaOH溶液中和每管。
5.显色
在每管中各加入2ml 0.03175g/L碘液并混匀,观察现象。
6.比色
若不同温度梯度间现象差别不明显,则进行比色,通过光密度值来比较。
【结果处理】
记录现象(或比较吸光度值),做出合理分析。
【注意事项】
【思考题】
实验(三)——PH对酶活性的影响
【实验目的】
了解PH对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
【仪器与试剂】
仪器:
1、冰箱 2、电炉 3、恒温水浴锅 4、试管架及试管
5、移液管架及移液管
试剂:
1、0.2M磷酸氢二钠溶液:称取35.61g含2个结晶水的磷酸氢二钠,用水定容至1L。
2、0.1M柠檬酸溶液:称取21.01g含一个结晶水的柠檬酸,用水定容至1L。
3、唾液淀粉酶:将唾液分别稀释10倍、50倍和100倍,得三种不同浓度的酶液、
4、0.5%淀粉的0.5%氯化钠溶液:0.5g可溶性淀粉和0.5g氯化钠,溶于100ml蒸馏水(需加热)。
5、0.1%淀粉液:0.1g可溶性淀粉,加到100ml蒸馏水中,加热溶解。
6、碘液:15g碘化钾和12.7g碘,加少许水使碘完全溶解后,再用水稀释至200ml。
7、1%氯化钠溶液。
8、0.1%硫酸铜溶液。
【实验步骤】
(一)PH对酶活性的影响
1、缓冲溶液的配制
表23-1 磷酸氢二钠-柠檬酸缓冲液的配制

取六支洁净试管,编号后按表23-2操作:
表23-2 pH对酶活性的影响

【结果处理】
记录现象(或比较吸光度值),做出合理分析。
【注意事项】
【思考题】
实验(四)——酶浓度对酶活性的影响
【实验目的】
了解酶浓度对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
在适宜的条件下,若反应物浓度大大高于酶浓度时,反应速度随酶浓度增加而增加,两者间成正比。
本实验采用唾液淀粉酶为例。加入不同浓度的酶,并比较在同一适当时间后,以碘检验淀粉的含量从而确认其反应程度。
【仪器与试剂】
仪器:
1.恒温水浴锅
2.吸量管
3.试管与试管架
试剂:
1.含NaCI的0.5%淀粉液
2.pH7.0的缓冲液
3.分别稀释过10、50和100后的唾液
【实验步骤】
1.取3支洁净试管,按下表加入淀粉液,缓冲液,加毕后放入37度恒温水浴中保温5分钟;
2.保温后,快速加入不同浓度的稀释唾液,摇匀,立即放入37度恒温水浴中,并计时。约3至4分钟后加入稀释后等量的碘液一至两滴,立即摇匀后,记录各管的颜色。

【结果处理】
记录现象,做出合理分析。
【注意事项】
【思考题】
实验(五)——离子对酶活性的影响
【实验目的】
了解离子对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
酶的活性常常受某些物质的影响,有些物质能使酶的活性增加,称为酶的激活剂;有些物质能使酶的活性降低,称为酶的抑制剂。Cl-是唾液淀粉酶的激活剂。其它的阴离子,如Br-、NO3-和I- 对该酶也有激活作用,但较微弱。而Cu2+对唾液淀粉酶具有抑制作用。激活剂和抑制剂影响酶活性的剂量是很少的,并且常具有特异性。
就本实验,低浓度CI-可以增加酶活性,高浓度的CI-或者低浓度的Cu2+则会抑制酶活性,同时低浓度的Na+、SO42-等对酶活性没有影响。激活剂的作用机制是多种多样的,可能是作为辅酶或辅基的一个组成部分,也可以直接作为酶活性中心的构成部分。
【仪器与试剂】
仪器:
1.恒温水浴锅
2.吸量管
3.试管与试管架
试剂:
1. 1%NaCI溶液
2. 0.1%CuSO4溶液
3. 0.1%淀粉液
4. 100倍稀释唾液、5.碘液
【实验步骤】
取3支洁净的试管,编号后按下表操作:
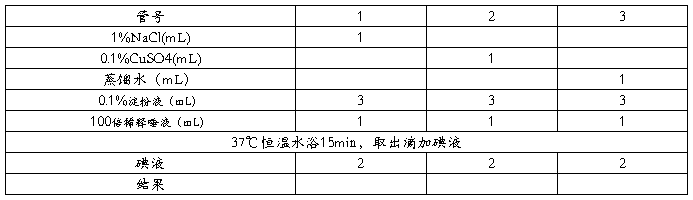
【结果处理】
记录现象(或比较吸光度值),做出合理分析。
【注意事项】
【思考题】
为什么加入淀粉后有试管内颜色显现为红色?
(思考题可以总结起来出在最后面)
第二篇:实验五 酶促反应动力学实验
实验五 酶促反应动力学实验
——温度和离子对酶活性的影响
【实验目的】
1、了解温度对酶活性及酶促反应速度的影响,加深对酶特性的认识。
2、了解离子对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
1、每种酶都有其最适温度,高于或低于此温度酶的活性都降低。一般而言,若酶处于过高的温度环境中,会使酶活性永久丧失;而若处于极低温度的环境中只会使酶活性受到抑制,一旦温度适宜,酶又会全部或部分的恢复其活性。
2、酶的活性常常受某些物质的影响,有些物质能使酶的活性增加,称为酶的激活剂;有些物质能使酶的活性降低,称为酶的抑制剂。Cl-是唾液淀粉酶的激活剂。其它的阴离子,如Br-、NO3-和I- 对该酶也有激活作用,但较微弱。而Cu2+对唾液淀粉酶具有抑制作用。激活剂和抑制剂影响酶活性的剂量是很少的,并且常具有特异性。
就本实验,低浓度CI-可以增加酶活性,高浓度的CI-或者低浓度的Cu2+则会抑制酶活性,同时低浓度的Na+、SO42-等对酶活性没有影响。激活剂的作用机制是多种多样的,可能是作为辅酶或辅基的一个组成部分,也可以直接作为酶活性中心的构成部分。
【实验用品】
1、仪器和器材:冰箱、恒温水浴锅、紫外分光光度计、试管和试管架、移液枪及枪头、胶头滴管、烧杯
2、试剂:1)PH6.8的缓冲液:量取15.45ml的0.2M磷酸氢二钠和4.55ml的柠檬酸混合摇匀即可。
2)0.5%淀粉的0.5%氯化钠溶液:0.5g可溶性淀粉和0.5g氯化钠,溶于100ml蒸馏水(需加热)。
3)碘液
4)1M HCl溶液
5)1M NaOH溶液
6)稀释100倍的唾液
7)冰水浴
8) 1%NaCI溶液
9) 0.1%CuSO4溶液
10)0.1%淀粉液
【实验内容】
(一)温度对酶活性的影响
1.制管和预温:
由于本实验对恒温反应要求较高,故每个温度梯度使用两支试管,分别标记为A管和B管,同时欲温底物与酶。A管加入PH6.8的缓冲液和0.5%淀粉液;B管使用移液枪加入稀释100倍的唾液,相对应的两支试管置于设定的温度下预温5min。
取12支洁净试管,参照下表加入试剂:
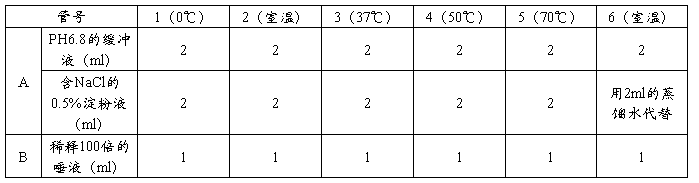
*6号管为对照组(比色时作为0号管),置于室温,且淀粉液用蒸馏水代替
2.混合A、B管:
将1号A管试剂迅速加入温度对应的B管中(为了最大限度保证酶的量),此时为计时的起点(使用秒表),摇匀后放回对应温度继续水浴。注意:转移A管试剂前需将其摇匀。
3.时间控制
然后每隔1min或2min(时间自定)按上步操作依次把2、3、4、5、6号的A、B管混合 ,严格控制好时间。
4.中止反应
准确反应13min,向1号管加入2滴1M HCl溶液,立即混匀,中止反应,按上一步的顺序和时间间隔依次对各管进行操作,并移至试管架。后再各用2滴1M NaOH溶液中和每管。
5.显色
在每管中各加入2ml 0.03175g/L碘液并混匀,观察现象。
6.比色
若不同温度梯度间现象差别不明显,则进行比色,通过光密度值来比较。
(二)离子对酶活性的影响
取3支洁净的试管,编号后按下表操作:

【结果处理】
记录现象(或比较吸光度值),做出合理分析。
【注意事项】
严格注意时间的控制及各物质的添加量。
【思考题】
1、如果某同学(没有严格按照教案步骤)做出的实验结果为唾液淀粉酶的最适温度为70度,请分析他得出这样的结果的可能原因。
2、为什么加入淀粉后有试管内颜色显现为红色?
