醋酸电离常数的测定
一、实验目的:
1、了解用pH法测定醋酸电离度或离解度和电离常数或离解常数的原理和方法;
2、加深对弱电解质电离或离解平衡的理解;
3、学习酸度或电导率仪的使用方法,进一步练习滴定管、移液管的基本操作。
二、实验原理
醋酸CH3COOH(常简写作HAc)是弱电解质,在水溶液中存在着下列电离平衡或离解平衡:
HAc(aq) ←→ H+(aq)+Ac-(aq)
其电离常数或离解常数为:
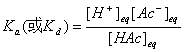
如果HAc的起始浓度为c起始(mol·L-1),其电离度或离解度(即平衡时溶液中已电离或离解的HAc分子数占原来的HAc总分子数的百分率)为 ,由于
,由于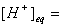 c起始
c起始 ,则式(12-1)为:
,则式(12-1)为:
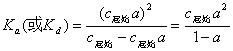
某一弱电解质的电离常数或离解常数 仅与温度有关,而与该弱电解质溶液的浓度无关;其电离度或离解度a则随溶液浓度的降低而增大。可以有多种方法用来测定弱电解质的a和
仅与温度有关,而与该弱电解质溶液的浓度无关;其电离度或离解度a则随溶液浓度的降低而增大。可以有多种方法用来测定弱电解质的a和 ,本实验所采用的方法有下列两种。
,本实验所采用的方法有下列两种。
(1)pH法测定HAc的 和
和
在一定温度下,用酸度计(又称为pH计)测定一系列已知浓度的HAc溶液的pH值,按pH=-lg[H+]换算成[H+]。根据[H+]= c起始 ,即可求得一系列对应的HAc的电离度或离解度a和
,即可求得一系列对应的HAc的电离度或离解度a和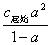 值应近似为一常数,取其平均值,即为该温度时HAc的电离常数或离解常数
值应近似为一常数,取其平均值,即为该温度时HAc的电离常数或离解常数 。
。
(2)另一种方法简单易行,无需知道HAc溶液的浓度就能测定它的 。
。
根据缓冲溶液的计算公式:
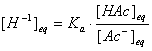
若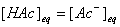 ,则上式可简化为:
,则上式可简化为:

因而如果将HAc溶液分为体积相等的两部分,其中一部分溶液用NaOH溶液滴定至终点(此时HAc即几乎完全转化为Ac-),再与另一部分溶液混合,并测定该混合溶液(即缓冲溶液)的pH值。由对应的[H+]可得到HAc的电离常数或离解常数 。若已知HAc溶液的浓度,则可得到该浓度时HAc的电离度或离解度
。若已知HAc溶液的浓度,则可得到该浓度时HAc的电离度或离解度 。
。
三、仪器和药品
(1)仪器和器皿
烧杯(100mL,2只) 移液管(25mL,10 mL ,5 mL ,3支) ,容量瓶, 吸气橡皮球 洗瓶 玻璃棒 温度计(0~100℃,公用)
其它:酸度计(附玻璃电极,甘汞电极)
2、药品
0.2000mol·L-1醋酸HAc标准溶液
四、实验内容
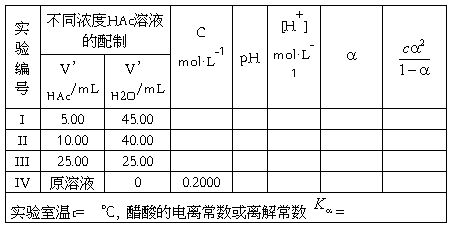
将已标定的HAc标准溶液装盛到烧杯中,用移液管分别取25.00mL 、10.00mL 5.00mL已标定过的HAc溶液于3个50毫升的容量瓶中,注意:接近所要求的放出体积时,应逐滴滴放,以确保精确度和避免过量。用蒸馏水释释至刻度,摇匀,制得C3、C2、C1不同浓度的HAc溶液。配制的HAc溶液的浓度计算后填入下表。
按上述所配制的系列醋酸溶液由稀到浓的顺序,测定各HAc溶液的pH值,记录实验时的室温,算出测定所得不同浓度HAc溶液中的Ac的 值及
值及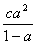 值,取所得
值,取所得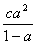 的平均值,即为HAc的电离常数或离解常数
的平均值,即为HAc的电离常数或离解常数 实验值。
实验值。
五、数据记录和处理
第二篇:实验八 醋酸电离度和电离平衡常数的测定
实验八 醋酸电离度和电离平衡常数的测定
一、实验目的
1、测定醋酸电离度和电离平衡常数。
2、学习使用pH计。
3、掌握容量瓶、移液管、滴定管基本操作。
二、实验原理
醋酸是弱电解质,在溶液中存在下列平衡:
HAc H+ + Ac-
H+ + Ac-

式中[ H+]、[ Ac-]、[HAc]分别是H+、 Ac-、HAc的平衡浓度;c为醋酸的起始浓度;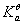 为醋酸的电离平衡常数。通过对已知浓度的醋酸的pH值的测定,按pH=-lg[H+]换算成[H+],根据电离度
为醋酸的电离平衡常数。通过对已知浓度的醋酸的pH值的测定,按pH=-lg[H+]换算成[H+],根据电离度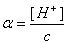 ,计算出电离度α,再代入上式即可求得电离平衡常数
,计算出电离度α,再代入上式即可求得电离平衡常数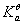 。
。
三、仪器和药品
仪器:移液管(25mL),吸量管(5mL),容量瓶(50mL),烧杯(50mL),锥形瓶(250mL),碱式滴定管,铁架,滴定管夹,吸气橡皮球,Delta320-S pH计。
药品:HAc(约0.2mol·L-1),标准缓冲溶液(pH=6.86,pH=4.00),酚酞指示剂,标准NaOH溶液(约0.2mol·L-1)。
三、实验内容
1.醋酸溶液浓度的标定
用移液管吸取25mL约0.2mol·L-1 HAc溶液三份,分别置于三个250mL锥形瓶中,各加2~3滴酚酞指示剂。分别用标准氢氧化钠溶液滴定至溶液呈现微红色,半分钟不褪色为止,记下所用氢氧化钠溶液的体积。从而求得HAc溶液的精确浓度(四位有效数字)。
2.配制不同浓度的醋酸溶液
用移液管和吸量瓶分别取25mL,5mL,2.5mL已标定过浓度的HAc溶液于三个50mL容量瓶中,用蒸馏水稀释至刻度,摇匀,并求出各份稀释后的醋酸溶液精确浓度(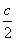 ,
,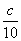 ,
, )的值(四位有效数字)。
)的值(四位有效数字)。
3.测定醋酸溶液的pH值
用四个干燥的50mL烧杯分别取30~40mL上述三种浓度的醋酸溶液及未经稀释的HAc溶液,由稀到浓分别用pH计测定它们的pH值(三位有效数字),并纪录室温。
4.计算电离度与电离平衡常数
根据四种醋酸的浓度pH值计算电离度与电离平衡常数。
五、数据纪录和结果
1.醋酸溶液浓度的标定

2.醋酸溶液的pH值测定及平衡常数、电离度的计算 t = ℃
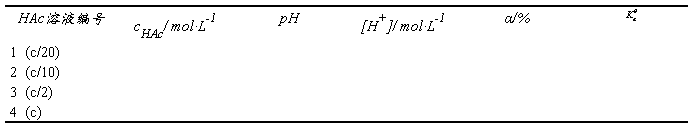
六、预习要求及思考题
1.预习要求
(1)认真预习电离平衡常数与电离度的计算方法,以及影响弱酸电离平衡常数与电离度的因素。
(2)pH计的型号不同使用方法也略有区别,使用前应认真预习,熟悉实验所用型号的pH计的使用方法。
2.思考题
(1)标定醋酸浓度时,可否用甲基橙作指示剂?为什么?
(2)当醋酸溶液浓度变小时,[H+]、α如何变化?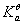 值是否随醋酸溶液浓度变化而变化?
值是否随醋酸溶液浓度变化而变化?
(3)如果改变所测溶液的温度,则电离度和电离常数有无变化?
