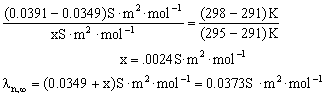实验十九醋酸解离度、解离常数的测定
一、预习思考
1.两种方法测定HAc解离度和解离常数的原理有何不同?
2.计算中数字的有效数字位数有什么规则?
二、实验目的
1.了解用pH法和电导率法测定醋酸解离度和解离常数的原理和方法。
2.加深对弱电解质解离平衡的理解。
3.学习pH计和电导率仪的使用方法,练习使用移液管。
三、实验原理
醋酸是弱酸,即弱电解质,它在溶液中存在下列解离平衡:

或简写为

其解离常数为
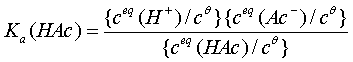 (6-5-1)
(6-5-1)
如果HAc的起始浓度为c0,其解离度为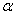 ,由于
,由于 =
=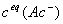 = c0
= c0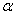 ,带入上式(6-5-1),得:
,带入上式(6-5-1),得:
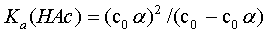
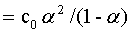 (6-5-2)
(6-5-2)
某一弱电解质的解离常数Ka仅与温度有关,而与该弱电解质溶液的浓度无关;其解离度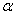 则随着溶液浓度的降低而增大,本实验采用两种方法。
则随着溶液浓度的降低而增大,本实验采用两种方法。
1.pH值法测定醋酸的解离度和解离常数
在一定温度下,用 pH 计 ( 酸度计 )测得一系列已知不同浓度的醋酸溶液的 pH 值,根据 pH= - lg c(H + ) ,换算出各不同浓度醋酸溶液中的 c(H + ) ;再根据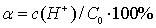 ,可求得各不同浓度醋酸溶液的解离度
,可求得各不同浓度醋酸溶液的解离度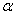 值;最后根据公式(6-5-2)
值;最后根据公式(6-5-2)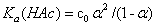 ,求得一系列对应的解离常数 Ka(HAc)值,取其平均值,即为该温度下的醋酸解离常数值。
,求得一系列对应的解离常数 Ka(HAc)值,取其平均值,即为该温度下的醋酸解离常数值。
2. 电导率法测定醋酸的解离度和解离常数
电解质溶液是离子电导体,在一定温度时,电解质溶液的电导(电阻的倒数)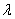 为
为
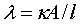 (6-5-3)
(6-5-3)
式中: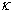 为电导率(电阻率的倒数),表示长度
为电导率(电阻率的倒数),表示长度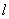 为1m、截面积A为1m2导体的电导,单位为S·m -1,电导的单位为S(西门子)。为了便于比较不同溶质的溶液电导,常采用摩尔电导
为1m、截面积A为1m2导体的电导,单位为S·m -1,电导的单位为S(西门子)。为了便于比较不同溶质的溶液电导,常采用摩尔电导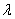 m 。摩尔电导表示在相距1cm的两平行电极之间,放置含有1单位物质的量电解质的电导,其数值等于电导率
m 。摩尔电导表示在相距1cm的两平行电极之间,放置含有1单位物质的量电解质的电导,其数值等于电导率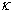 乘以此溶液的全部体积。若溶液的浓度为c(mol·L -1),则含有1单位物质的量电解质的溶液体积V=10-3/ c(m3·mol -1),溶液的摩尔电导为:
乘以此溶液的全部体积。若溶液的浓度为c(mol·L -1),则含有1单位物质的量电解质的溶液体积V=10-3/ c(m3·mol -1),溶液的摩尔电导为:
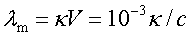 (6-5-4)
(6-5-4)
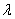 m的单位为S·m2·mol-1 。
m的单位为S·m2·mol-1 。
由公式(6-5-2)可知,弱电解质溶液的浓度c越小,弱电解质的解离度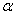 越大,无限稀释时弱电解质也可看作是完全解离的,即此时的
越大,无限稀释时弱电解质也可看作是完全解离的,即此时的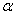 =100%。从而可知,一定温度下,某浓度c的摩尔电导率
=100%。从而可知,一定温度下,某浓度c的摩尔电导率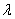 m与无限稀释时的摩尔电导率
m与无限稀释时的摩尔电导率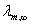 之比,即为该弱电解质的解离度:
之比,即为该弱电解质的解离度:
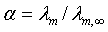 (6-5-5)
(6-5-5)
不同温度时,HAc的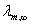 值见表6-5-1。
值见表6-5-1。
表6-5-1不同温度下HAc无限稀释时的摩尔电导率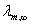

通过电导率仪测定一系列已知起始浓度的HAc溶液的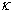 值。根据公式(6-5-4)以及(6-5-5)即可求得对应的解离度
值。根据公式(6-5-4)以及(6-5-5)即可求得对应的解离度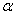 。若将公式(6-5-5)代入公式(6-5-2),可得:
。若将公式(6-5-5)代入公式(6-5-2),可得:
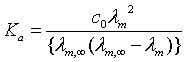 (6-5-6)
(6-5-6)
根据公式(6-5-6)即可求得HAc的解离常数Ka 。
四、仪器与试剂
1.仪器:洗瓶(1 个),移液管 (20mL,1 支),小烧杯 (50 mL,6 只),移液管架(1 只),洗耳球,酸度计(1 台),温度计 (0~100 ℃,1 支)。
2.试剂:HAc(0.1mol · L-1) ,pH=4.00 的标准缓冲溶液(邻苯二甲酸氢钾)。
五、实验步骤
1. pH 值法测定醋酸解离常数
(1)取5只洗净烘干的 50mL 小烧杯依次编成 1 # ~5 # 。
(2)从移液管中分别向1 # ,2 #, 3 #,4 #,5 #小烧杯中准确放入48.00,24.00 ,12.00 ,6.00 ,3.00mL已准确标定过的 HAc 标准溶液。
(3)用移液管中分别向1 # ,2 #, 3 #,4 #,5 #小烧杯中准确放入 0.00 ,24.00 ,36.00,42.00,45.00mL的蒸馏水,并将杯中溶液搅混均匀。
(4)用酸度计分别依次测量 5 #~1 # 小烧杯中醋酸溶液的 pH 值,并如实正确记录测定数据(表6-5-2)。
2.电导率法测定醋酸解离常数
(1)取配置好的醋酸溶液,用电导率仪分别依次测量 5 #~1 # 小烧杯中醋酸溶液的电导率的值,并如实正确记录测定数据(表6-5-3)。
(2)记录实验数据时室温与不同起始浓度时的电导率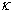 数据。根据表6-5-1的数值,得到实验室温下HAc无限稀释时的摩尔电导率
数据。根据表6-5-1的数值,得到实验室温下HAc无限稀释时的摩尔电导率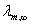 。再按照公式(6-5-4)计算不同起始浓度时的摩尔电导
。再按照公式(6-5-4)计算不同起始浓度时的摩尔电导 。即可由公式(6-5-5)求得各浓度时HAc的解离度
。即可由公式(6-5-5)求得各浓度时HAc的解离度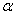 。根据公式(6-5-6)的计算,取平均值,可得到HAc的解离常数Ka 。
。根据公式(6-5-6)的计算,取平均值,可得到HAc的解离常数Ka 。
六、数据记录与处理
1.pH 值法测定醋酸解离常数的数据记录和处理:
醋酸溶液的原始浓度: c(HAc)= 0.09217mol · L -1,实验时室温 =___________℃。
表6-5-2 pH 值法测定醋酸解离常数的数据记录
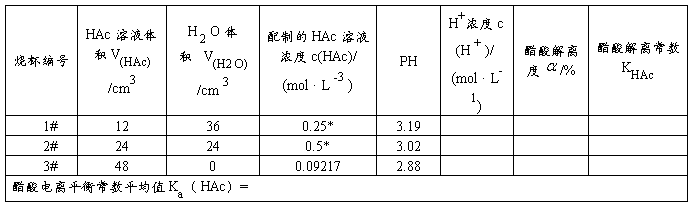
2.电导率法测定醋酸解离常数的数据记录和处理
表6-5-3电导率法测定醋酸解离常数的数据记录
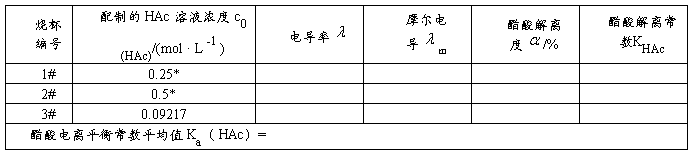
七、注意事项
1.移液管的使用注意事项。
2.pH计和电导率仪使用方法以及注意事项,尤其是电极的清洗。
八、讨论和应用
1.内插法求所需的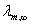 。例如,室温为295K时,HAc无限稀释时的摩尔电导
。例如,室温为295K时,HAc无限稀释时的摩尔电导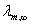 为:
为:
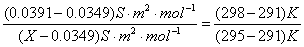
求得X=0.0373 S·m2·mol-1 。
第二篇:实验 醋酸解离度和解离常数的测定
实验 醋酸解离度和解离常数的测定
一、实验目的
1、了解电导率法测定醋酸解离度和解离常数的原理和方法;
2、加深对弱电解质解离平衡的理解;
3、学习电导率仪的使用方法,进一步学习滴定管、移液管的基本操作。
二、提 要
醋酸CH3COOH即HAC,在水中是弱电解质,存在着下列解离平衡:

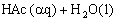
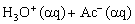
或简写为

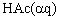

其解离常数为
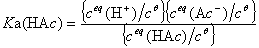 (2.1)
(2.1)
如果HAc的起始溶度为co,其解离度为 ,由于
,由于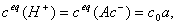 代入式(2.1)得:
代入式(2.1)得:
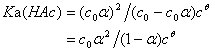 (2.2)
(2.2)
某一弱电解质的解离常数Ka仅与温度有关,而与该弱电解质溶液的浓度无关;其解离度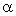 则随溶液浓度的降低而增大 。可以有多种方法用来测定弱电解质的
则随溶液浓度的降低而增大 。可以有多种方法用来测定弱电解质的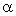 和Ka,本实验采用的方法是用电导率测定HAc的
和Ka,本实验采用的方法是用电导率测定HAc的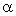 和Ka。
和Ka。
电解质溶液是离子电导体,在一定温度时,电解质溶液的电导(电阻的倒数)λ为 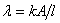 (2.3)
(2.3)
式中,k为电导率(电阻率的倒数),表示长度l为1m、截面积A为1m2导体的电导;单位为S·m-1。电导的单位为S[西(门子)]。
在一定温度下,电解质溶液的电导λ与溶质的性质及其溶度c有关。为了便于比较不同溶质的溶液的电导,常采用摩尔电导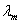 。它表示在相距1cm的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率k乘以此溶液的全部体积。若溶液的浓度为
。它表示在相距1cm的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率k乘以此溶液的全部体积。若溶液的浓度为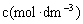 ,于是溶液的摩尔电导为
,于是溶液的摩尔电导为
 (2.4)
(2.4)
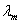 的单位为
的单位为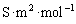 。
。
根据式(2.2),弱电解质溶液的溶度c越小,弱电解质的解离度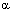 越大,无限稀释时弱电解质也可看作是完全解离的,即此时的
越大,无限稀释时弱电解质也可看作是完全解离的,即此时的 。从而可知,一定温度下,某浓度c的摩尔电导
。从而可知,一定温度下,某浓度c的摩尔电导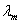 与无限稀释时的摩尔电导
与无限稀释时的摩尔电导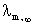 之比,即为该弱电解 质的解离度:
之比,即为该弱电解 质的解离度: 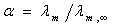 (2.5)
(2.5)
不同温度时,HAc的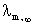 值中表 2.1所示。
值中表 2.1所示。
表2.1 不同温度下HAc无限稀释时的摩尔电导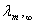

藉电导率仪测定一系列已知起始浓度的HAc溶液的k值。根据式(2.4)及式(2.5)即可求得所对应的解离度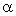 。若将式(2.5)代入式(2.2),可得:
。若将式(2.5)代入式(2.2),可得:
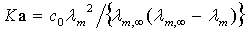 (2.6)
(2.6)
根据式(2.6),可求得HAc的解离常数K 。
。
三、仪器和药品
1、仪器
常用仪器:烧杯(100cm3,5只) 锥形瓶(250cm3,2只) 铁架 移液管(25cm3,3支) 吸气橡皮球 滴定管(玻璃塞式;简易式) 滴定管夹白瓷板 洗瓶 玻璃棒 滤纸片 温度计(0~100℃,公用)
其它:pH计(附玻璃电极、甘汞电极) 电导率仪(附铂黑电导电极)
2、药品
醋酸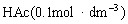
标准氢氧化钠NaOH(0.1mol·dm-3,4位有效数字)
邻苯二甲酸氢钾
酚酞(1%)
四、仪器使用方法(见化学实验的精密仪器——电导率仪)
五、实验内容
(一)醋酸溶液浓度的标定
用移液管(有哪些应注意之处?参见基本操作五中的移液管的使用)量取2份25.00cm30.1mol·dm3HAc溶液,分别注入2只锥形瓶中,各加2滴酚酞溶液。
分别用标准NaOH溶液滴定到溶液显浅红色,半分钟内不褪色即为终点,计算滴定所用的标准NaOH溶液的体积,从而求得HAc溶液的准确浓度。
重复上述实验,求出两次测定HAc溶液浓度的平均值。
(二)系列醋酸溶液的电导率的测定
用移液管(有哪些应注意之处?参见基本操作五中的移液管的使用)量取25.00cm3已标定的HAc溶液置于烧杯中,另用移液管量取25.00cm3去离子水与上述HAc溶液混合。用玻璃棒搅拌均匀。按电导率仪中的操作步骤,使用铂黑电导电极,将高低周开关拨到“低周”,测定所配制的HAc溶液的电导率。
随后,用移液管从已测定过电导率的溶液中取出25.00cm3,并弃去;再用另一支移液管加入25.00cm3去离子水[1][注1],搅拌均匀,测定此稀释后HAc溶液的电导率。如此不断稀释,测定电导率共4~6次。
记录实验时室温与不同起始浓度时的电导率k数据。根据表2.1的数值,得到实验室温下HAc无限稀释时的摩尔电导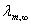 [2][注2]。再按式(2.4)计算不同超始浓度时的摩尔电导
[2][注2]。再按式(2.4)计算不同超始浓度时的摩尔电导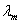 。即可由式(2.5)求得各浓度时HAc的解离度
。即可由式(2.5)求得各浓度时HAc的解离度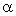 。根据式(2.2)或式(2.6)的计算,取平均值,可得HAc的解离常数Ka。
。根据式(2.2)或式(2.6)的计算,取平均值,可得HAc的解离常数Ka。
六、数据记录和处理
(1)醋酸溶液浓度的标定 表一

(2)醋酸溶液的电导率、醋酸的解离度和解离常数的测定 表二

七、预习要求
1、了解两种不同方法测定HAc解离度和解离常数的原理。
2、预习实验及计算中的有效数字。
3、预习基本操作五中的容量瓶、滴定管的使用以及精密仪器四(电导率仪)。
八、附录:测定醋酸解离度和解离常数的另外两个方法
方法一:pH法测定HAc的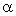 和Ka
和Ka
(一)原理
在一定温度下,用pH计(又称为酸度计)测定一系列已知溶液的HAc溶液的pH值,按pH= 。根据
。根据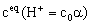 ,即可求得一系列对应的HAc的解离度
,即可求得一系列对应的HAc的解离度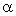 和
和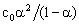 值。这一系列
值。这一系列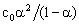 值应近似为一常数,取其平均值,即为该温度时HAc的解离常数Ka。
值应近似为一常数,取其平均值,即为该温度时HAc的解离常数Ka。
(二)方法
1、醋酸溶液浓度的标定(同电导率法的标定)
2、系列醋酸溶液的配制和pH值的测定
将上述已标定的HAc溶液装盛到玻璃塞式滴定管中,并从滴定管中分别放出48.00cm3、24.00cm3、12.00cm3、6.00cm3、3.00cm3该HAc溶液于5只干燥的烧杯(为什么需要干燥的?)中。注意:接近所要求的放出体积时,应逐滴滴放,以确保准确度和避免过量。藉另一支盛有去离子水的滴定管,往后面4只烧杯中分别加入24.00cm3、36.00cm3、42.00cm3、45.00cm3去离子水,使各烧杯中的溶液总体积均为48.00cm3,混合均匀。
按上述所配制的系列醋酸溶液由稀到浓的顺序,并按精密仪器四中的pH计中的操作步骤分别测定各HAc溶液的pH值。记录实验时的室温,算出不同起始浓度HAc溶液的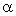 值及
值及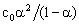 值。取所得
值。取所得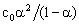 的平均值,即为HAc的解离常数Ka实验值。
的平均值,即为HAc的解离常数Ka实验值。
3、数据记录和处理
(1)醋酸溶液浓度的标定(同表一)
(2)醋酸溶液的pH值、醋酸的解离度和解离常数的测定
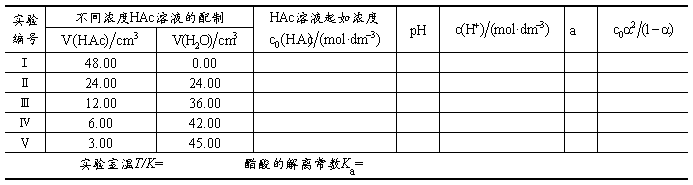
方法二:缓冲溶液法测定HAc的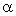 和Ka
和Ka
(一)原理
根据缓冲溶液的计算公式
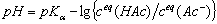 (1)
(1)
若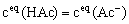 ,则上式简化为
,则上式简化为
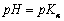
由于
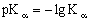 (2)
(2)
因而如果将HAc溶液分为体积相等的两部分,其中一部分溶液用NaOH溶液滴定至终点(此时HAc即几乎完全转化为Ac—),再与另一部分溶液混合,并测定该混合溶液(即缓冲溶液)的pH值,即可得到HAc的解离常数。测定时无需知道HAc和NaOH溶液的浓度。
(二)方法
1、等浓度的醋酸和醋酸钠缓冲溶液的配制
用称液管量取25.00cm3 0.1mol·dm-3HAc溶液置于锥形瓶中,加入2滴酚酞溶液,用0.1mol·dm-3NaOH溶液滴定至终点。另用移液管量取25,00cm30.1mol·dm-3HAc溶液与上述滴定后的溶液混合,摇荡锥形瓶,使之混合均匀。
2、醋酸和醋酸钠缓冲溶液pH值的测定
取适量上述相互混合的HAc-NaAc溶液置于烧杯中,按pH计的操作步骤测定其pH值。记录实验时室温,计算HAc的解离常数Ka。
重复进行一次,求得两次数据的平均值。
3、数据记录和处理
实验时室温T/K
HAc-NaAc混合溶液的pH值 ;
HAc-NaAc混合溶液的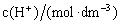 ;
;
HAc的解离常数K ;
;
平均值:
[注1] 为使实验结果不产生较大的误差,本实验所用去离子水的电导率应不大于1.2×10-3S·m-1。
[注2] 若室温不同于表2.1中所列温度,可用内插法近似求得所需的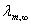 值。例如,室温为295K时,HAc无限稀释时的摩尔电导
值。例如,室温为295K时,HAc无限稀释时的摩尔电导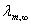 为
为