实验一 分析天平称量练习
[实验目的]
1.学习分析化学中试剂的称量方法。
2.掌握准确、简明、规范地记录实验原始数据的方法。
[实验原理]
1.电子天平的构造
电子天平是最新一代的天平,是根据电磁力平衡原理,直接称量,全量程不需砝码。放上称量物后,在几秒钟内即达到平衡,显示读数,称量速度快,精度高。电子天平的支承点用弹性簧片,取代机械天平的玛瑙刀口,用差动变压器取代升降枢装置,用数字显示代替指针刻度式。
2.电子天平的使用方法
(1)水平调节。观察水平仪,如水平仪水泡偏移,需调整水平调节脚,使水泡位于水平仪中心。
(2)预热。接通电源,预热至规定时间后,开启显示器进行操作。
(3)开启显示器。轻按ON键,显示器全亮,待出现称量模式0.0000 g后即可称量,读数时应关上天平门。
(4)校准。天平安装后,第一次使用前,应对天平进行校准。因存放时间较长、位置移动、环境变化或未获得精确测量,天平在使用前一般都应进行校准操作。一般采用外校准(有的电子天平具有内校准功能)完成。
(6)称量。按清零键,显示为零后,置称量物于称盘上,关上天平门,待数字稳定后,即可读出称量物的质量值。
(7)去皮称量。按清零键,置容器于称盘上,天平显示容器质量,再按清零键,显示零,即去除皮重。再置称量物于容器中,或将称量物(粉末状物或液体)逐步加入容器中直至达到所需质量,待数字稳定,这时显示的是称量物的净质量。将称盘上的所有物品拿开后,天平显示负值,按清零键,天平显示0.0000 g。若称量过程中称盘上的总质量超过最大载荷时,天平仅显示上部线段,此时应立即减小载荷。
(8)称量结束后,若较短时间内还使用天平(或其他人还使用天平)一般不用按OFF键关闭显示器。实验全部结束后,关闭显示器,切断电源,若短时间内(例如2 h内)还使用天平,可不必切断电源,再用时可省去预热时间。
若当天不再使用天平,应拔下电源插头。
3.称量方法
常用的称量方法有直接称量法、固定质量称量法和递减称量法,现分别介绍如下。
(1)直接称量法
直接称量法只能称量能直接放在天平上的物品,如小烧杯、蒸发皿、坩埚等。
(2)固定质量称量法
此法又称增量法,用于称量需要某一固定质量的试剂或试样。这种称量操作的速度很慢,适于称量不易吸潮、在空气中能稳定存在的粉末状或小颗粒(最小颗粒应小于0.1 mg,以便容易调节其质量)样品。
固定质量称量法如图2-3所示。注意:若不慎加入试剂超过指定质量,应用牛角匙取出多余试剂。重复上述操作,直至试剂质量符合指定要求为止。严格要求时,取出的多余试剂应弃去,不要放回原试剂瓶中。操作时不能将试剂散落于天平盘等容器以外的地方,称好的试剂必须定量地由表面皿或称量纸等容器直接转入接受容器,此即所谓“定量转移”。

图2-3 固定质量称量法 图2-4递减称量法
(3)减量法
又称递减称量法或差减称量法,如图2-4所示,此法用于称量一定质量范围的样品或试剂。在称量过程中样品易吸水、易氧化或易与CO2等反应时,可选择此法。由于称取试样的质量是由两次称量之差求得,故也称差减法。减量法称量步骤如下:
①从干燥器中用纸带(或纸片)夹住称量瓶后取出称量瓶(注意:不要让手指直接触及称瓶和瓶盖)。
②用纸片夹住称量瓶盖柄,打开瓶盖,加入适量待称量样品或试剂(一般为称一份样品量的整数倍),盖上瓶盖。
③归零后,打开天平门,将称量瓶放在天平盘中央,关上天平门,读出称量瓶加试样后的准确质量m1。
④将称量瓶从天平上取出,在接收容器的上方倾斜瓶身,用称量瓶盖轻敲瓶口上部使试样慢慢落入容器中,瓶盖始终不要离开接受器上方。
⑤当倾出的试样接近所需量(可从体积上估计或试重得知)时,一边继续用瓶盖轻敲瓶口,一边逐渐将瓶身竖直,使粘附在瓶口上的试样落回称量瓶,然后盖好瓶盖,放回天平准确称其质量m2。两次质量之差(m1-m2),即为试样的质量m。有时一次很难得到合乎质量范围要求的试样,可重复上述称量操作1~2次。
⑥按上述方法连续递减,可称量多份试样。
[试剂与仪器]:
CuSO4﹒5H2O
称量瓶,瓷坩埚
电子天平:220g/0.0001g(万分之一);150g/0.01(百分之一)
[实验步骤]
①、取两个瓷坩埚,在电子天平上称准至0.1mg,记录为m0和m0’
②、取一个装有足够试样的洁净、干燥的称量瓶,在电子天平上粗略称量其质量,然后加入约1g CuSO4﹒5H2O;在分析天平上精确称量盛有CuSO4﹒5H2O的称量瓶,记录为m1;用瓶盖轻敲瓶口上沿,转移出0.3-0.4g样品至第一个坩埚中,估计倾出的样品已足够量时,再边敲瓶口,边扶正瓶身;盖好瓶盖后方可将称量瓶移开容器上方,准确称量并记录称量瓶的剩余量m2。以同样的方法再转移出0.3-0.4g样品,称量并记录称量瓶的剩余质量m 2。
③、分别精确称量两个盛有CuSO4﹒5H2O的瓷坩埚,记录其质量为m1’和m2’
参照下表的格式记录实验数据并计算实验结果。
表1.称量练习记录格式示例

要求:相对偏差小于等于千分之五。
[注意事项]
1.电子天平属精密仪器,使用时注意细心操作。
2.称量时须细心将样品或试剂置入承受器皿中,不得洒在天平上。若发生了上述错误,当事人必须按要求处理好,以免玷污和腐蚀仪器,并报告实验指导教师。
3.实验数据要记在实验本上,不能随意记在纸片上。
实验二 酸碱滴定实验
[实验目的]
1. 练习酸碱滴定的基本操作
2. 学习和掌握酸碱滴定终点的判断方法
[实验原理]
滴定分析是将一种已知准确浓度的标准溶液滴加到被测试样的溶液中,直到化学反应完全为止,然后根据标准溶液的浓度和体积求得被测试样中组份含量的一种方法。在进行滴定分析时,一方面要会配制滴定剂溶液并能准确测定其浓度;另一方面要准确测量滴定过程中所消耗滴定剂的体积。为止,安排了此基本操作实验。
滴定分析包括酸碱滴定法、氧化还原滴定法、沉淀滴定法和络合滴定法。本实验主要是以酸碱滴定法中酸碱滴定剂标准溶液的配制和测量滴定剂体积消耗为例,来练习滴定分析的基本操作。
酸碱滴定中常用盐酸和氢氧化钠溶液作为滴定剂,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水分和二氧化碳,故此滴定剂无法直接配制准确,只能先配制近似浓度的溶液,然后用基准物质标定其浓度。
强酸HCl与强碱NaOH溶液的滴定反应,突跃范围pH约为4~10,在这一范围中可采用甲基橙(变色范围pH3.1-4.4),甲基红(变色范围pH4.4-6.2)、酚酞(变色范围pH8.0-9.6)、百里酚蓝和甲酚红钠盐水溶液(变色点的pH为8.3)等指示剂来指示终点。为了严格训练学生的滴定分析基本操作,选用甲基橙、酚酞二种指示剂,通过盐酸与氢氧化钠溶液体积比的测定,学会配制酸碱滴定剂溶液的方法与检测滴定终点的方法。
[实验试剂]:
1、0.1mol/L NaOH 1000mL
2、0.1mol/L HCl 1000mL
3、酚酞 0.2%水溶液
4、甲基橙 0.2%水溶液
5、甲基红+溴甲酚绿溶液 0.2%水溶液
[实验步骤]
1、用0.1mol/L NaOH溶液润洗碱式滴定管2-3次,每次用5-10 mL 溶液润洗。然后将滴定剂倒入碱式滴定管中,滴定管液面调节至0.00刻度。
2、用0.1mol/L 盐酸溶液润洗酸式滴定管2-3次,每次用5-10 mL 溶液润洗。然后将盐酸溶液倒入酸式滴定管中,滴定管液面调节至0.00刻度。
3、酸碱滴定管的操作: 由碱式滴定管中放NaOH溶液10-15mL于锥瓶中,放出时以每分钟约10ml的速度,即每秒钟滴入3-4滴溶液,再加1-2滴甲基橙指示剂,用0.1mol/L 盐酸溶液滴定至溶液由黄色转变为橙色。由碱式滴定管中再滴入少量NaOH溶液,此时锥瓶中溶液由橙色又转变为黄色,再由酸式滴定管中滴入HCl溶液,直至被滴定溶液由黄色又转变为橙色,即为终点,如此反复练习3~5次。
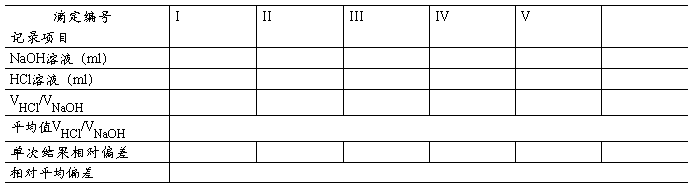
4、由碱式滴定管准确放出NaOH溶液10.00毫升于锥瓶中,加入1-2滴甲基橙指示剂,用0.1 mol/L HCl溶液滴定溶液由黄色恰变为橙色。平行测定三份,数据按表记录,所测VHCl/VNaOH体积的相对极差%在±1%范围内,才算合格。
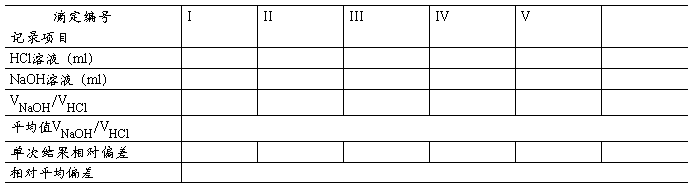
5、用移液管吸取10.00毫升0.1 mol/L HCl溶液于锥瓶中,加2-3滴酚酞指示剂,用0.1 mol/L NaOH溶液滴定溶液呈微红色,此红色保持30秒钟不褪色即为终点。如此平行测定三份,所测VNaOH/VHCl体积的相对极差%在±1%范围内,才算合格。
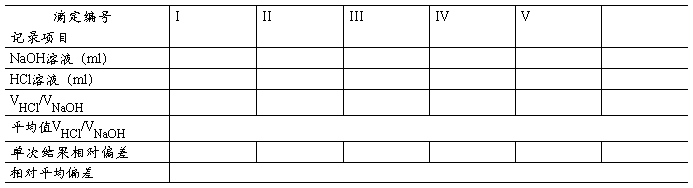
6、由碱式滴定管准确放出NaOH溶液10.00毫升于锥瓶中,加入1-2滴甲基红+溴甲酚绿混合指示剂,用0.1mol/L HCl溶液滴定溶液由绿色经灰色变为红色。平行测定三份,数据按表记录,所测VHCl/VNaOH体积的相对极差%在±1%范围内才算合格。
(注:相对极差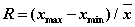 )
)
要求:三个分实验中至少一个实验满足相对极差在±1%范围内。
[结果记录]
1、HCl溶液滴定NaOH溶液(实验步骤为4,指示剂为甲基橙)
2、NaOH溶液滴定HCl溶液(实验步骤为5,指示剂为酚酞)
3. HCl溶液滴定NaOH溶液(实验步骤为6,指示剂为甲基红+溴甲酚绿)
[注意事项]
酸式滴定管和碱式滴定管的使用方法。
第二篇:化学分析实验部分思考题

化学分析实验课讲稿
单 位:药科学院
教研室:分析化学教研室
教 师:范华均
20##年9月
实验三 HCl标准溶液的配制和标定思考题
1. 滴定分析用玻璃器皿洗涤的要求是什么?为什么要达到这一要求?
答:玻璃器皿应洁净透明,不挂水珠,内外壁为水均匀润湿,以保证器皿彻底干净,不残留其它杂质。
2. 使用铬酸洗液应注意什么问题?为什么?
答:有腐蚀性,切勿洒在皮肤、衣物上,用过的仍倒回储液瓶中,可继续使用直至变绿失效为止。勿倒入水槽,废液也应回收处理,保护环境。
3. 使用移液管、吸量管应注意什么?留在管内的最后一点溶液是否吹出?
答:洗涤用铬酸洗液、蒸馏水、移取液润洗三次,以除去残留的水分。留在管尖的最后一点溶液不用吹出(除非管上表明“吹”字),在校正移液管时,未将这部分溶液体积计算在内。使用后,应立即洗净放在移液管架上。
实验四 药用硼砂的测定思考题
1、硼砂是强碱弱酸盐,可用盐酸标准溶液直接滴定,醋酸钠也是强碱弱酸盐,是否能用盐酸标准溶液直接滴定?
答:不可以。硼酸为弱酸其Ka为5.4×10-10,则相应的共轭碱H2BO3-,Kb为1.8×10-5,设浓度为0.1 mol/L,则CbKb >10-8,可以用HCl溶液直接滴定;而Ac-的Kb=5.6×10-10,CbKb <10-8,故不能用HCl溶液直接滴定。
2、Na2B4O7.10H2O用HCl标准溶液(0.2 mol/L)滴定至计量点时的pH值是多少?
答:由 Na2B4O7 + 2HCl → 4H3BO3 = 4H3BO3 + 2NaCl
设Na2B4O7.10H2O的浓度为0.1 mol/L,体积为20 mL,则生成的硼酸浓度为
C = 0.1×20×4/(20+20)= 0.2 mol/L
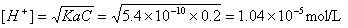
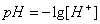 pH=4.98
pH=4.98
注:学生也可以根据实验硼砂的称样量进行计算。
3、答:偏高,根据Na2B4O7.10H2O百分质量数的计算式:
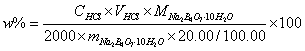
若Na2B4O7.10H2O部分风化失去结晶水,则称取同样质量的硼砂样品将使VHCl增大,从而百分质量数增加。
实验五 混合碱的测定思考题
2.答:纯碱中Na2CO3和 NaHCO3的测定——双指示剂法

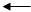

 加入酚酞
加入酚酞


 V1 HCl
V1 HCl




 酚酞变色
酚酞变色

 V 加入甲基橙
V 加入甲基橙
V2 HCl


 甲基橙变色
甲基橙变色
由此可推得:
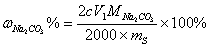
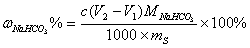
3.答:
V1 和 V2 的变化 试样的组成(以活性离子表示)

V1 ¹ 0, V2 = 0 OH-
V1 =0, V2 ¹ 0 HCO3-
V1 =V2 ¹ 0 CO32-
V1 >V2 > 0 OH- +CO32-
V2 >V1 > 0 HCO3- +CO32-
4.答:
实验六 明矾含量测定思考题
1.能否用EDTA直接滴定进行明矾定量测定?
答:不能。1)明矾中的Al3+与EDTA的配位反应速率缓慢;2)Al3+对XO指示剂有封闭作用;3)酸度不高时,Al3+易水解形成多羟基配合物,故不能直接滴定。
2.为什么要加入六次甲基四胺缓冲液?
答:1)金属离子要完全反应,必须要控制酸度。如果溶液酸度太高,则由于酸效应的影响使滴定反应进行不完全;如果酸度太低,则金属离子会水解产生氢氧化物沉淀,因此有其适宜的滴定酸度;
2)在滴定过程中,形成配合物的同时不断放出H+,使溶液酸度增大;
3)配位滴定使用的金属指示剂都有一定的酸度使用范围限制。因为二甲酚橙(XO)在pH <6.3时呈黄色,反应必须在pH4~6范围进行。
在上述情况下都会影响反应的完全程度和滴定结果的准确度,因此常常加入缓冲溶液来控制溶液酸度。
3.此滴定能用铬黑T指示剂吗?
答:不能。1)Al3+能封闭铬黑T:铬黑T与Al3+生成的配合物非常稳定,滴定终点发生指示剂封闭作用。2)铬黑T的适宜pH范围:9~10,在该条件下Al3+易形成多羟基配合物,与该反应剩余滴定pH5~6的条件不符。
4.答: M + H2Y = MY + H+,反应中有H+不断生成,溶液的pH会下降,影响反应的稳定常数,pH <4,则配位反应不完全,pH >6.3则溶液呈XO的橙红色,pH>7,Al3+易水解形成多羟基配合物,如Al(OH)3,会影响终点判断。
实验七 硫代硫酸钠标准溶液的配制与标定思考题
1.影响Na2S2O3溶液稳定性的因素有那些?如何配制Na2S2O3标准溶液?
答:空气中的CO2: 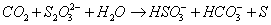
水中的嗜硫微生物:
空气中的O2: 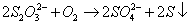
2.用K2Cr2O7作基准物标定Na2S2O3溶液时为什么要在一定的酸度范围进行,酸度过高或过低有何影响?在第一步反应中,如何(1)加KI溶液而不加HCl溶液,(2)加酸后不放置暗处,(3)不放置或放置一定时间即加水稀释,会产生什么影响?
答:必须维持一定的酸度,第一步反应慢,增加溶液的酸度,反应速度加快,但酸度太强又使I–被空气中的O2氧化为I2。
(1)不加HCl,反应速度慢,甚至不反应;
(2)不放置暗处,先会加速I–被空气中的O2氧化为I2,使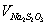 偏高,
偏高, 偏低;
偏低;
(3)致使第一步反应不完全,生成的I2偏低, 偏高。
偏高。
3.为什么在滴定至接近终点时才加入淀粉指示剂?过早加入会出现什么现象?
答:大量I2被淀粉牢固地吸附,不易完全放出,使终点难以观察,提前终点。
