宁波工程学院
物理化学实验报告
实验名称 电导的测定及应用
一、实验目的
1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率;
2、用电导法测量醋酸在水溶液中的解离平衡常数;
3、掌握恒水温水槽及电导率仪的使用方法。
二、实验原理
1、电解质溶液的导电能力通常用电导G来表示,若将电解质溶液放入两平行电极之间,设电极的面积为A,两电极的间的距离为l,则溶液的电导G为:
G = к(A / l) (1)
由于电极的l和A不易精确测量,因此在实验中用一种已知电导率的溶液先求出电导池的常数Kcell,然后再把欲测的的溶液放入该电导池中测出其电导值,在根据上式求出其电导率。
摩尔电导率与电导率的关系:
Λm=K/C (2)
2、Λm总是随着溶液的浓度的降低而增大的。对强电解质稀溶液而言,其变化规律可以用科尔劳施经验公式表示:
Λm=Λ∞m -A√C (3)
对特定的电解质和溶剂来说,在一定温度下,是一个常数。所以,将Λm对√C作图得到的直线外推至C=0处,可求得。
3、对于弱电解质溶液来说,其Λm无法利用上式通过实验直接测定。但是,在弱电解质的稀薄溶液中,离子的浓度很低,离子的浓度很低,离子间的相互作用可以忽略,也可以认为它在C浓度时的解离度等于它的摩尔电导率Λm与其无限稀释摩尔电导率之比,即:
α=Λm/Λ∞m (4)
对于HAc,在溶液中电离达到平衡时,电离平衡常数Kc与原始浓度C和电离度α有以下关系:
HAc H+ + Ac-
t=0 C 0 0
t=t平衡 C(1-α) Cα Cα
K0= Cα2/[C0(1-α)] (5)
在一定温度下K0是常数,因此可以通过测定HAc在不同浓度时的代入(5)式中求出Kc。综合可得出关系:
K0= CΛ2m/ [C0Λ∞m(Λ∞m-Λm)]
或CΛm=(Λ∞m)2K0 C0(1/Λm)-Λ∞m K0 C0
以CΛm对1/Λm作图,其直线的斜率为(Λ∞m)2K0 C0,如知道Λ∞m值,就可算出K0。
三、实验仪器与试剂
仪器:梅特勒电导率仪1台;电导电极1只;量杯(50ml)2只;移液管(25ml)3只;洗瓶1只;洗耳球1只。
试剂:10.00mol/m-3 KCl溶液;100.0mol/m-3HAc溶液;电导水。
四、实验步骤
1、打开电导率仪开关,预热5min。
2、KCl溶液电导率测定:
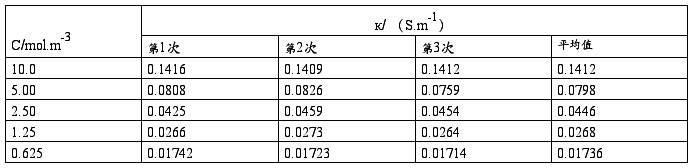
(1)用移液管准确移入10.00(mol.m-3)KCl溶液25.00ml,置于洁净、干燥的量杯中;测定其电导率3次,取平均值。
(2)再用移液管准确移入25.00ml电导水,置于上述量杯中,搅拌均匀后,测定其电导率3次,取平均值。
(3)用移液管准确移出25.00ml上述量杯中的溶液,弃去;再用移液管准确移入25.00ml电导水,置于上述量杯中,搅拌均匀后,测定其电导率3次,取平均值。
(4)重复的(3)步骤。
(5)重复的(3)步骤。
(6)倾去电导池中的KCl溶液,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
3、HAc溶液和电导水的电导率测定:
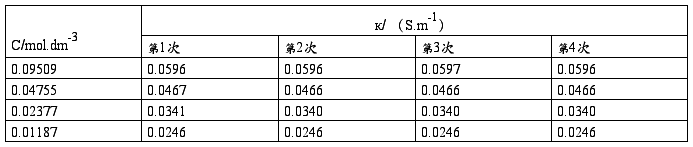
(1)用移液管准确移入100.0(mol.m-3)HAc溶液25.00ml,置于洁净、干燥的量杯中;测定其电导率3次,取平均值。
(2)再用移液管准确移入25.00ml已恒温的电导水,置于上述量杯中,搅拌均匀后,测定其电导率3次,取平均值。
(3)用移液管准确移出25.00ml上述量杯中的溶液,弃去;再用移液管准确移入25.00ml电导水,置于上述量杯中,搅拌均匀后,测定其电导率3次,取平均值。
(4)再用移液管准确移入25.00ml电导水,置于上述量杯中,搅拌均匀后,测定其电导率3次,取平均值。
(5)倾去电导池中的HAc溶液,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
(6)倾去电导池中的电导水,量杯放回烘箱;电极用滤纸吸干,关闭电源。
五、数据记录与处理
1、数据记录
大气压:101.62KPa ; 室温:22.6℃ ; 实验温度:20.4℃ 。
已知数据:25℃下10.00 (mol.m-3) KCl溶液电导率=0.1413 S. m-1;25℃时无限稀释的HAc水溶液的摩尔电导率=3.907*10-2(S.m2.mol-1)。
(1) 测定KCl溶液的电导率:
(2)测定HAc溶液的电导率:
电导水的电导率к(H2O)/ (S.m-1)= 0.00806
2、数据处理:
(1)将KCl溶液的各组数据填入下表内:
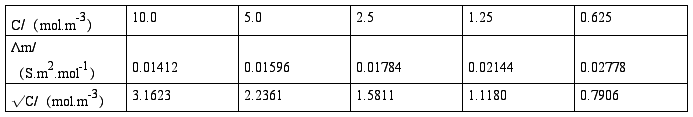
以KCl溶液的Λm对√C作图,由直线的截距求出KCl的Λ∞m。
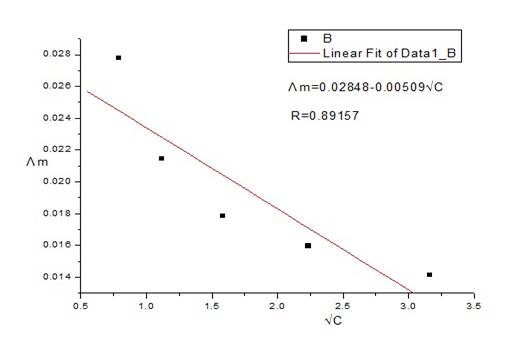
由图可知:当√C=0时,Λm=Λ∞m=0.02848
即KCl溶液在无限稀释时的极度摩尔电导率的Λ∞m为0.02848S.m2.mol-1。
(2)HAc溶液的各组数据填入下表内:
HAc溶液原始浓度:0.09509 mol.dm-3
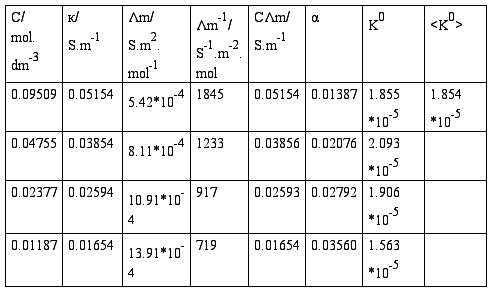
注:к=к-к(H2O)
以CΛm对1/Λm作图应得一直线,直线的斜率为(Λ∞m)2K0 C0 :
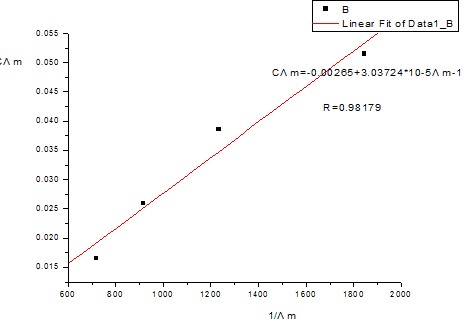
根据上图可知,该直线的斜率为3.03724*10-5。
即(Λ∞m)2Kθ Cθ=3.03724*10-5。
已知Λ∞m =3.907*10-2S.m2.mol-1,
则Kθ=3.03724*10-5/[(Λ∞m)2C0]= 3.03724*10-5/[(3.907*10-2)2*1000]
=1.990*10-5
拟合获得的Kθ值,与表格计算的与<Kθ>=1.854*10-5作比较,
误差=(Kθ-<Kθ>)/<Kθ>*100%
=(1.990*10-5-1.854*10-5)/(1.854*10-5)*100%
=7.34%
六、注意事项
1、换待测液测定前,必须将电导电极和电导池洗净、擦干,以免影响测定结果。
七、结果与讨论
1、溶液配制时时由大浓度向小浓度稀释的。一旦某上一浓度出现偏差,则将影响到后面的浓度,因此在稀释时要及其小心,这也是影响实验准确性的一个很重要的因素。
2、对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶液浓度
的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。
对弱电解质而言,溶液浓度降低时,摩尔电导率也增加。在溶液极稀时,随
着溶液浓度的降低,摩尔电导率急剧增加。
3、电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度有关。
因为电解质溶液的电导与温度有关,温度的变化会导致电导的变化。实验中测电导池常数和溶液电导时的温度不需要一致,因为电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
八、思考题
1、如果配制HAc溶液的水不纯,将对结果产生什么影响?
答:对测定结果不准,会产生误差。如果配制HAc溶液的水不纯,HAc溶液的实际浓度会偏大,测得的Kθ值偏小。
第二篇:电导的测定及其应用
物 理 化 学 实 验 报 告
实 验 名 称: 电导的测定及其应用
学 院: 化学工程学院
专 业: 化学工程与工艺
班 级:
姓 名:
学 号:
指 导 教 师:
日 期: 2011年 月日
一、实验目的
1. 测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率;
2. 用电导率测量醋酸在水溶液中的解离平衡常数;
3. 掌握恒温水槽及电导率仪的使用方法。
二、实验原理
1.电解质溶液的电导能力通常用电导G来表示,它的单位是西门子,用符号S表示,若将某电解质溶液放入两平行电极之间,设电极间距离为l ,电极面积为A,则电导为:
G=KA / l (2.5.1)
式 (2.5.1) 中,K为该电解质溶液的电导率,其物理意义:在两平行而相距1m,面积均为1 m2的两电极间,电解质溶液的电导称为该溶液的电导率,其单位以SI制表示为S/m;(l/A)为电导池常数,以Kcell表示,单位为m-1。
由于电极的l和A不易精确测量,因此在实验中是用一种已知电导率值的溶液先求出电导池常数Kcell, 然后把欲测溶液放入该电导池测出其电导值,再根据 (2.5.1) 式求出其电导率。
在讨论电解质溶液的导电能力时常用摩尔电导率(Λm)这个物理量。它是指把含有1mol电解质的溶液置于相距为1m的两平行板电极之间的电导。以Λm表示,其单位以SI单位制表示为S·m2/mol-1。
摩尔电导率与电导率的关系:
Λm = K / C (2.5.2)
式(2.5.2)中,C为该溶液浓度,其单位以SI单位制表示为mol · m-3。
2. Λm 总是随着溶液的浓度的降低而增大的。对强电解质稀溶液而言,其变化规律可用科尔劳施经验公式表示:
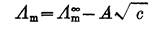 (2.5.3)
(2.5.3)
式(2.5.3)中,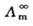 是溶液在无限稀释时的极限摩尔电导率。对特定的电解质和溶剂来说,在一定温度下,A是一个常数。所以,将
是溶液在无限稀释时的极限摩尔电导率。对特定的电解质和溶剂来说,在一定温度下,A是一个常数。所以,将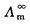 对
对 作图得到的直线外推至C=0处,可求得
作图得到的直线外推至C=0处,可求得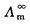 。
。
3. 对于弱电解质溶液来说,其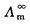 无法利用上式通过实验直接测定。但我们知道,在其无限稀释溶液中,弱电解质的a=1,每种离子对电解质的摩尔电导率都有一定的贡献,是独立移动的,不受其他离子的影响,对电解质MV+AV-来说,即:
无法利用上式通过实验直接测定。但我们知道,在其无限稀释溶液中,弱电解质的a=1,每种离子对电解质的摩尔电导率都有一定的贡献,是独立移动的,不受其他离子的影响,对电解质MV+AV-来说,即:
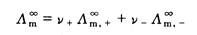 (2.5.4)
(2.5.4)
式(2.5.4)中,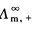 、
、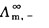 分别表示正、负离子的无限稀释摩尔电导率。它与温度及离子的本性有关。
分别表示正、负离子的无限稀释摩尔电导率。它与温度及离子的本性有关。
在弱电解质的稀薄溶液中,离子的浓度很低,离子间的相互作用可以忽略,可以认为在它浓度C时的解离度a等于它的摩尔电导率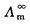 与其无限稀释摩尔电导率之比,即:
与其无限稀释摩尔电导率之比,即:
a=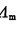 /
/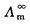 (2.5.5)
(2.5.5)
把(2.5.4)代入(2.5.1)式可得:
 (2.5.6)
(2.5.6)
以C Λm 对 1/Λm 作图,根据其斜率求得K 。
三、实验仪器、试剂
仪器:梅特勒326电导率仪1台;电导电极1只;量杯(50ml)2只;移液管(25ml)9只;洗瓶1只;洗耳球1只
试剂:10.00(mol/m3)KCl溶液; 100.0(mol/m3)HAc溶液;电导水
四、实验步骤
1.打开电导率仪开关,预热5min 。
2.KCl溶液电导率测定;
(1)用移液管准确移入10.00(mol/m3)KCl溶液25.00ml,置于洁净,干燥的量杯中;测定其电导率3次,取平均值。
(2)再用移液管准确移入25.00ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(3)用移液管准确移出25.00ml上述量杯中的溶液,弃去;再用移液管准确移入25.00ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)重复(3)的步骤。
(5)重复(3)的步骤。
(6)倾去电导池中的KCl溶液,用电导水洗净量杯和电极;量杯放回烘箱;电极用滤纸吸干。
3.HAc溶液和电导水的电导率测定;
(1)用移液管准确移入100.0(mol/m3)HAc溶液25.00ml,置于洁净,干燥的量杯中;测定其电导率3次,取平均值。
(2)再用移液管准确移入25.00ml已恒温的电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(3)用移液管准确移出25.00ml上述量杯中的溶液,弃去;再用移液管准确移入25.00ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。
(4)重复(3)的步骤。
(5)倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定其电导率3次,取平均值。
(6)倾去电导池中的电导水;量杯放回烘箱;电极用滤纸吸干。关闭电源。
五、数据记录与处理
1.数据记录:
大气压:100.40KPa; 室温: 27.5℃ ; 实验温度: 21.7℃;
已知数据:25℃下10.00(mol·m-3)KCl溶液电导率 = 0.1413 S·m-1;25℃时无限稀的HAc水溶液的摩尔电导率 = 0.03907(S·m2·mol -1)
(1)测定KCl溶液的电导率
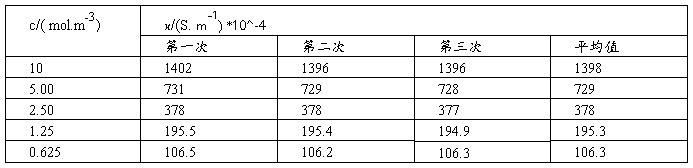
(2)测定HAc溶液的电导率
该条件下电导水的电导率 = 16.7μS/ cm
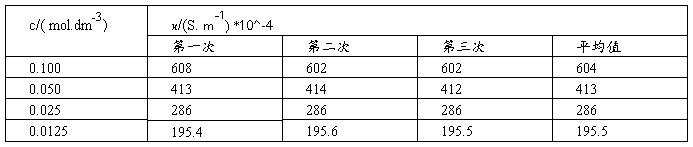
2. 数据处理
(1)将KCl溶液的各组数据填入下表内:
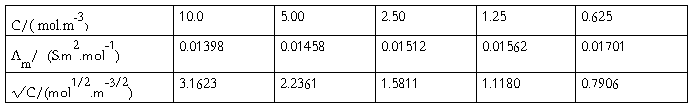
以KCl溶液的Λm对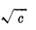 作图,由直线的截距求出KCl的
作图,由直线的截距求出KCl的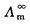
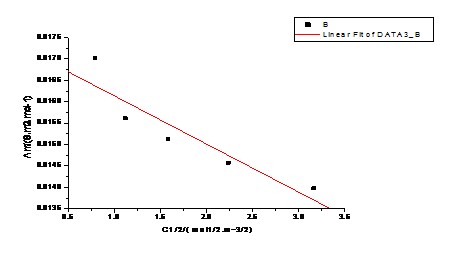
图-1 Λm—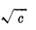 的关系图
的关系图
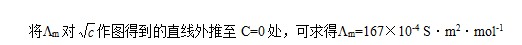
(2)HAc溶液的各组数据

由上表 CΛm对Λm -1作图应得一直线,直线的斜率为(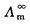 )2 KθCθ
)2 KθCθ
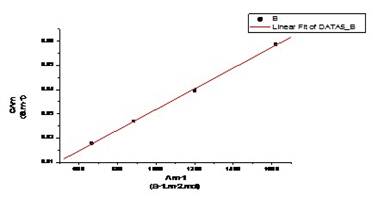
图-2  —
— 的关系图
的关系图
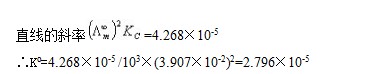
六、结果与讨论
1.电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度有关,所以测电导是要恒温。而电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
2. 电解质的摩尔电导率随浓度增加而降低,原因是:对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶液浓度的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。对弱电解质而言,溶液浓度降低时,摩尔电导率也增加。在溶液极稀时,随着溶液浓度的降低,摩尔电导率急剧增加。
