化工专业实验 蛋白质的离子交换层析实验
一、实验目的
1.了解离子交换层析分离蛋白质的基本原理。
2.掌握离子交换层析分离操作的基本步骤及方法。
二、实验原理
1. 离子交换层析蛋白质的基本原理
离子交换层析(Ion Exchange Chromatography,简称为IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析分离方法。离子交换层析中,基质是由带有电荷的树脂或纤维素组成,带负电荷能吸附正电荷的称之阳离子交换树脂,而带有正电荷能吸附负电荷的称之阴离子交换树脂。
蛋白质(protein)是生命的物质基础,它是与生命及与各种形式的生命活动紧密联系在一起的生物大分子物质。蛋白质的种类很多,性质、功能各异,但都是由20多种氨基酸按不同比例组合而成的。虽然蛋白质是大分子有机物,但由于蛋白质中含有氨基、羧基等亲水基团,蛋白质长链中的亲水基团向外而疏水基团向内,可以形成特定的三维结构,所以大部分蛋白质仍能较好的溶解在水溶液中。在一定的离子强度范围内,溶液中的小分子离子在静电作用下吸附包裹在蛋白质表面亲水基团外侧,形成双电层结构,一定程度上有助于稳定蛋白结构及其水溶性。但蛋白质在不同的pH条件下,其带电状况不同。当pH较低时,蛋白质表面正电荷多于负电荷,总体电性为正;当pH较高时,蛋白质表面正电荷少于负电荷,总体电性为负;当蛋白质表面正电荷量与负电荷量相当时,蛋白质总体显示电中性,双点层结构解体,蛋白质亲水性降到最低,将表现出明显的疏水性,发生疏水性团聚和沉淀,此时的pH值即为蛋白质的等电点。不同蛋白质结构不同,等电点亦不同,但大部分已知蛋白多属于阴离子蛋白,在中性溶液中显示出电负性。
离子交换层析可以用于蛋白质的分离纯化:阴离子交换基质能吸附带有负电荷的蛋白质,阳离子交换基质能结合带有正电荷的蛋白质。一般而言,pH越低,蛋白质净正电荷数越多,pH越高,蛋白质净负电荷数越多;蛋白质分子个头越小,净电荷数越多,离子交换吸附作用越强,越难被洗脱;溶液中小分子离子含量越多,蛋白质可吸附量越少,但若小分子离子含量过低,蛋白质双电层结构不易形成,其水溶性会降低。因此,可以通过提高洗脱液中的盐浓度或改变pH值等措施,将吸附在柱子上的蛋白质洗脱下来。
2.离子交换层析分离蛋白质的过程与步骤
 本实验将采用强碱性大孔树脂吸附分离牛血清白蛋白(BSA),实验装置结构如图所示。离子交换层析操作一般分为五步:
本实验将采用强碱性大孔树脂吸附分离牛血清白蛋白(BSA),实验装置结构如图所示。离子交换层析操作一般分为五步:
(1)平衡:用操作条件下的背景缓冲液平衡层析柱,使介质柱中溶液环境体系各处均一,与吸附上样样品的背景溶液条件相同;
(2)上样:将待分离原料连续稳定的注入层析柱中进行吸附分离,未被吸附的物料将从层析柱下端排出;随上样时间的增加,层析介质的吸附量将逐渐增大并趋于饱和,出口浓度也将不断增加直至与上样浓度相同。待吸附上样物料未被吸附而从出口排出,称为穿透。
 (3)冲洗:用背景缓冲液冲洗层析系统,排出管路及层析柱床空隙中未吸附的物料;若在该溶液环境条件下原料与吸附介质间的吸附作用力较弱,则冲洗操作会造成部分解吸。
(3)冲洗:用背景缓冲液冲洗层析系统,排出管路及层析柱床空隙中未吸附的物料;若在该溶液环境条件下原料与吸附介质间的吸附作用力较弱,则冲洗操作会造成部分解吸。
(4)洗脱:用特定pH值的含盐缓冲液冲洗层析柱,解吸柱内的蛋白质;
(5)再生:用再生溶液冲洗层析柱,彻底清除未解吸的吸附物料,再生还原层析介质,以备后用。
3. 物料恒算
若收集上样和冲洗过程的穿透液,根据物料守恒,应有:
上样量=穿透量+吸附量
若上样浓度为C0,上样体积为V0,层析洗脱死体积为VS,介质质量为m,单位质量介质的吸附量为qm,穿透液体积为VT,穿透液平均浓度为CT,则有:
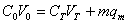
进而,可计算出介质最终的吸附密度:
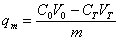 (1)
(1)
吸附回收率R1为
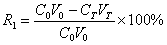 (2)
(2)
不同洗脱溶液的解吸附效果不同,若洗脱过程穿透液的平均浓度为CX,体积为VX,则此时的洗脱回收率R2为:
 (3)
(3)
层析分离操作的总收率R3为:
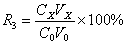 (4)
(4)
4.蛋白含量的测定
在无其他杂质干扰的情况下,蛋白质含量可采用紫外光吸收法进行定量,绝大部分蛋白质对280nm紫外光有明显的吸收,通过测定样品的吸光度与标准曲线比对,即可确定样品中的蛋白含量。
三、实验装置
实验装置包括恒流泵、层析柱、上样瓶、收集瓶及连接管路组成。操作状态下,样品瓶中的样品沿连接管路被恒流泵输送到层析柱,由层析柱上端进入介质床层,再由层析柱下端流出至收集瓶。
实验操作过程中应当防止气泡进入层析柱,切换上样样品时需停泵,尽量避免气泡进入管路,否则,气体易滞留于介质床层中,影响液-固间物质传递。
四、实验步骤
1.层析柱准备
首先,称取2g强碱性大孔树脂,装入层析柱;然后,连接好管线,开泵向层析柱内输入去离子水,排出输入管线中的气体;调节层析柱上端转接头排出介质柱床中的气体,使转接头下缘紧贴介质床层上沿,旋紧密封旋钮,固定转接头;最后,依次用1mol/L的NaCl溶液和去离子水冲洗层析柱10分钟,停泵待用。
2.流量标定
调节恒流泵以一定转速操作,用一预先称重的锥形瓶收集层析柱出口流出的去离子水,收集过程计时5分钟,收集结束后再次称量锥形瓶重量,通过前后差重与收集时间计算泵的流量。重复测定两次,取平均值,即得恒流泵在该转速下的平均输送流量。
通过上述方法,调节泵的转速,使得输出流量QV=2mL/min。
3.动态吸附含量及回收率测定
【上样样品溶液】浓度为1mg/mL、2mg/mL、3mg/mL的BSA溶液
【冲洗液】去离子水
【洗脱液】0.1mol/L 、0.3mol/L 、0.5mol/L、0.75mol/L的NaCl溶液
【再生液】1mol/L的NaCl溶液
【上样时间】5min、10min、15min、20min
【操作流量】QV=2mL/min
用去离子水平衡层析柱10分钟;上样10分钟,冲洗10分钟,收集上样和冲洗过程的穿透液;用洗脱液洗脱15分钟,收集洗脱过程的穿透液;再生层析柱10分钟。
按照上述操作步骤,换不同浓度的上样样品、不同的上样时间、不同解吸液进行测试,通过紫外吸收测定穿透液中的蛋白含量,计算动态吸附量和回收率,并进行分析比较。
五、实验数据处理
自行设计实验数据记录表格,并对实验结果进行分析。
六、思考与讨论
1. 上样时间对吸附分离效果有何影响?
2. 上样浓度对吸附分离效果有何影响?
3. 洗脱液盐含量对分离效果有何影响?
第二篇:实验十二 离子交换柱层析法分离蛋白质
实验十二 离子交换柱层析法分离蛋白质
实验原理
1.离子交换与洗脱
所谓离子交换,是指溶液中的某一种离子与另一种靠静电力结合在惰性载体上的离子进行可逆交换的过程,即溶液中的离子结合到载体上而载体上的离子被替换下来。若惰性载体上以共价键结合着带正电荷的活性基团,则可交换阴离子,叫阴离子交换剂;若以共价键结合着带负电荷的活性基团,则可交换阳离子,叫阳离子交换剂。在一定的条件下,混合物中不同蛋白质所带电荷的性质及电荷多少不同,有的能与特定离子交换剂结合,有的不能结合;能与离子交换剂结合的蛋白质中,结合力的大小也不一定相同,所以,采用适当的洗脱条件,可以对它们进行有效的分离。离子交换过程可以表示如下:
一一一一 ■一R+Y+x→■一R+X+Y (阴离子交换)
■一R—Y++x+→■一R—X++Y+ (阳离子交换)
上式中,■代表惰性载体;R代表惰性载体上的活性基团;Y代表平衡离子(可替换离子); x代表蛋白质分子。
样品进入离子交换柱之前,共价结合于惰性载体上的活性基团大部分处于溶剂化状态,并吸附着平衡缓冲液中带相反电荷的离子。蛋白质样品进入离子交换柱后,由于分子表面一些基团的电荷性质与交换剂上活性基团的电荷性质相反,因而会通过静电引力结合于交换剂上,并把其原来吸附的平衡离子取代下来。
蛋白质是两性电解质,它与离子交换剂的结合力取决于分子表面能够与离子交换剂形成静电键的数目,而后者首先与分子所携带的电荷的数目有关,其次与蛋白质分子的大小及电荷排列也有一定关系,因为它们与蛋白质分子是否易于在离子交换剂上的适当部位形成静电键有关。总的来说,蛋白质分子与交换剂之间存在三种不同的结合状态:①蛋白质分子与交换剂之间的静电键数目很多,以致它们同时解离的机率等于零。洗脱时,这部分蛋白质由于结合紧密而停留在柱顶端。②蛋白质分子与交换剂之间的静电键数目相对较少,它们同时解离的机率达到某一有限值(0~1之间)。洗脱时,某一种蛋白质分子的静电键在某一时间里同时解离,随洗脱液向下移动。③蛋白质分子与交换剂之间的静电键数目极少,完全不与交换剂结合。处于这种状态的蛋白质分子随洗脱液的前峰移动,呈现一个高而窄的“穿过峰’’(“不交换峰”)。如果混合物中有几种蛋白质同时处于这种状态,那么它们会同时被洗脱下来,达不到分离目的。采用阳离子交换剂时,带负电荷的蛋白质分子不能结合而呈“穿过峰”洗脱下来。
蛋白质分子在离子交换剂上的结合状态是随着环境条件的变化而改变的。洗脱就是通过改变缓冲液离子强度或/和pH来改变蛋白质与交换剂的结合状态,降低其与交换剂的结合力,使交换上去的不同蛋白质分子以不同速度洗脱下来,达到分离纯化的目的。增加缓冲液的离子强度时,由于洗脱液中高离子强度竞争性离子的存在,与交换剂结合的蛋白质分子被取代下来进入洗脱液中。洗脱液中离子种类不同时,取代能力不一样。改变缓冲液的pH时,蛋白质分子的解离度降低,电荷减少,从而减弱其与交换剂的结合力。应用阴离子交换剂时要降低pH;应用阳离子交换剂时要升高pH。有时,同时改变两个方面的条件,有利于分离复杂的蛋白质混合物。在恒定的洗脱条件下,往往难以将复杂的蛋白质混合样品有效地分离。通常采用不断改变洗脱条件的方法,即用梯度洗脱的方法来分离蛋白质混合样品。
虽然离子交换层析法分离蛋白质时,主要通过离子交换的作用,但实际上也可能存在 一些疏水吸附和分子筛作用。
2.离子交换剂
人工合成的离子交换剂由高分子的不溶性基质和许多与其共价结合的带电荷的活性基团组成。由于活性基团的电离性质不同,而有强酸性、强碱性、弱酸性和弱碱性之分。不溶性基质主要有树脂、纤维素、葡聚糖凝胶、聚丙烯酰胺凝胶和硅胶等。
离子交换树脂一般只适合分离小分子物质如氨基酸等,不适合分离蛋白质等大分子物质,一方面是因为大分子不易进入树脂紧密交联结构的内部,另一方面是因为交联聚苯乙烯骨架疏水性很强,用于蛋白质分离时,会出现疏水性的不可逆吸附。此外,离子交换树脂的机械强度较差,而且树脂的体积常随着溶剂离子强度的变化发生溶胀和收缩。
离子交换纤维素的种类很多,可分为阴离子交换纤维素和阳离子交换纤维素两大类。由于这些材料是纤维状的,大部分活性基团分布在表面,所以,适合于分离蛋白质等生物大分子。二乙基氨乙基纤维素(DEAE一纤维素)和羧甲基纤维素(CM一纤维素)分别是应用得最广泛的阴离子交换纤维素和阳离子交换纤维素。另外,根据纤维素颗粒的物理结构不同,可分为“纤维型,,和“微晶型”两大类。‘‘微晶型”因颗粒细、比重大,能制成紧密的柱,交换容量大,分辨率高。
离子交换葡聚糖凝胶和聚丙烯酰胺凝胶具有许多优点:不会引起被分离物质的变性或失活;非特异性吸附很低;交换容量大(为离子交换纤维素的3~4倍);容易制成微球型,因此装柱和层析时的流速都较易控制。它的缺点是随着洗脱液的离子强度和pH的变化,床体积变化大,明显影响流速;另外,由于它的凝胶性质,有时会把大分子物质排阻在网络结构之外。
目前,用于蛋白质和多肽离子交换HPLC的多为以硅胶为载体的离子交换剂。以硅胶为载体的离子交换剂的主要优点是有很好的机械强度,能耐受较高的层析柱压,可适应广泛种类的流动相,在含有变性剂、有机溶剂和高离子强度的洗脱液中均能使用,不会发生明显的溶胀与收缩,而且可以制成各种孔径5~1 000 nm的刚性填料。根据硅胶载体上键合的活性基团的不同,可分为强酸性、强碱性、弱酸性和弱碱性的离子交换剂。通常用于蛋白质与多肽分离的强酸性阳离子交换剂联有磺酸基(一S03H);强碱性阴离子交换剂联有季胺碱基
[一CH2N+(CH3)3];弱酸性阳离子交换剂联有羧甲基(一CH2一COO一,CM);弱碱性阴离子交换剂联有二乙基氨乙基[一CH2CH2N(CH2CH2)2,DEAE]。强酸性和强碱性离子交换剂的优点是流动相较大范围内的pH不会改变载体活性基团的带电性质,因而在酸性、中性和碱性的流动相中均能使用。弱酸性(CM型)的离子交换剂宜在pH>4.0的环境中使用,弱碱性(DEAE型)的离子交换剂宜在pH<9.6的环境中使用。弱酸性和弱碱性离子交换剂由于对
一H+和OH有较大的亲和力,为洗脱和再生带来了方便,对于一些吸附性能较强的蛋白质与多肽样品采用弱碱性和弱酸性的交换剂,可以在较温和的条件下,即较低的盐浓度和较小的pH改变的情况下把样品洗脱下来。这对于某些蛋白质的活性保持通常是很有意义的。以硅胶为载体的离子交换剂可有不同颗粒孔径供选择,大孔径的填料为相对分子质量Mr大的蛋白质提供更多可交换的基团,使每克交换剂的交换容量增大。一般蛋白质样品应选择孔径为30 nm的交换剂,对于相对分子质量Mr150000以上的蛋白质,应当选择孔径l00nm的交换剂。
3.离子交换柱层析条件的选择
对于分离一个特定的蛋白质,选择什么样的柱子、离子交换剂和流动相等需根据具体情况统筹考虑,主要是根据待分离蛋白质本身的理化性质和生物学性质确定。因此,在采用离子交换层析法进行蛋白质的分离之前,应当对待分离的蛋白质的性质有所了解,如等电点、相对分子质量、疏水性、生物活性及测定方法、溶解性、浓度、发生聚合的可能性、稳定性以及微观不均一性等。由于多数情况下离子交换柱层析采用梯度洗脱,因而柱子都不需很长。了解样品的等电点决定选用阳离子还是阴离子交换剂以及流动相的pH;样品的相对分子质量Mr将决定选用多大孔径的柱填料;疏水性强的样品则要求选用疏水吸附较小或亲水性载
体的交换剂,以防止非特异性疏水吸附;活性测定方法可用来鉴定分离到的样品及测定回收率;样品的溶解性在选用流动相的种类时是必须考虑的,并依此决定是否要在流动相中添加促溶剂;根据样品的稳定性决定层析温度、流动相pH以及是否要在流动相中添加稳定剂;样品的浓度和含量是选择柱体积大小和每次进样量的依据;对于那些存在微观不均一的样品,由于它们在结构和性质上极其相似,所以在分离时要采用分辨率尽可能高的条件(如等梯度洗脱);对某些样品还要选用适当的样品浓度、pH和盐浓度以防止其发生聚合。
(1)离子交换剂的选择在等电点已知的前提下,若所用缓冲液的pH高于等电点,则用阴离子交换剂;反之,若所用缓冲液的pH低于等电点,则用阳离子交换剂;若先确定了所用离子交换剂的类型,那么,就必须对缓冲液的pH作相应的调整。但在实际应用中,为了避免样品处于过酸或过碱的环境,对于酸性蛋白质和多肽样品(pI<6),通常是使其带有负电荷而采用阴离子交换剂;对于碱性蛋白质和多肽样品(pI>8),通常是使其带有正电荷而采用阳离子交换剂。等电点未知时,可参照电泳分析的结果。在中性和偏碱性条件下电泳时向阳极移动较快的物质,同样条件下可被阴离子交换剂吸附;向阴极移动或向阳极移动较慢的物质,同样条件下可被阳离子交换剂吸附。但有时有例外,因为某一物质的层析行为,除与分子的净电荷有关外,还与它的分子大小、分子结构和电荷排列等有关。对于等电点未知的蛋白质,还可用阴离子交换剂和阳离子交换剂分别在较高pH(如pH 8.6)和较低pH(如pH 5.5)条件下进行离子交换实验,观察交换吸附的情况。如果待分离的物质能被两种交换剂吸附,则两种离子交换剂都可用于分离,而且待分离物质与其他成分分离的机会更多。如果都不吸附,则尽量降低样品和起始缓冲液的盐浓度,直至几乎为零。若发现被吸附的物质由于吸附太牢而不易洗脱,则应选用交换当量较小或具有弱解离活性基团的离子交换剂。
(2)缓冲液的选择缓冲液离子应不影响被分离物质的活性并不干扰其测定,不影响样品的溶解度和稳定性。如洗脱液要用280 nm波长检测时,缓冲液内就不能有芳香族化合物;如要用215~225 nm波长检测肽键的含量,则不能用含羧基的缓冲液。采用阳离子交换剂时,应选用阴离子型缓冲液,如磷酸、醋酸缓冲液等。采用阴离子交换剂时,应选用阳离子型缓冲液,如Tris、吡啶缓冲液等。
缓冲液pH的确定首先取决于被分离物质的等电点,采用阳离子交换剂时应低于物质的等电点,采用阴离子交换剂时应高于物质的等电点。同时要结合考虑被分离物质的溶解度、稳定性和离子交换剂的活性基团的PK?。用阴离子交换剂时pH应低于其pK?,用阳离子交换剂时pH应高于其pK?,且应使缓冲液pH介于样品等电点和pK?之间。
为了降低盐离子的竞争,起始缓冲液的浓度要尽可能的低(如0.01 mol/L左右)。这 就需要选用其pK?接近所需pH的缓冲离子,以使缓冲液具有较强的缓冲能力,避免缓冲离子与离子交换剂作用而引起pH的改变。当确信样品易被吸附后,可适当提高起始缓冲液的浓度以保证一定的缓冲能力。
实验材料与设备
1.用品与仪器
玻璃层析柱(20 mL),梯度混合器,核酸蛋白检测仪,记录仪,部分收集器,接收试管、天平,酸度计等。
2.试剂
(1)蛋白质样品液:鸡卵清蛋白,pI=4.6;核糖核酸酶,pI=7.8;细胞色素c,pI=10.6; 胰岛素,pI=5.3。
(2)洗脱液A:0.05 mol/L Tris·HCl缓冲液,pH:7.5;洗脱液B:0.05 mol/L Tris·HCl缓冲液,pH=7.5,含有1.0mol/LNaCl.
(3)DEAE一纤维素:0.5 mol/L HCl;0.5 mol/L NaOH;双蒸水。
实验操作程序
1.离子交换剂的预处理
称取1.8 g DEAE一纤维素(DE52,Whatman公司生产,6.3 mL/g)置于小砂芯漏斗中.先在20mL 0.5 mol/LNaOH中浸泡30 min,然后用双蒸水洗至pH=8。再用20 mL0.5 mol/L HCl浸泡30 min,然后水洗至pH=4.0。最后用20 mL 0.5 mol/L NaOH浸泡30 min后水洗至pH=8.O。
2.装柱
将玻璃层析柱洗净后垂直安装于支架上,装入约10 mL洗脱液A,打开下嘴阀让缓冲液慢慢滴出,同时,将悬浮于适量洗脱液A中的处理好的DEAE一纤维素一边搅动一边倒入层析柱中,让其自然沉降到全部加入为止。装柱时交换剂的悬浮液最好一次倒人,若分次倒入,则须在再次添加之前将界面处的交换剂搅起,以保证柱床不分节。柱面要平整,柱中无气泡。待液面离纤维素沉降面约l cm后,关闭下嘴阀。
3.平衡
连接梯度混合器,用起始缓冲液(洗脱液A)以1.0 mL/min的流速平衡柱子,直到流出液pH与起始缓冲液的完全相同为止。
4.上样
揭开层析柱上盖。打开下嘴阀,待液面降至纤维素柱面时又关闭之。用滴管小心将0.5 mL样品均匀地加到纤维素柱面上,打开下嘴阀,待样品液面降至与柱面平齐时又关闭之。用同样的方法加入0.5 mL起始缓冲液,让其将残留于柱内壁的样品全部洗入纤维素柱后关闭下嘴阀。最后在柱面上覆盖一层起始缓冲液(约1~2 cm深)。
5.洗脱
盖紧层析柱上盖,连接并打开梯度混合器,开始洗脱。梯度为30 min内由100%洗脱液A变到100%洗脱液B。用核酸蛋白检测仪280 nm检测并用部分收集器收集流出的组分。根据离子交换层析的理论和记录仪上的洗脱曲线确定各蛋白质组分所在的接收试管。
讨 论
1.配制离子交换层析的缓冲液时需要量最大的是水,对水的要求一般为去离子水。对于一些特殊用途的样品,如医药用的样品,则要求不含热原即各种内毒素的水,因而需要进一步纯化。通过全玻璃蒸馏器的双蒸水或三蒸水一般能达到要求。
2.配制缓冲液时,应先配好缓冲离子的共轭酸和共轭碱溶液,然后按比例准确量取混合。用酸度计测量pH,必要时用共轭酸或共轭碱溶液调整之。配制好的缓冲液需经孔径为0.45μm的滤膜过滤,并用超声波或氦气除去溶液中的气体。缓冲液应当新鲜配制,不用时放在4℃冰箱以防长菌,再用前须重新过滤和除气,但在冰箱中放置一周以上的缓冲液最好不用。
3.加入的样品若为直接从生物材料中提取的混合物,也需过滤或高速离心,加样后要用足够的起始缓冲液流洗,使未吸附的物质全部洗出,并充分平衡层析柱,然后再用梯度洗脱。
4.离子交换纤维素柱用起始缓冲液充分平衡后可再次使用。如长时间不用,须用0.1%的叠氮钠缓冲液浸泡并于4℃冰箱存放。
