化学与制药工程学院
工业分析专业实验
实验题目: 混合碱分析
班 级: 应化0704 学 号: 07220410
姓 名: 实验日期:
实验题目:混合碱分析
一、摘要
本实验采用双指示剂法,通过配制一定浓度的HCl,对混合碱进行了定性和定量的分析。用分析纯无水Na2CO3来标定HCl浓度,并用其来滴定配好的混合碱溶液,根据前后两次消耗HCl的体积判断样品中的成分为Na2CO3与NaHCO3 的混合物,并计算各组分的百分含量。
二、实验目的
1.掌握移液管的使用;
2.掌握HCl标准溶液的配制和标定方法;
3.学会用双指示剂法测定混合碱中各组分的含量,掌握酸碱分步滴定的原理;
4.学会混合碱的总碱度测定方法及计算。
三、实验原理
混合碱是Na2CO3与 NaOH 或Na2CO3与NaHCO3的混合物。测定同一份试样中各组份的含量时,可用HCl标准溶液滴定,选用两种不同指示剂分别指示第一、第二化学计量点的到达。根据到达两个化学计量点时消耗的HCl标准溶液的体积,便可判别试样的组成及计算各组份含量。
1.用碳酸钠标定盐酸标准溶液:
以甲基橙为指示剂,用HCl标准溶液滴定溶液由黄色变为橙色,发生的反应为: 2HCl +Na2CO3 = 2NaCl+CO2 ↑+H2O
2.双指示剂法测定混合碱中组分含量:
先以酚酞作指示剂,用HCl标准溶液滴定至溶液由红色变成无色,这是第一个滴定终点,此时消耗的HCl溶液的体积记为V1(mL),溶液中的滴定反应为:Na2CO3 + HCl = Na2CO3 + NaCl
NaOH + HCl = H2O + NaCl
在反应的溶液中再加入甲基橙指示剂,滴定至溶液由黄色变成橙色,这是第二滴定终点,此时消耗的HCl溶液记为V2(ml),溶液中的滴定反应为:
NaHCO3 + HCl = NaCl + H2O + CO2↑
当 V1 > V2 时,试样为Na2CO3与NaOH的混合物,中和Na2CO3所需HCl是分两批加入的,两次用量应该相等。即滴定Na2CO3所消耗的HCl的体积为2V2 ,而中和 NaOH 所消耗的 HCl的体积为(V1 –V2) ,故计算NaOH和Na2CO3的含量公式应为: 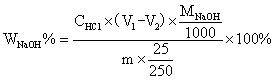
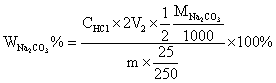
当V1 < V2时,试样为Na2CO3与NaHCO3的混合物,此时V1为中和Na2CO3时所消耗的HCl的体积,故Na2CO3所消耗的HCl的体积为2V1,中和NaHCO3消耗的HCl的体积为(V2–V1),计算NaHCO3和Na2CO3含量的公式为:
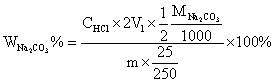
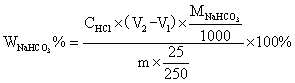
四、实验仪器和试剂
仪器:分析电子天平 、酸式滴定管、锥形瓶、25mL移液管、250mL容量瓶、试剂瓶、量筒。
试剂:分析纯无水Na2CO3 、混合碱样品 、甲基橙指示剂 、酚酞指示剂、浓HCl。
五、实验步骤
1.溶液的配制:
a HCl溶液的配制:量取5mL浓HCl加入的放有295mL蒸馏水的试剂瓶中,充分混合后待用。
b 混合碱溶液的配制:准确称取2g混合碱样品溶解于小烧杯中,转移到250mL容量瓶中,定容、摇匀。
2. HCl溶液的标定: 准确称取0.17g—0.21g无水Na2CO3三份分别放于锥形瓶中,各加30mL蒸馏水温热溶解。取其中一个,加入2d甲基橙试剂,用HCl滴定至溶液由黄色刚变为橙色为终点。平行滴定三次,计算HCl标准溶液的浓度。
3.双指示剂法测定混合碱中组分: 用移液管移取25.00mL混合碱溶液于锥形瓶中,加2d酚酞,用已标定好的HCl标准溶液滴定至溶液由红色变为微红色,为第一终点,记下体积V1 ,再加入2d甲基橙,继续用HCl标准溶液滴定至溶液由黄色变为橙色,为第二终点,记下体积V2 ,平行测定三次,计算混合碱中各组分含量。
六、数据处理
1.盐酸溶液的标定
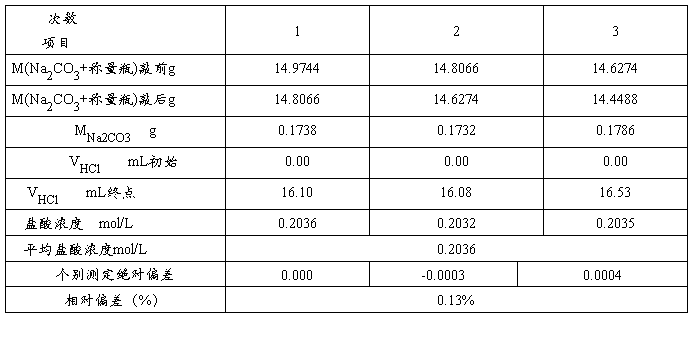
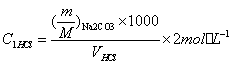
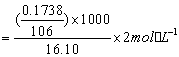
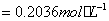
同理可得: =
=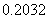
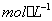
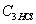 =
=
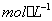
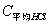 =
=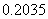
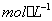
绝对偏差: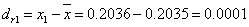
同理可得: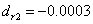
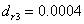
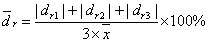

2. 混合碱中各组分含量的计算
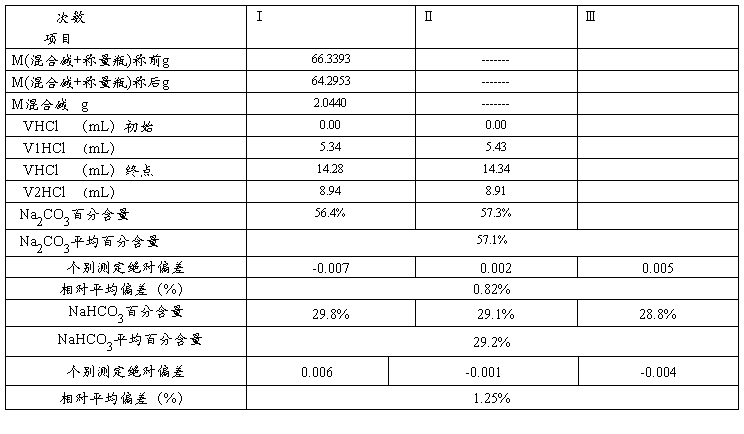
V1=5.34<8.94=V2 则混合碱组分为Na2CO3和NaHCO3
1.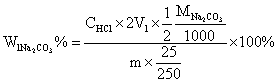
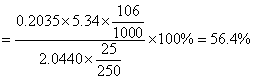
同理可得:
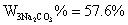
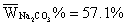
第一次测定Na2CO3绝对偏差: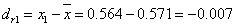
同理可得: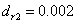
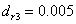
相对平均偏差: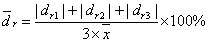
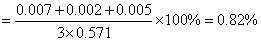
2. 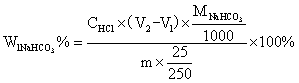
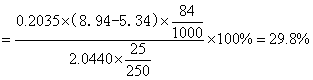
同理可得: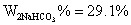
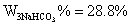
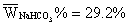
第一次测定NaHCO3绝对偏差: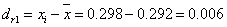
同理可得: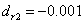
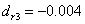
相对平均偏差: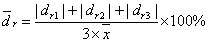
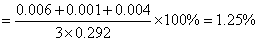
七、结果与讨论
1、在取混合碱样品和Na2CO3固体粉末时,应直接放到锥形瓶里,因为其在空气中容易潮解,Na2CO3吸收空气中的水和CO2变成NaHCO3影响实验结果,所以尽可能避免其长时间暴露于空气中。
2、配制稀盐酸溶液时,应该在通风厨里进行,防止其挥发对人体造成伤害,在取盐酸时应该带胶皮手套,防止皮肤与其接触。
3、滴定混合碱样品时,后几次以第一次体积为基准,在到达终点前1mL处,开始一滴滴地滴定,仔细观察近终点时颜色的变化。
4、滴定速度过快导致滴定过量,影响实验结果。甲基橙指示剂变色范围为由黄色变为橙色,变色不明显,导致滴定误差,影响滴定结果。
八.实验结论:
由滴定体积V2>V1可知 混合碱样品中的成分为:Na2CO3与NaHCO3 ,Na2CO3 的含量为57.1% NaHCO3 的含量为29.2% 。
九、评语和成绩:
成绩: 指导教师:
1.注意事项:
(1)称量无水Na2CO3基准物时,称量瓶一定要带盖,以免吸湿。
(2)滴定速度宜慢,否则因颜色变化较慢容易过量。
(3)在配制HCl标准溶液时,一定要先加入浓HCl,后加入蒸馏水,以免浓HCl飞溅,伤到身体。
(4)在进行滴定时,后几次以第一次体积为基准,在到达终点前1mL处,开始一滴滴地滴定,仔细观察近终点时颜色的变化。
(5)读数时视线要与滴定管的凹液面相平。
(6)在酚酞的配制过程中,一定要先加无水乙醇溶解酚酞,再加入蒸馏水到达指定刻度。
(7)称量浓盐酸时要打开通风橱且要戴手套。
2.误差分析:
(1)滴定速度过快导致滴定过量,影响实验结果。
(2)甲基橙指示剂变色范围为由黄色变为橙色,变色不明显,导致滴定误差,影响滴定结果。
3. 思考题:
1.本实验采用什么为指示剂法,其滴定终点为多少?
答:本实验采用酚酞和甲基橙为指示剂,酚酞的变色范围在8.2~10.0,甲基橙的变色范围为3.1~4.4。
2.通过消耗的体积可得到什么结论?
答:若V1>V2,混合碱为Na2CO3和NaOH的混合物;当V1<V2,混合碱为Na2CO3和NaHCO3的混合物。
八.实验结论:
通过实验测定结果可知,混合碱组分为Na2CO3和NaHCO3,百分含量分别为57.13%和29.10%
九、评语和成绩
指导教师: 成绩:
第二篇:实验十二混合碱组成的分析及各组分含量的测定






