实验三、混合碱(Na2CO3、NaHCO3)中各组分含量的测定
教学目标及基本要求
1. 学习双指示剂法测定混合碱中各组分含量的方法;
2. 学习连续滴定的计算方法;
教学内容及学时分配
1. 提问检查预习落实情况,0.2学时。
2. 讲解实验内容(0.8学时):双指示剂法测定混合碱中各组分含量的基本原理,HCl标准溶液的配制与标定,混合碱试样中各组分含量的测定。
3. 开始实验操作,指导学生实验,发现和纠正错误,3学时。
一、预习内容
1、 双指示剂法测定混合碱中各组分含量
2、 酸式滴定管的使用
二、实验目的
1、练习双指示剂法测定混合碱中各组分含量
2、练习酸碱滴定的基本操作
3、学习连续滴定的相关计算
三、实验原理
若混合碱的组成为NaOH与Na2CO3

↓V1-V2 ↓V2 SP1:PP Na2CO3%=C(HCl)V2M(Na2CO3)/ms×100%

↓V2 SP2:MO NaOH%= C(HCl)(V1-V2) M(NaOH)/ms×100%

若混合碱的组成为Na2CO3与NaHCO3

↓V1 SP1:PP Na2CO3%=C(HCl)V1M(Na2CO3)/ms×100%

↓V1 ↓V2-V1 SP2:MO NaHCO3%= C(HCl)(V2-V1) M(NaHCO3)/ms×100%

四、实验步骤
1、 HCl标准溶液的配制
(1)配制300cm3浓度为0.1moldm3的HCl溶液
用量筒量取295cm3水置于试剂瓶中,用吸量管量取5.00 cm3浓度为6moldm-3的浓HCl溶液置于试剂瓶中,盖塞,摇匀。
(2)HCl溶液浓度的标定
计算需称取Na2CO3固体的质量
若消耗HCl溶液20.00cm3,则m=20.00×10-3×0.1×0.5×105.99=0.11(g);
若消耗HCl溶液30.00cm3,则m=30.00×10-3×0.1×0.5×105.99=0.16(g)。
用差减法准确称取Na2CO3固体0.11~0.16g于锥形瓶中,加25.00cm3水振荡至完全溶解,加2滴甲基橙指示剂,用HCl溶液滴定至橙色,消耗HCl溶液的体积为V。平行操作三次。
做溶剂水的空白:移取25.00cm3水置于锥形瓶中,加2滴甲基橙指示剂,用HCl溶液滴定至橙色,消耗HCl溶液的体积为V空(约为0.10cm3)。
2、 混合碱中各组分含量的测定
用差减法准确称取混合碱样品0.11~0.16g于锥形瓶中,加25.00cm3水振荡至完全溶解,加2滴酚酞指示剂,用HCl标准溶液滴定至几乎无色,消耗HCl标准溶液的体积为V1,再加入2滴甲基橙指示剂,摇匀,继续用HCl标准溶液滴定至橙色。在电炉上将锥形瓶中的溶液加热煮沸,若仍为橙色,说明HCl已过量;若变为黄色,则冷却后继续滴至橙色,消耗HCl溶液的体积为V总。平行操作三次。
五、数据处理
1、HCl溶液浓度的标定

C(HCl)=m(Na2CO3) ×2000/M(Na2CO3)(V-V空) (mol dm-3)
2、混合碱中各组分含量的测定
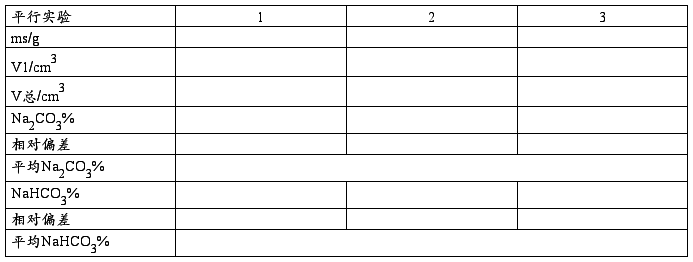
Na2CO3%=C(HCl)×V1×10-3×M(Na2CO3)/ms×100% M(Na2CO3)=105.99
NaHCO3%= C(HCl)(V总-2V1- V空)M(NaHCO3)/ms×100% M(NaHCO3)=84.01
六、实验中易出现的问题
1、纯Na2CO3与混合碱样品两瓶试剂易取错。
2、测定混合碱时,第一化学计量点之前滴定速度不要过快,否则会造成HCl局部过浓,Na2CO3直接转化为H2O,CO2,造成V总﹤2V1。
3、第一化学计量点时溶液的颜色为浅红,不能太深,也不能无色,颜色太深会造成Na2CO3%偏低,无色会造成Na2CO3%偏高。
4、第二化学计量点时溶液的颜色为橙色,不能太黄,也不能太红,颜色太黄会造成NaHCO3 %偏低,太红会造成NaHCO3 %偏高。
5、本实验的误差主要来自对两个化学计量点时溶液的颜色的判断。
七、思考题
1、如果在滴定过程中所记录的数据发现V总﹤2V1,说明什么问题?
2、称量基准物无水碳酸钠时应注意什么问题?
3、本实验中,滴定试样溶液接近终点时为什么要剧烈振荡?
重点和难点
i.给学生解释清楚双指示剂法,以及操作过程中应该注意的问题:颜色变化的识别比较困难,这会直接影响实验数据的计算。
ii. 掌握连续滴定的相关计算。
深化和拓展
在基础实验中锻炼基础科学研究技能。
教学方式及注意问题
以提问的方式了解预习内容落实情况,以多媒体为手段讲解实验内容;以现场指导法纠正和规范实验操作。
参考书目及网络资源
基础化学实验(I)------无机及分析化学部分,山东大学、山东师范大学等高校合编,化学工业出版社教材出版中心,20##年7月第一版。
分析化学(第四版),武汉大学主编,高等教育出版社,20##年3月第四版
第二篇:有关Na2CO3与NaHCO3的实验
1.(14分)化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为: ;
(2)实验中,需加热至恒重的目的是 。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是
。
[方案三]按如下图所示装置进行实验:

(1)D装置的作用是 。
分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重 8.80g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
2、我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:


(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是
A、增大NH4+的浓度,使NH4Cl更多地析出
B、使NaHCO3更多地析出
C、使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
3、我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。试回答下列有关问题:
(1)根据“侯氏制碱法”,涉及三个有关反应的化学方程式为:
①NH3+CO2+H2O =NH4HCO3;
②NH4HCO3+NaCl =NaHCO3↓+NH4Cl;
③ 。
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是( )(填字母标号);
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某研究性学习小组根据上述制碱原理,进行碳酸氢钠的制备模拟实验,同学们按各自设计的方案实验。
I、一位同学将二氧化碳气体通入含足量氨的饱和食盐水中制备碳酸氢钠,实验装置如下左图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 ①甲装置中玻璃仪器的名称是 、 ;
①甲装置中玻璃仪器的名称是 、 ;
②乙装置的试剂是 。
③丁装置中稀硫酸的作用是 ;
④实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
Ⅱ、另一位同学用图中戊装置(其它装置未画出)进行实验。
⑤实验时,须先从 管通入 气体,再从 管中通入 气体;
⑥有同学建议在戊装置的b管下端连接己装置,理由是
;
⑦丙和戊装置中用冷水控制温度在30℃—35℃,其可能的原因是: 。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
1. (14分)
[方案一]
(1)2NaHCO3  Na2CO3 + CO2↑ + H2O (2分)
Na2CO3 + CO2↑ + H2O (2分)
(2)保证NaHCO3分解完全 (2分)
[方案二]
(1)玻璃棒 (1分) (2)取少量上层清液于一支试管中,加一滴Ba(OH)2溶液,
观察是否有白色沉淀生成 (2分)
[方案三]
(1)防止空气中的水蒸气、二氧化碳进入C装置 (2分)
不能 (1分)
(2)29.6% (2分)
(3)缺少一个驱赶残留二氧化碳气体的装置(或其他合理答案) (2分)
2、(1)联合制碱法或侯德榜制碱法,化肥或电解液或焊药等(其他合理答案均正确)
(2)NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(3)CO2 (4)I 过滤 ⑸稀硝酸和硝酸银溶液(6)A C
3(1)③2 NaHCO3 △ Na2CO3+CO2↑+ H2O
(2)C
(1) ①圆底烧瓶、分液漏斗;
①圆底烧瓶、分液漏斗;
②饱和NaHCO3溶液;
③吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分);
④过滤;
⑤a 氨气 b 二氧化碳;
⑥增大气体与溶液的接触面积、使反应充分进行;
⑦防止NH4HCO3分解,同时能使较多的晶体析出。
(4)用碳酸氢铵与适量饱和食盐水反应。(或向NaOH溶液中通入过量CO2;向饱和Na2CO3溶液中通入过量CO2等。其他合理方法均可)
 钠放置在空气中被氧化(常温):4Na + O2 == 2Na2O(氧化钠,白色固体)
钠放置在空气中被氧化(常温):4Na + O2 == 2Na2O(氧化钠,白色固体)
钠在空气中燃烧:2Na + O2 Na2O2 (过氧化钠,淡黄色固体)
 钠与水的反应:2Na + 2H2O == 2NaOH + H2↑ 2Na + 2H2O == 2Na+ + 2OH - +H2↑
钠与水的反应:2Na + 2H2O == 2NaOH + H2↑ 2Na + 2H2O == 2Na+ + 2OH - +H2↑
钠与四氯化钛的反应:TiCl4 + 4Na Ti + 4NaCl
 钠的工业制法:2NaCl(熔融) 2Na + Cl2↑
钠的工业制法:2NaCl(熔融) 2Na + Cl2↑
* 过氧化钠与二氧化碳的反应:2Na2O2 + 2CO2 == 2Na2CO3 +O2
* 过氧化钠与水的反应:2Na2O2 + 2H2O == 4NaOH + O2↑
碳酸钠与氢氧化钙的反应:Na2CO3+Ca(OH)2==CaCO3↓+2NaOH Ca2++CO32-==CaCO3↓
碳酸钠与氯化钡的反应:Na2CO3+BaCl2==BaCO3↓+2NaCl Ba2+ + CO32- ==BaCO3↓
碳酸钠溶液中通入CO2:Na2CO3+CO2+H2O==2NaHCO3 CO32- + CO2 + H2O==2HCO3–
NaHCO3与NaOH溶液反应:NaHCO3+NaOH==Na2CO3+H2O HCO3- +OH -==CO32- +H2O
NaHCO3与盐酸反应:NaHCO3+HCl==Na2CO3+CO2↑+H2O HCO3- +H+ == CO2↑+ H2O
碳酸钠与不足的盐酸反应:Na2CO3+HCl==NaHCO3+NaCl CO32- + H+ == HCO3-
碳酸钠与足量的盐酸反应:Na2CO3+2HCl==2NaCl+CO2↑+H2O CO32-+2H+==CO2↑+H2O
碳酸氢钠固体受热分解:2NaHCO3 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O
* 侯氏制碱法:NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl
