第三章有机化合物的制备
3.1 消除反应
实验二十八 环己烯的制备
1 反应式
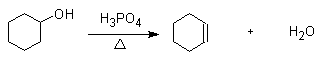
2 药品与试剂
环己醇,浓磷酸,碳酸钠溶液,无水氯化钙
3 实验步骤与操作
在50mL干燥的圆底浇瓶中,加入 10g环己醇(10.4mL, 约0.1mol), 4mL浓磷酸(或2ml浓硫酸)和几粒沸石,充分振摇使之混合。安装蒸馏装置,加热到130~140 oC, 并维持此反应温度[1],直至无液体馏分为止。 将馏出液用约1g精盐饱和后加入 3~4 mL 5%碳酸钠溶液中和微量酸[2] . 将此液体倒入小分液漏斗中,振摇后静置分层。放出下层的水层[3],上层的粗产品转入干燥的小三角烧瓶中,加入1~2g无水氯化钙干燥[4]。粗环己烯(溶液应为清亮透明)倒入60mL蒸馏烧瓶中,加入几粒沸石后用水浴加热蒸馏,收集80~85 oC的馏分。称重并计算产量。
4 注意事项
[1] 温度不可过高,蒸馏速度不宜过快,以2~3滴/秒为宜,减少未反应的环己醇蒸出。
[2] 也可用约0.5ml 20%的氢氧化钠溶液中和。
[3] 水层应尽量分离完全。否则,将增加无水氯化钙的用量。
[4] 用无水氯化钙干燥粗产品,还可除去少量未反应的环己醇。
5 思考题
(1) 在粗制的环己烯中,为什么要用精盐使水层饱和?
(2) 如果用油浴加热时,要注意哪些问题?应选用哪一种油?
3.2 加成反应
实验二十九 7,7-二氯双环[4.1.0]庚烷的制备
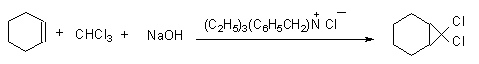
1 反应式
2 主要药品与试剂
环己烯,氯仿(AR),氯化苄基三乙基铵,50%NaOH,乙醚,无水硫酸钠等
3 实验步骤与操作
150mL锥形瓶中加入5mL蒸馏过的环己烯,12mL无乙醇的氯仿[1]和0.3~0.4g氯化苄基三乙铵, 摇匀, 再加入15mL 50%NaOH水溶液。振摇混合物数分钟,反应温度自行上升至50~60 oC。不断振摇或搅拌混合物15~20min,然后让其自然冷却至35 oC左右,加蒸馏水30mL,将反应混合物转移到分液漏斗中,分出有机层。水层用10ml乙醚萃取,合并乙醚萃取物和有机层,再用蒸馏水洗涤二次,每次用水10mL, 分净水层[2], 有机层用无水硫酸钠干燥。热水浴蒸出乙醚和氯仿后, 再蒸馏收集196~199 oC馏分[3]。
4注意事项
[1] 氯仿遇光分解产生极毒的光气,为此在氯仿中常加少量乙醇作稳定剂。
[2] 水层要分尽,干燥要彻底,这样才不会影响产率.
[3] 也可用减压蒸馏收集馏分.
5 思考题
(1) 简述本实验中相转移催化反应的基本原理.
3.3 卤代反应
实验 三十 1-溴丁烷的制备
1 反应式
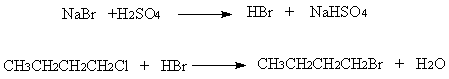
2 药品与试剂
浓硫酸,正丁醇,溴化钠,饱和碳酸氢钠溶液,无水氯化钙
3 实验步骤与操作
在100ml圆底烧瓶中,加入10mL水,慢慢加入12mL (0.08mol) 浓硫酸, 混合均匀并冷却至室温。加入正丁醇7.5mL (0.08mol), 混合后加入10g (0.10 mol) 研细的溴化钠,充分振摇[1],再加入几粒沸石,安装接一吸收溴化氢气体装置的回流冷凝管。用5%的氢氧化钠溶液作吸收剂。小火加热回流0.5h[2]. 冷却后,改作蒸馏装置,加热蒸出所有溴丁烷[3]。
将馏出液转入分液漏斗,用10mL水洗涤[4],将粗品转入到另一干燥的分液漏斗中,用5mL浓硫酸洗涤[5]。分去硫酸层后,有机层依次分别用水、饱和碳酸氢钠溶液和水各10mL洗涤。产物用无水氯化钙干燥至液体透明, 转入到蒸馏烧瓶中。蒸馏,收集99~103℃馏分,称重,计算产率。
4 注意事项
[1] 如在加料过程中和反应回流时不摇动,将影响产量。
[2] 在此过程中,要经常摇动。
[3] 馏出液由浑浊变为澄清表明1-溴丁烷已蒸完。
[4] 用水洗涤后馏出液如有红色,是因为含有溴的缘故,可加入 10~15mL饱和亚硫酸氢钠溶液洗涤除去。
[5] 浓硫酸可洗去粗品中少量未反应的正丁醇和副产物丁醚等杂质。
5 思考题
(1) 本实验中,浓硫酸起何作用?其用量及浓度对实验有何影响?
(2) 为什么在用饱和碳酸氢钠溶液洗涤以前,要先用水洗涤?
实验三十一 1-碘丁烷的制备
1 反应式

2 药品与试剂
1-溴丁烷,碘化钠,丙酮,乙醚,饱和亚硫酸钠溶液
3 实验步骤与操作
250ml圆底烧瓶中,加入80mL的碘化钠-丙酮溶液(15g, 0.1mol碘化钠)。在磁力搅拌下,加入5.4 (6.85g,50mmol) 的1-溴丁烷,水浴回流20min后,让其冷却,安装蒸馏装置,蒸出约60mL的丙酮。瓶内物用冰浴冷却至室温,加入50mL水,用25mL乙醚萃取,分出的有机层用10ml饱和亚硫酸钠洗涤,以除去反应中产生的碘。再用无水硫酸镁干燥,抽滤,旋转蒸发除去溶剂[1],再常压蒸馏收集125~135℃馏分[2]。称重,计算产率。
4 注意事项
[1] 旋转蒸发时,不需要加热。
[2] 为减少产物的分解,可在蒸馏烧瓶内加入一截铜丝。也可用减压蒸馏,收集60~65℃馏分。
5 思考题
(1) 卤代烷的结构对SN2反应有何影响?
3.4 酰基化反应
实验三十二 苯乙酮的制备
1 反应式

2 药品与试剂
苯,醋酸钠,无水三氯化铝,浓盐酸,氢氧化钠(10%)
3 实验步骤与操作
向装有10ml恒压滴液漏斗[1]、机械搅拌装置[2]和回流冷凝管(上端接一氯化钙干燥管与氯化氢吸收装置相连)的100mL三颈烧瓶中迅速加入13g(0.097mol)粉状无水三氯化铝和16mL(约14g, 0.18mol)无水苯。在搅拌下将4mL (约4.3g, 0.04mol) 新蒸馏的乙酐自滴液漏斗慢慢滴加到在三颈烧瓶中,控制乙酐的滴加速度以使三颈烧瓶稍热为宜。加完后(约需10min), 待反应稍缓和后在沸水浴中搅拌回流,直至不再有氯化氢气体逸出为止。
将反应混合物冷到室温,在搅拌下倒入18mL浓盐酸和35g碎冰的烧杯中[3],将混合物转入分液漏斗中,分出有机层,水层用苯萃取2次(每次8mL)。合并有机层,依次用15mL 10%氢氧化钠、15mL水洗涤,再用无水硫酸镁干燥。水浴蒸馏回收苯,稍冷后改用空气冷凝管蒸馏, 收集195~202℃馏分。称重,计算产率。
4 注意事项
[1] 本实验也可用电磁搅拌器或人工振荡代替机械搅拌.
[2] 无水AlCl3要研细, 称重、投料都要迅速.
[3] 若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。
5 思考题
(1) Friedel-Crafts酰基化反应和烷基化反应各有何特点?在这两个反应中,AlCl3和芳烃的用量有何不同?为什么?
(2) 反应完成后为什么要加入浓HCl冰水的混合物来分解产物?
(3) 过量苯与1,2-二氯乙烷和苯与马来酐在无水AlCl3存在下分别相互作用,应得到什么产物?
实验三十三 二苯甲酮的制备

1 反应式
2 药品与试剂
无水三氯化铝,无水苯,苯甲酰氯,5%氢氧化钠水溶液,浓盐酸
3 实验步骤与操作
在100mL三口烧瓶上,配置搅拌器、恒压滴液漏斗、温度计和回流冷凝管,冷凝管上端依次配置氯化钙干燥管和盛有碱液的气体吸收装置。在通风橱内称取7.5g粉状无水三氯化铝 [1]后迅速投入三口烧瓶中,加入30mL苯。室温下边搅拌边自滴液漏斗滴加6mL苯甲酰氯。滴液以控制反应温度处于40℃为宜。瓶内混合物开始激烈反应,并伴有氯化氢气体产生,反应液逐渐呈褐色。约10min左右滴加完毕,在60℃水浴上加热并搅拌约1.5h。冷却后,将反应液慢慢倒入盛有50mL冰水的烧杯中,有沉淀物析出。搅拌下,用滴管慢慢加入2~3mL浓盐酸,直至沉淀全部分解。用分液漏斗分出有机相,用苯萃取水相两次(2×15mL). 合并有机相,依次用20mL水和20mL 5%氢氧化钠水溶液洗涤,然后再用水洗涤2~3次(每次20mL),直至有机相呈中性。无水硫酸镁干燥、蒸除溶剂,即得粗产品[2]。然后减压蒸馏[3],收集187~190℃/2.0kPa(15mmHg)馏分,冷却后固化,即得纯品[4]。称重、并计算产率。
4注意事项
[1] 无水三氯化铝极易吸潮,与潮湿空气接触会产生刺激性的氯化氢气体,称重、研细及投料等操作要迅速。
[2] 粗产品常呈粘稠状,这是由于溶剂未除尽或不同晶型的存在,导致熔点下降所致。
[3] 如果不经减压蒸馏,粗产品可用石油醚(60~90℃)重结晶。干燥后称重,测熔点并计算产率。
5 思考题
(1)用酰氯作酰基化试剂进行傅-克反应时,为什么要用过量许多的无水三氯化铝作催化剂?
(2)酰基化反应结束后为什么要用酸处理?
5.5 有机光化学反应
实验三十四 四苯基乙二醇的制备
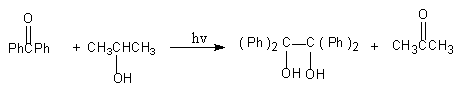
1 反应式
2 药品与试剂
二苯甲酮,异丙醇,冰醋酸
3 实验步骤与操作
在1支36mL试管中[1],加入1.8g二苯甲酮,加2ml异丙醇温热溶解。再加1滴醋酸后用异丙醇加满试管,以排除空气,用塞子塞紧。然后放在紫外灯下照射[2], 约0.5h后有无色晶体析出[3],继续照射3h, 即有满意的结晶,过滤,干燥,得四苯基乙二醇。称重、计算产率、测熔点。
4 注意事项
[1] 试管用石英材料制成,因为石英材料只滤去200nm以下的光,可以让较短波长的紫外光通过。普通玻璃吸收紫外光,使反应难以进行。
[2] 也可置于强太阳光下照射1小时.
[3] 光化学反应主要在紧靠器壁的很薄的一层溶液中进行,因此经常摇动,防止晶体结在器壁上,对反应有利。
5 思考题
(1)光化学反应能否在红外灯下进行,为什么?
3.6 Williason 醚合成法
实验三十五 β-萘乙醚的制备
1 反应式

2 药品与试剂
β-萘酚,无水乙醇,氢氧化钠,溴乙烷
3 实验操作与步骤
在50ml圆底烧瓶中,加入20mL无水乙醇和0.9g氢氧化钠,振摇,待氢氧化钠溶解后,再将2.9gβ-萘酚[1] 溶入其中,并加入1.5mL溴乙烷。投入两粒沸石,并配置回流冷凝管,加热回流2h。反应结束后,将反应装置改为蒸馏装置,蒸馏回收大部分乙醇。将蒸馏瓶内残余物倒入盛有30mL的冰水中,充分搅拌,倾去水层,粗产品用水洗涤两次。粗品可用95%的乙醇重结晶,干燥,称重,计算产率,测熔点。
4 注意事项
[1] β-萘酚有毒,对皮肤、粘膜有强烈刺激作用,称取时要小心。若触及皮肤,应立即用肥皂水清洗。
5 思考题
(1) 以威廉逊制醚法制取β-萘乙醚时,为什么要用β-萘酚和溴乙烷作原料,而不是以2-溴萘和乙醇作原料?
(2) 在制取β-萘酚盐时,用的是氢氧化钠的乙醇溶液,这里可以用氢氧化钠水溶液代替吗?
(3) 在反应后处理中,如果不先蒸除乙醇而直接将反应混合物倒入水中,对实验结果会有什么影响?
3.7 酯化反应
实验三十六 乙酸乙酯的制备

1 反应式
2 药品与试剂
无水乙醇(AR),冰醋酸(AR),浓硫酸(AR),无水硫酸镁,饱和碳酸钠溶液,饱和食盐水溶液,饱和氯化钙溶液
3 实验步骤与操作
在50ml圆底烧瓶中加入9.5mL(约0.2mol)无水乙醇和6mL(约0.1mol)冰醋酸,在振荡和冷却下加入2.5mL浓硫酸,混匀后,投入几粒沸石,装上回流冷凝管。缓缓加热回流0.5h, 反应物冷却后,将回流装置改成蒸馏装置,蒸出生成的乙酸乙酯,直到馏出液体积约为反应液总体积的1/2为止。在馏出液中慢慢加入饱和碳酸钠溶液,并不断振荡,直至不再有二氧化碳气体产生(或调至石蕊试纸不再显酸性)。然后将混合液转入分液漏斗,分去下层水溶液,有机层用5mL饱和食盐水洗涤[1],再用5ml饱和氯化钙洗涤,最后用水洗一次,分去下层液体。有机层倒入一干燥的三角烧瓶中,用无水硫酸镁干燥[2],粗产物约6.8g(产率约77%), 将干燥的有机层进行蒸馏,收集73~78℃的馏分,产量约4.2g(产率约48%)
纯乙酸乙酯为无色而有香味的液体,bp为77.06℃, nd20为1.3723。
4 注意事项
[1]当有机层用碳酸钠洗过后,若紧接着就用氯化钙溶液洗涤,有可能产生絮状碳酸钙沉淀,使进一步分离 变得困难,故在两步操作间必须用水洗一下。由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以实际上用饱和食盐水进行水洗。
[2] 酯层中的乙醇不除净或干燥不够时,由于形成低沸点的共沸混合物,从而影响酯的产率。
5 思考题
(1) 酯化反应有什么特点?
(2) 本实验中若采用醋酸过量的做法是否适合?为什么?
(3)蒸出的粗乙酸乙酯中主要有哪些杂质?如何除去?
实验三十七 乙酸异戊酯的制备

1 反应式
2 药品与试剂
异戊醇,冰醋酸,浓硫酸,10%碳酸氢钠水溶液,无水硫酸镁
3 实验步骤与操作
将10ml异戊醇和10ml冰醋酸加入到50mL干燥的圆底烧瓶中,在振摇下加入2.5mL浓硫酸,再投入几粒沸石并配置回流冷凝管,回流1h。冷却,将反应混合物倒入分液漏斗。用少量冷水洗涤反应瓶,洗涤液也倒入分液漏斗。静置分层,分出水层[1]。有机层经10%碳酸钠水溶液洗涤后,再用水洗涤两遍[2]。除水层后将酯层转入锥形瓶,用无水硫酸镁干燥。粗产品经过过滤转入蒸馏瓶,蒸馏收集138~142℃馏分。称量、测折光率并计算产率。
4 注意事项
[1] 如果两相分层困难,可以向分液漏斗中加入10ml饱和食盐水,振摇后静置分层。
[2] 一定要将有机相洗涤至中性,否则,在蒸馏过程中易发生分解。
5 思考题
(1)如果反应瓶潮湿有水,会对酯化反应产生什么影响?
3.8 Perkin反应
实验三十八 香豆素的制备
1 反应式

2 药品与试剂
水杨醛,醋酸酐,三乙胺,碳酸钠
3 实验步骤与操作
在50ml圆底烧瓶中,依次加入1.9mL水杨醛,2mL三乙胺及5mL醋酸酐,投入2粒沸石,配置回流冷凝管,并接一氯化钙干燥管,将混合物加热回流2h。回流结束后,将反应混合物趁热转入盛有20mL水的250mL三口烧瓶中,用少量热水冲洗反应瓶,以使反应物全部转入三口烧瓶中,然后,进行水蒸气蒸馏,蒸除未反应完的水杨醛。蒸馏至馏出液为清亮时,再蒸馏一段时间,间或取出馏液试样用几滴稀FeCl3溶液检验,直到无显色反应,蒸馏即到终点。
水蒸汽蒸馏结束后,待蒸馏烧瓶中的剩余物稍稍冷却,在充分搅拌下,慢慢加入碳酸氢钠粉末,直到溶液呈弱酸性(pH=8)。将烧瓶置入冰浴中使晶体析出。如果无结晶析出,可投入一粒香豆素晶种或用玻璃棒在烧瓶壁上摩擦以诱使结晶析出。经过滤,用少许冷水洗涤,即得香豆素粗产品。
滤液中含有副产物邻-乙酰氧基肉桂酸,可用20%盐酸酸化,经过滤收集沉淀物,沉淀物可用水-乙醇混合溶剂重结晶,即得邻-乙酰氧基肉桂酸,mp153~154℃。
香豆素粗品可用水重结晶:1g粗品加200mL水,煮沸15min。稍冷,加入半匙活性炭,再沸煮3min,趁热过滤。将滤液转至烧杯中,投入1~2粒沸石,加热沸煮直到溶液体积剩下约80mL为止。待溶液稍冷却后,将烧杯置入冰浴之中,使香豆素晶体充分析出,然后过滤,收集固体产品,干燥,称量,测熔点并计算产率。香豆素粗品也可用1:1的乙醇-水溶液进行重结晶。
4 注意事项
[1] 如果一次实验未完成,可中途停止加热。但是当重新加热时,应再投进几粒新沸石。
[2] 酚类化合物可以与FeCl3溶液形成显色配合物。
5 思考题
(1)实验中三乙胺起什么作用,可否用其他化合物替代?试举例说明。
(2)本实验有何副反应,如何分离副产物?
(3)在水蒸汽蒸馏过程中依据什么原理来确定蒸馏终点?
3.9 Knoeveragle反应
实验三十九 肉桂酸的制备

1 反应式
2 药品与试剂
苯甲醛,丙二酸,吡啶,哌啶,轻石油醚(bp40~60℃),碳酸钾,盐酸(2M)
3 实验步骤与操作
在100mL锥形瓶中加入8.0g碳酸钾、20mL水和约5mL的苯甲醛将之倒入一大试管中,半小时后,出现上层为苯甲醛的清晰的两相[1]。在另一100mL的锥形瓶中加入31g(30mmol)丙二酸和5ml的吡啶,热水浴温和加热使丙二酸溶解。用滴管小心从试管中吸取3ml的上层有机层(苯甲醛)加到丙二酸的吡啶溶液中。加入催化剂哌啶(1滴), 混合物水浴加热。
反应可根据释放出的CO2的速度确定其完成程度(约半小时),反应完成后,加入50mL 2M盐酸中,固体释出,用布氏漏斗抽滤,在漏斗中依次用20mL 2M盐酸和20mL水和20mL轻石油醚洗涤,抽干,将晶体转入预先称重过的100mL烧杯中,在80℃烘箱中干燥,称重,计算产率和测定熔点。
4注意事项
[1] 这一步是为了除去苯甲醛中可能有被氧化的苯甲酸。也可将苯甲醛重蒸.
5 思考题
(1) 提出形成(E)-3-苯基丙烯酸(肉桂酸) 的反应机理,在该反应条件下为什么得到(E)异构体?
(2)

指出制备下列产物所用原料及反应条件。

(3) 比较下列化合物中脱质子的难易程度。
3.10 Claison-Schmidt 反应

实验四十 苄叉丙酮和二苄叉丙酮的制备
1 反应式
2 药品与试剂
苯甲醛,丙酮,2M氢氧化钠,固体氢氧化钠,乙醚,稀盐酸,轻石油醚(bp40~60℃),乙醇,乙酸乙酯。
3 实验步骤与操作
(1) 苄叉丙酮的制备
100mL锥形瓶中,依次加入8.0mL(18.4g,80mmol)苯甲醛,16mL(12.7g, 0.22mmol)丙酮、2.0mL 2.5M的氢氧化钠溶液,磁力搅拌90分钟。反应完成后慢慢加入稀盐酸使反应液刚好呈中性,将混合物转移至分液漏斗中,用15mL乙醚清洗锥形瓶,分出有机层,水层再用15mL乙醚萃取一次,合并有机层,15mL水洗涤,无水硫酸镁干燥,过滤, 旋转蒸发除溶剂。水泵减压蒸馏, 收集130~145℃馏份,称重并计算产率。
(2) 二苄叉丙酮的制备
将2.5g固体氢氧化钠溶解于25ml水中,加入20mL乙醇,用流动的水冷却,再在盛有2.5mL(2.6g, 25mmol)的苯甲醛的丙酮100mL锥形瓶中,用滴管加入0.9mL(0.75g, 13mmol)丙酮,再加入上述氢氧化钠的乙醇溶液,化合物在20~25℃(必要时可冷却)[1],磁力搅拌15分钟,抽滤析出的沉淀,用冷水彻底洗涤至中性, 将产物于滤纸上室温干燥,用约每克2.5mL的乙酸乙酯重结晶,干燥,称重,计算产率,测定熔点。
4注意事项
[1] 若反应温度太高,副产物多,影响产率.
5 思考题
(1) 本实验中可能会产生哪些副反应?若碱的浓度偏高时有什么不好?
3.11 烯胺的合成应用
实验四十一 2-乙酰基环己酮的制备
1 反应式

2 药品与试剂
环己酮,四氢吡咯,对甲苯磺酸,乙酸酐,甲苯,盐酸(3M)
3 实验步骤与操作
100mL圆底烧瓶中依次加入5.0mL(4.7g,48mmol)环己酮、 4.0mL(3.4g, 48mmol)四氢吡咯[1]、0.1g对甲苯磺酸[2] 和几粒沸石。装置如图3.27。水分器上接一装有CaCl2干燥器的回流冷凝管,加热回流,维持约一小时后,让其溶液稍微冷却,移走水分器。改装成蒸馏装置。蒸出四氢吡咯和少量水,继续蒸馏直至溶液维持在108~110℃,停止加热,冷至室温,拆除蒸馏装置,加入乙酸酐溶液(4.5mL, 48mmol乙酐溶于10ml甲苯中),烧瓶用塞子塞紧,室温静置24小时以上,然后加入5mL水,安装回流装置,混合物回流半小时后冷至室温,并转移到50ml的盛有10mL水的50ml分液漏斗中。再用10mL水洗,无水硫酸镁干燥,过滤, 除去干燥剂。旋转蒸发溶剂后,将剩余物转至小蒸馏烧瓶中,在约15mmHg时,减压蒸馏收集产物,称重并计算产率。
4 注意事项
[1] 四氢吡咯有腐蚀性, 易燃, 恶臭.
[2] 也可用四氯化钛作催化剂.
5 思考题
(1) 如何确定2-乙酰环己酮的烯醇式含量?
(2) 为什么制备烯胺时常用环状的仲胺而很少用链状的仲胺。
实验四十二 7-氧代辛酸的制备
1 反应式

2 药品与试剂
2-乙酰环己酮,乙醚,氯仿,60%的氢氧化钾溶液,浓盐酸
3 实验步骤与操作
50ml圆底烧瓶中加入1.40g (10mmol) 2-乙酰环己酮、3mL 60%氢氧化钾溶液[1]。用沸水(蒸汽)浴加热15分钟。冷却后加30ml水,用浓盐酸调至pH在7~8,将溶液移入分液漏斗中,用2×5mL乙醚萃取,分出乙醚层。水相滴加浓盐酸,使之呈强酸性(pH1)后,用3×10mL氯仿萃取,MgSO4干燥,旋转蒸发除去溶剂得产物,称重,计算产率。
4 注意事项
[1] 浓氢氧化钾溶液具有腐蚀性.
5 思考题
(1) 写出2-乙酰环己酮转变成7-氧代辛酸的反应机理。
3.12 Wittig 反应
实验四十三 E-二苯乙烯的制备
1 反应

2 试剂
三苯膦,苄氯,苯甲醛,二甲苯,金属钠,无水乙醇
3 实验步骤与操作
3.1 氯化苄基三苯膦的制备
将0.7克三苯基膦(0.0027mol), 2.0g氯苄(0.00796mol) [1] 溶于2mL二甲苯中,在搅拌下,加热回流1.5h。冷止室温后再用冷水或冰水浴冷却, 使晶体完全析出,抽滤,干燥之。产物为白色晶体,产率为87%,熔点为311~313℃。
3.2 反-二苯乙烯的制备
将0.78g苄基膦盐(0.002mol), 0.24g新蒸的苯甲醛(0.0023mol)溶于40mL无水乙醇中并加入0.05g金属钠, 室温下搅拌1.5h后,停止反应。蒸去反应混合液中的部分乙醇,冷至室温,将残留物用冰水浴冷却至晶体完全析出,抽滤,收集晶体并干燥之[2]。产物为无色晶体. 熔点:123~124℃。
4 注意事项
[1] 有机磷化物有毒;氯苄具有刺激性和催泪性,慎防上述物质与皮肤接触或吸入其蒸气。
[2] 用Witting反应制烯烃,在本实验条件下应得到顺式与反式两种异构体,其中以反式为主。
5 思考题
(1) 三苯亚甲基膦能与水起反应,三苯亚苄基膦则在水存在下可与苯甲醛反应,并主要生成烯烃,试比较二者的亲核活性并从结构上加以说明。
(2) Witting反应制烯烃,一般以反式为主, 试解释这一反应的立体选择性。
3.13 Hofmann 重排反应
实验四十四 邻氨基苯甲酸的制备
1 反应式

2 药品与试剂
酞酰亚胺,溴,氢氧化钠,浓盐酸
3 实验步骤与操作
100mL锥形瓶中溶解8.0g NaOH于30mL蒸馏水中,用冰浴冷却溶液,并不断搅拌,再注入2.1mL(6.5g, 41mmol)溴[1],混合物剧烈搅拌直至溴反应完[2]。混合物冷至0℃,继续搅拌,将5.98g(40mmol)精细状酞酰亚胺加到溶液中,随后再加入5.5gNaOH溶于20mL水的溶液。移走冰浴,让混合物温度升高到70℃。继续搅拌10分钟,再用冰浴冷却,搅拌下,用滴管小心滴加浓盐酸(约15mL)至溶液刚好呈中性,将混合物转移到500mL烧杯中,加入约5mL冰醋酸,析出邻氨基苯甲酸,固体物用10mL冷水洗涤后,溶解于少量的沸水中,活性炭脱色,趁热过滤, 滤液用冰水冷却,抽滤,100~120℃干燥,称重,测熔点。
4注意事项
[1] 溴是氧化剂,有毒,应在通风橱中进行。
[2] 可通过观察溴的颜色来判断溴是否反应完。
5 思考题
(1)为了分离产物,为什么要小心中和反应液。
(2)写出Hofmnn重排反应的机理。
3.14 Breckmann重排反应
实验四十五 4—乙酰苯胺的制备
1 反应式

2 药品与试剂
对苯乙酮,乙醇,醋酸钠,磷酸,盐酸,浓氨水
3 实验步骤与操作
3.1 对溴苯乙酮肟的制备
50mL圆底烧瓶中加入8.0g(40mol)对溴苯乙酮,用20mL乙醇溶解,再加入4.9g(70mmol)盐酸,5.5g(40mmol)碳酸钠溶于15mL水的溶液。混合物水浴回流20分钟,然后趁热快速过滤,滤液冰水冷, 肟析出,抽滤,用少量的50%乙醇洗涤,抽滤,干燥。称量,测熔点。
3.2 Beckmann重排
100mL锥形瓶加入约50g的多聚磷酸,5.0g由上一步制得的肟,混合物在沸水浴上加热10分钟,并用玻棒不断搅拌,此后,将热的混合物小心地加到100g碎冰中,用玻棒搅拌直到粘稠的块状分散开来。产物抽滤,用冷水洗涤,至不再呈酸性为止,抽滤,干燥,计算粗产物的产率。取部分粗产物用乙醇重结晶,得纯品,测熔点。
4注意事项
[1] 多聚磷酸是强腐蚀剂,取用时应十分小心.
5 思考题
(10) 写出Beckmann重排机理.
3.15 安息香缩合反应
实验四十六 苯偶姻的制备

1 反应式
2 药品与试剂
苯甲醛,维生素B1,氢氧化钠(10%),95%乙醇
3 实验步骤与操作
50mL圆底烧瓶中, 加入1.75g(0.005mol) 维生素B1[1] 、3.5mL蒸馏水和15mL95%乙醇, 摇匀溶解后将烧杯置于冰水浴中冷却. 同时取5mL10%氢氧化钠溶液于一支试管中,也置于冰水浴中冷却。在冰水浴冷却下,将冷透的氢氧化钠溶液[2] 逐滴加入反应瓶中,然后加入10mL(10.5g,0.1mol)新蒸的苯甲醛,充分摇匀,调节反应液的pH为9~10。移走冰水浴,加入几粒沸石,装上回流冷凝管,将混合物置于60~75℃水浴中温热1.5h (反应后期可将水浴温度升高到80~90℃),其间注意摇动反应瓶且保持反应液的pH为9~10(必要是可滴加10%NaOH溶液),等反应混合物冷至室温后将烧瓶置于冰水中使结晶析出完全[3]。抽滤并用2×20mL冷水洗涤结晶,干燥,称重。
粗产物可用95%乙醇重结晶,必要时可加入少量活性炭脱色,产量为6g(产率为60%), 测定熔点。
纯安息香为白色针状结晶,mp为137℃。
4注意事项
[1] 应使用新开瓶或原封的、保管良好的VB1;用不完的应尽快密封保存在阴凉处。
[2] VB1溶液和NaOH溶液在反应前要用冰水充分冷透,否则VB1的噻唑环在碱性条件下易开环失效,是实验失败。
[3] 若冷却太快,产物易呈油状析出,可重新加热溶解后在慢慢冷却重新结晶,必要时可用玻璃摩擦瓶壁诱发结晶。
5 思考题
(1) 安息香缩合、羟醛缩合、歧化反应有何不同?
(2) 为什么加入苯甲醛后,反应混合物的pH要保持在9~10?溶液的pH过低或过高有什么不好?
(3) 为什么要向VB1溶液中加入稀NaOH溶液?若用浓碱,将发生什么变化?
3.16 氧化反应
实验四十七 二苯基乙二酮的制备

1 反应式
2 药品与试剂
安息香,浓硝酸,稀碱(液95%),乙醇
3 实验步骤与操作
100mL圆底烧瓶中加入4.2g安息香(0.02mol)和14mL浓硝酸(20g;0.22mol)混合均匀。在冷凝管上端接一吸收装置, 用稀碱液吸收放出的氧化氮气体。在水浴中加热10~12min, 并间隙振摇烧瓶。在加热过程中固体物逐渐溶解,同时生成油状物。回流1.5小时后, 冷却,加入75mL冰水,析出黄色结晶,在冰浴中冷却使晶体析出完全。抽虑,用少量水洗去硝酸。干燥后,粗产物用95%乙醇重结晶,得黄色针状晶体3.2g(产物77%)。熔点94~95 oC。
4注意事项
[1] 浓硝酸具有强氧化性和腐蚀性。操作时必须戴防护手套,并且在通风橱中量取。
5 思考题
(1) 在反应过程中固体渐渐溶解,同时形成了油状物,油状物是什么?
(2) 从结构特点出发说明二苯基乙二酮为什么呈黄色结晶?
实验四十八 己二酸的制备
1 反应式

2 药品与试剂
环己醇,硝酸, 钒酸铵,稀碱液,
3 实验步骤与操作
在装有回流冷凝管、温度计和滴液漏斗的50mL三颈烧瓶中,放置6mL(7.9g,0.06mol)50% 硝酸[1]及少许钒酸铵[2](约0.01g),并在冷凝管上接一气体吸收装置,用稀碱液吸收反应过程中产生的二氧化氮气体。三颈烧瓶用水浴预热到50℃左右,移去水浴,自滴液漏斗先滴入5~6滴环己醇[3],同时加以摇动,至反应开始放出二氧化氮气体,然后漫漫加入其余部分的环己醇,总量为2mL(约2g,0.02mol),调节滴加速度,使瓶内温度维持在50~60℃之间(在滴加时经常加以摇动)。温度过高时,可用冷水浴冷却,温度过低时,则可用水浴加热,滴加完毕约需5min。加完后再继续震荡,并用80~90℃的热水浴加热10min,至几乎红棕色气体放出为止。然后将此热液倒入50mL的烧杯中,冷却后析出己二酸,抽滤,用15mL冰水洗涤,干燥,粗产物约2g。用水重结晶。产量约1.7g(产率约58%),熔点153℃。
4 注意事项
[1] 环己醇与浓硝酸切不可用同一量筒量取,两者相遇会发身发生剧烈反应,甚至发生以外。
[2] 钒酸铵不可多加,否则产品发黄。
[3] 此反应为强烈防热反应,滴加速度不宜过快,以避免反应过剧烈而引起爆炸。一般可在环己醇中加入0.5mL水,一是减少环己醇因粘稠带来的损失,二是避免反应过于剧烈。
5 思考题
(1) 为什么要严格控制该反应的温度?
(2) 用同一量筒量取硝酸和环己醇有什么不好,为什么?
3.17 还原反应
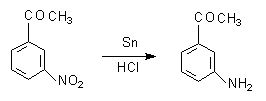
实验四十九 3-氨基苯乙酮的制备
1 反应式
2 药品与试剂
3-硝基苯乙酮,粒状锡,浓盐酸,氢氧化钠(40%)
3 实验步骤与操作
100mL圆底烧瓶放入3.3g(28ml)剪碎的锡箔, 安装回流冷凝管和磁力搅拌,往瓶内加入1.65g(10mL)3-硝基苯乙酮,24mL水和9ml浓盐酸[1],混合后搅拌,然后用沸水浴加热1.5小时,混合物冷却至室温,抽滤,滤液在搅拌和冷却下加入20mL 40%氢氧化钠溶液。黄色沉淀析出。抽滤,用水充分洗涤至呈中性。将粗产物用最少量的热水溶解,趁热过滤,冷却,结晶析出。抽滤,干燥,称重,计算产率,测熔点。
4 注意事项
[1] 浓盐酸有腐蚀性。
5 思考题
(1)讨论用锡和盐酸还原硝基的机理,反应的中间体是什么?
实验五十 3-硝基-1-苯乙醇的制备
1 反应式

2 药品与试剂
3-硝基苯乙酮,氢氧化钠,乙醇,乙醚,甲苯
3 实验步骤与操作
100mL锥形瓶中溶解1.6g(10mmol)3-硝基苯乙酮于热乙醇中, 在搅拌、冰水浴冷却下,分批加入0.4g(12mmol)硼氢化钠。混合物在室温下搅拌15分钟,加入15mL水,再加热回流2分钟,混合物冷却至室温。移入分液漏斗,用2×20mL乙醚萃取。有机层用无水硫酸镁干燥, 过滤, 旋转蒸发除溶剂, 内容物冰冷, 结晶析出, 用小量的甲苯重结晶, 计算产率, 测熔点.
4 注意事项
[1] 硼氢化钠系强碱性试剂, 很易吸潮, 当心接触到皮肤.
5 思考题
(1) 讨论硼氢化钠还原羰基的机理.
(2) 用什么试剂既可还原羰基又可还原硝基?
3.18 乙酰乙酸乙酯及其合成应用
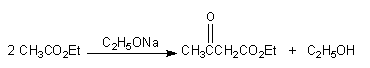
实验五十一 乙酰乙酸乙酯的制备
1 反应式
2 药品与试剂
金属钠, 二甲苯,乙酸乙酯,50%醋酸,苯,pH试纸
3 实验步骤与操作
将0.9g(约0.04mol)清除掉表面氧化膜的金属钠放入一装有回流冷凝管的50ml圆底烧瓶中。立即加入5ml干燥的二甲苯[1],将混合物加热直至金属钠全部熔融,停止加热,拆下烧瓶,立即用塞子塞紧后包在毛巾中用力振摇。,使钠尽可能成小而均匀的小珠。随着二甲苯逐渐冷却,钠珠迅速固化。待二甲苯冷却至室温后,将二甲苯倾去,立即加入10mL(约0.1mol)精制过的乙酸乙酯,迅速装上带有氯化钙干燥管的回流冷凝管,反应立即开始。反应液处于微沸状态。若反应不立即开始,可用小火直接加热,促使反应开始后即移去热源。若反应过于剧烈则用冷水稍微冷却一下。待剧烈反应阶段过后,利用小火保持反应体系一直处于微沸状态,至金属钠全部作用完毕(约需2h)。反应结束时,整个体系为一红棕色的透明溶液(但有时也可能夹带少量黄白色沉淀。)
待反应物稍冷后,将圆底烧瓶取下。然后一边振荡一边不断加入50%的醋酸,直至整个体系呈弱碱性(pH=5~6)为止[2]。将反应液移入分液漏斗中,加入等体积饱和食盐水,分出有机层,水层用8ml苯萃取。合并有机层,无水硫酸镁干燥。转移入蒸馏烧瓶中,水浴蒸去苯和未作用的乙酸乙酯。当馏出液温度升至95℃时停止蒸馏。
将瓶内剩余液体进行减压蒸馏[3],收集54~55℃/931Pa(7mmHg)的馏分即为产品,产量约为1.8g(产率约为35%)。纯乙酰乙酸乙酯的bp为180。4℃(同时分解), 为1.4194
4注意事项
[1] 一般要求金属钠全部消耗掉,但极少量未反应金属钠并不妨碍进一步操作。
[2] 要注意避免加入过量的醋酸,否则会增加酯在水层中的溶解度而降低产率。另外,当酸度过高时,会促进副产物“去水乙酸”的生成,因而降低产品产率。
[3] 乙酰乙酸乙酯在常压下很容易分解,分解产物为“去水乙酸”,这样会影响产率,故应采用减压蒸馏法。
5 思考题
(1) 本实验所用仪器未经干燥处理,对反应有何影响?
(2) 加入50%的醋酸及氯化钠饱和溶液的目的何在?
(3) 取2~3滴产品溶于2ml水中,加1滴1%的三氯化铁溶液,会以生什么现象?如何解释?
实验五十二 2-庚酮的制备
1 反应式

2 药品与试剂
金属钠,二氯甲烷,5%氢氧化钠,20%硫酸溶液,40%氯化钙溶液,无水硫酸镁,无水乙醇,碘化钾,乙酰乙酸乙酯,正溴丁烷,1%盐酸
3 实验步骤与操作
在干燥的100mL三颈烧瓶上,装置冷凝管和恒压滴液漏斗,冷凝管上端装一氯化钙干燥管。瓶中加入1.15g(0.05mol)切成小块的金属钠,由滴液漏斗逐渐加入25mL无水乙醇,控制加入速度使乙醇保持沸腾,待金属钠作用完毕后,加入0.6g粉状碘化钾,加热至沸,直至固体溶解。然后加入6.5g(0.05mol)乙酰乙酸乙酯。在加热回流下加入7.55g(0.505mol)正溴丁烷,继续回流3h[1]。
反应液冷却后,倾出上层清液,析出的盐用少量乙醇洗涤一次,和上层清液合并后蒸出乙醇,粗产物用5mL 1%的盐酸洗涤,分出油层,水层用5mL二氯甲烷萃取液合并,用4mL水洗涤。加入30mL 5%的氢氧化钠溶液,室温搅拌2.5h, 在搅拌下慢慢加入8mL 20%的硫酸溶液调节pH为 2~3,待大量二氧化碳气泡放出后,停止搅拌,改成蒸馏装置,收集馏出物。分出油层,水层用二氯甲烷萃取(2 × 5mL), 然后与油层合并,用10mL 40%的氯化钙溶液洗涤一次,再用无水硫酸镁干燥,蒸出二氯甲烷,蒸馏收集145~152 oC的馏分,产量约3.4g(产率约58%).
4注意事项
[1] 在回流过程中, 由于溴化钠的生成会出现剧烈的崩沸现象. 如采用搅拌装置可避免这种现象.
5 思考题
(1) 待金属钠作用完毕后加入碘化钾的目的时什么?
(2) 在本实验中, 若用1,3-二溴丁烷代替正溴丁烷将得到什么产物.
3.19 Cannizzaro 反应
实验五十四 苯甲醇和苯甲酸的制备

1 反应式
2 药品与试剂
苯甲醛,氢氧化钾,乙醚,饱和亚硫酸氢钠,硫酸钠, 20%浓盐酸,刚果红试纸
3 实验步骤与操作
100mL锥形瓶中加入由9g(0.16mol) 氢氧化钾和9mL水配成的溶液,冷却至室温后,加入10.5g新蒸过的苯甲醛(10mL, 0.1mol). 用胶塞塞紧瓶口[1],用力振摇使反应物充分混合,最后成为白色糊状物,放置24h以上,并经常振摇。向反应混合物中逐渐加入足够的水(约30mL). 不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用15mL乙醚萃取三次(萃取出什么?)。合并乙醚萃取液,依次用5ml饱和亚硫酸氢钠溶液,10mL 10%Na2CO3溶液及水洗涤,最后用无水硫酸镁或无水碳酸钾干燥。
干燥后的乙醚溶液,先蒸去乙醚,再蒸馏苯甲醇,收集204~206 oC馏份.
乙醚萃取后的水溶液,用浓盐酸酸化至使刚果红试纸变蓝,充分冷却使苯甲酸析出完全。抽滤,粗产品用水重结晶,得苯甲酸4.5~5g(产率74~82%)m.p. 121~122 oC。
4 注意事项
[1] 不宜用玻璃塞
5 思考题
(1)试比较发生Cannizzaro反应与发生羟醛缩合反应的醛在结构上有何差异?
(2)本实验中两种产物是根据什么原理分离提纯的?用饱和的亚硫酸氢钠及10%NaCO3溶液洗涤的目的何在?
(3)乙醚萃取后的水溶液用浓盐酸酸化至中性是否适当?为什么?若不用试纸或试剂检验,怎样才能知道酸化已恰当?
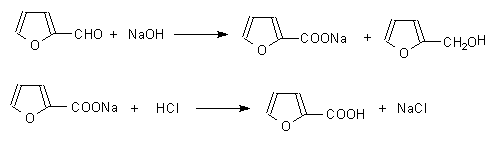
实验五十四 呋喃甲醇和呋喃甲酸的制备
1 反应式
2 药品和试剂
呋喃甲醛,氢氧化钠(33%),乙醚,盐酸(25%),刚果红试纸
3 实验步骤与操作
往100mL烧杯中,加入9.5g新蒸馏过的呋喃甲醛(8.2mL, 0.1mol)[1], 将烧杯置于冰水浴中冷却至5 oC左右。在搅拌下自滴液漏斗滴入8mL 33%的氢氧化钠溶液,保持反应在8~12 oC之间[2]。氢氧化钠溶液加完后(约20min), 在8~12 oC继续搅拌半小时,反应即可完成,得到黄色浆状物。
在搅拌下加适量的水(约8mL), 使沉淀恰好溶解,此时溶液呈暗褐色或深棕色,将溶液倒入分液漏斗中,每次用10mL乙醚萃取4次,合并乙醚萃取液,用无水硫酸镁或无水硫酸钾干燥,先蒸去乙醚再蒸馏呋喃甲醇,收集169~172 oC的馏分。称重、计算产率。
乙醚萃取后的水溶液,用25%的盐酸酸化,至刚果红试纸变蓝(约需酸8mL)。冷却使呋喃甲酸析出完全,抽滤,用少量水洗涤。粗产物用水重结晶,得白色针状结晶的呋喃甲酸。
4注意事项
[1] 新蒸过的呋喃甲醛为无色或浅黄色的液体。
[2] 反应温度若高于12 oC,则反应物温度极易升高而难以控制,致使反应物变成深红色;若低于8 oC,则反应过慢,可能积累一些氢氧化物。一旦发生反应,则过于猛烈,易使温度迅速上升,增加副反应,影响产量及纯度。由于氧化还原是在两相间进行的,因此必须充分搅拌。呋喃甲醇和呋喃甲酸的制备也可以在相同的条件下,采用反加的方法,将呋喃甲醛滴加到氢氧化钠溶液中,产率相仿。
5 思考题
(1) 怎样利用Cannizzaro反应将呋喃甲醛全部转变成呋喃甲醇?
(2) 为什么需控制反应温度在8~12 oC之间?如何控制?
(3) 如将此实验改为少量有机合成实验,欲得产品1g,设计一个实验步骤并标明原料及试剂的用量。
3.20 Diels-Alder 反应
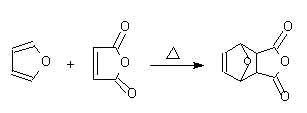
实验五十五 顺丁烯二酸酐的加成
1 反应式
2 药品与试剂
呋喃、顺丁烯二酸酐、无水乙醚
3 实验步骤与操作
50mL锥形瓶中放入研磨成细粉状的顺丁烯二酸酐[1]3.3g(0.034mol加入),加入30mL无水乙醚,振摇使顺丁烯二酸酐完全溶解(或用电磁搅拌使其溶解)。然后加入2.5ml新蒸过的呋喃(2.4g, 0.035mol), 振摇使均匀溶解,放置1~2天, 使反应进行完全。产物成结晶析出。抽气过滤,并用20mL无水乙醚洗涤晶体。晾干,约得2.6g, 熔点115~116 oC,(产率46%). 产物保存于真空干燥器中。纯粹产物的熔点为116~117 oC
4注意事项
[1] 顺丁烯二酸酐如放置过久, 需重结晶提纯. 称10克顺丁烯二酸酐加15 ml氯仿, 煮沸数分钟, 趁热过滤, 滤液冷却, 即得纯品, 抽滤, 置于干燥器中凉干.
5 思考题
(1)

写出下列Diels-Alder反应的产物:
(2) 试写出在农药氯丹的合成中所需二烯烃和烯烃的结构。

