燃烧焓的测定
一 、实验目的
1、掌握氧弹量热计的使用;用氧弹量热计测定萘的燃烧焓;
2、掌握精密贝克曼温差温度计的使用;
3、掌握氧气钢瓶的使用。
二、实验原理
称取一定量的试样置于氧弹内,并在氧弹内充入1.5 ~2.0MPa的氧气,然后通电点火燃烧。燃烧时放出的热量传给水和量热器,由水温的升高(△T)即可求出试样燃烧放出的热量: Q =K·△T
式中K为整个量热体系(水和量热器)温度升高1℃所需的热量。称为量热计的水当量。其值由已知燃烧热的苯甲酸(标样)确定。K=Q/△T ,式中△T应为体系完全绝热时的温升值,因而实测的△T须进行校正。
三、仪器与试剂
1、试剂:分析纯苯甲酸(Qv=26480 J·g-1); 煤样(工业品); 引火丝(本实验采用Ni-Cr丝(Qv=8.4 J·cm-1)。
2、仪器:HR-15A数显型氧弹量热计一台;压片机(苯甲酸和煤样各用一台);精密贝克曼温差温度计(精确至0.01℃,记录数据时应记录至0.002℃);台秤一台;分析天平一台。
四、实验步骤
1、水当量的测定
1
⑴量取10cm引火丝;在分析天平上称重。(~0.010 g)
⑵压片━━在台秤上称取苯甲酸1g ~ 1.2g ;用压片机压片,同时将燃烧丝压入。注意压片前后应将压片机檫干净;苯甲酸和煤样不能混用一台压片机。
⑶称重━━将片样表面刷净,然后在分析天平上准确称重至0.0002g。减去引火丝重量后即得试样重量。
⑷系燃烧丝━━拧开氧弹盖,将盖放在专用架上.将坩埚放在坩埚架上.然后将试样置入其中并将引火丝的两端紧在两个电极上, 用万用表检查两电极是否通路。
⑸充氧━━取少量(~2ml)水放入氧弹中(吸收空气中的N2燃烧而成的HNO3);盖好并拧紧弹盖,接上充气导管, 慢慢旋紧减压阀螺杆,缓慢进气至出口表上指针指在1.5 ~2.0MPa,充气约1min后, 取下充气管, 关好钢瓶阀门。
⑹用容量瓶取3000ml水倒入量热容器中,并将氧弹放入,检查是否漏气.
⑺将点火电电极套在氧弹上。
⑻将贝克曼温度计置入量热器中。
⑼接通电源,开动搅拌器,5min 后,开始记录时间t-温度T数据。(即使量热计与周围介质间建立起稳定的热交换后开始记录数据)整个实验过程中,数据记录分前期、主期和末期三个阶段:前期是试样燃烧以前的阶段。每隔1min 读取温度一次,共六次。目的是为了观察在实验开始温度下,量热体系与环境的热交换情况。主期是试样燃 2
烧,并把热量传给量热计的阶段。在前期最后一次读取温度的同时。按点火开关点火,并每0.5min 读取温度一次,直至温度持平或开始下降。
末期是温度持平或下降后的5min ,每0.5min读取温度一次,目的是为了观察在末期温度下,量热体系与环境的热交换情况。
⑽测温停止后,关闭搅拌器,先取下温度计放好;再取出氧弹檫干,套上放气罩释放余气,拧开弹盖,检查燃烧是否完全,(若弹中有炭黑或未燃尽的试样,表明实验失败。)若燃烧完全,则取下剩余的引火丝量取长度,求出实验消耗掉的长度。最后,将量热容器中的水倒出,用毛巾檫干全部设备,以待下次使用。
2、煤样的燃烧热的测定
操作步骤与K值测定完全相同,只是将试样换成煤样。 五、注意事项 1、每次使用钢瓶时,应在老师指导下进行。
2、接通总电源前,应检查控制器的点火开关。点火开关应处于断开状态,以免通电即点火。
3、坩埚每次使用后。应清洗干净并檫干。
4、试样燃烧热的测定和水当量的测定,应尽可能在相同条件下进行。
3
第二篇:燃烧焓的测定
 宁波工程学院
宁波工程学院
物 理 化 学 实 验 报 告
专业班级 化工 姓 名 序 号
同组姓名 指导老师刘旭锋、王婷婷实验日期20##-3-17
实验名称 实验一 燃烧焓的测定
一、实验目的
1、 用氧弹量热计测定萘的摩尔燃烧焓。
2、 了解热量计中主要部分的作用,掌握氧弹量热计的实验技术。
二、实验原理
有机物B的标准摩尔燃烧焓ΔcHθm(B,T)是指1mol指定相态的B物质在温度T和恒压(PΘ)条件下完全燃烧所放出的热量(QP),其值与以B为反应物(化学计量数 B= -1)的燃烧反应的标准摩尔反应焓变ΔcHθm相等。若将燃烧反应系统中的气体均可视为理想气体,则存在以下关系:
B= -1)的燃烧反应的标准摩尔反应焓变ΔcHθm相等。若将燃烧反应系统中的气体均可视为理想气体,则存在以下关系:
QP = QV + ΔnRT (式1)
ΔrHθm = ΔrUθm + RT B(g)(式2)
B(g)(式2)
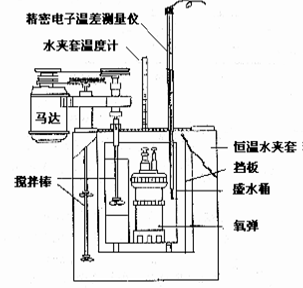
图1、氧弹式量热计原理构造结构图
本实验采用氧弹式量热计测定萘的燃烧焓,构造如图1所示。测量的基本原理是将一定量待测萘样品在氧弹中完全燃烧,燃烧时放出的热量使量热计本身及氧弹周围介质(本实验用水)的温度升高。通过测定燃烧前后量热计(包括氧弹周围介质)温度的变化值,就可以求出该样品的燃烧热。实验测得的是恒容反应热QV,通过(式1、式2)即可计算得到萘的摩尔燃烧焓ΔcHm。
用该法测定燃烧焓时要尽可能在接近绝热的条件下进行。实验时,氧弹放置在装有一定量水的内桶中,内桶外是空气隔热层,再外面是温度恒定的水套夹。整个量热计可看成是一个等容绝热系统,其热力学能变ΔU为零。其中ΔU包括样品在氧气中等容燃烧的热力学能ΔcUB,引燃丝燃烧的热力学能变ΔcU引燃丝,量热计(包括氧弹、内桶、搅拌器和温度感应器等)的热力学能变化ΔU量热计。因此,ΔU可表示为:
ΔU = ΔcUB + ΔcU引燃丝+ ΔU量热计 = 0(式3)
若已知物质的质量,等容燃烧热值及燃烧前后系统温度的变化ΔT,则上式可写成:
mB QV,B + lQl + KΔT = 0 (式4)
式中mB 样品的质量(g);QV,B为样品的等容燃烧热值(J/g);l为燃烧掉的引燃丝的长度(cm);Ql为引燃丝的燃烧热值(J/cm);K为量热计系统的热容量,即每升高1K所需吸收的热量(J/K),而真实温差ΔT可由对实测温差进行修正获得。
本实验先用已知ΔcHθm(苯甲酸,298.15K)= -3226.7 kJ/mol 来测定量热计的热容量K,之后再重复实验,测定未知样品萘的摩尔燃烧焓。其中用到的引燃丝的燃烧热值Ql = -6.699 J/cm。
由于量热计无法做到完全绝热,因此燃烧前后温度差的测量值须经雷诺温度校正图校正。
三、实验仪器、试剂
数显氧弹式量热计全套(氧弹、搅拌器、数字贝克曼温度计)、压片机、引燃丝、量筒(2000mL)、电子天平(精确到0.0001g)、直尺、充氧台、氧气钢瓶及减压阀、专用放氧阀。
萘(A.R.)、苯甲酸(A.R.)。
四、实验步骤
1、热容量K的测定
(1)准确截取15cm左右的引燃丝,然后将引燃丝中部绕成环状。
(2)苯甲酸称取约0.8~1.0g,在压片机上压成片状。将压好的样品在干净的桌面上敲击2~3次,以除去没有压紧的部分,再在分析天平上准确称量
(3)拧开氧弹盖放在专用支架上,将弹内洗干净,擦干。分别将引燃丝两端固定在氧弹两极柱上,药片置于不锈钢坩埚中,使引燃丝接触药片表面。盖上氧弹盖拧紧。
(4)打开氧气瓶阀门,调节减压阀,使压力达到1~2MPa。将氧弹置于充氧器底座上,使进气口对准充氧器的出气口。按下充氧器的充氧至充氧器压力表值约1.0MPa,用放氧阀将氧弹中的氧气放出(赶出氧弹内的空气),然后再次充入氧气约1MPa,浸入水中检查是否漏气,确认密封良好后方能进行下一步实验。
(5)将充有氧气的氧弹放入内桶底座上,检查搅拌叶片是否正常工作。用量筒量取低于室温的3000mL自来水倒入将数字贝克曼温度计的传感器竖直插入量热计盖上的孔中,其末端应处于氧弹高度1/2处。将点火插头插在氧弹电极上,装好搅拌器。打开控制箱的电源开关,按下“搅拌”键,搅动内桶水,仪表开始显示内桶水温。
(6)约5~6min后,当系统温度变化速度达到恒定时,开始初期温度读数,每隔30s读数一次。当读第十次时,同时将开关旋至点火档,仍每隔30s读一次主期温度读数,直至两次的温度读数差值小于0.002℃时,再继续读取温度10次。
(7)停止搅拌,取出温度传感器,拔掉引火导线,取出氧弹并擦干其外壳,用放气阀放掉氧弹内的氧气,打开氧弹盖,检查是否燃烧完全。若取出坩埚或氧弹内有积碳,则说明 实验失败,需重做。若无上述情况,则实验成功。取出未烧完的引燃丝,测其长度。
(8)洗净并擦干氧弹内外壁,将内桶蒸馏水倒掉,擦干全部设备。
2、萘的恒容燃烧热值的测定
称取0.6g左右的萘,实验步骤同上。
本实验注意事项:
压片时应不松不紧,以保证其可以完全燃烧,且不会散开;
引燃丝不可插入药片的小孔,以免影响点火质量。
五、数据记录与处理
室温:17.2℃ 大气压力:101.99KPa
引燃丝初始长度:15.00cm 剩余引燃丝长度:苯甲酸:6.33cm 萘:3.81cm
表1、测定苯甲酸在水夹套中的水浴温度
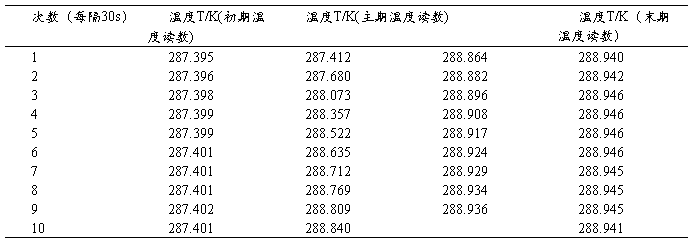
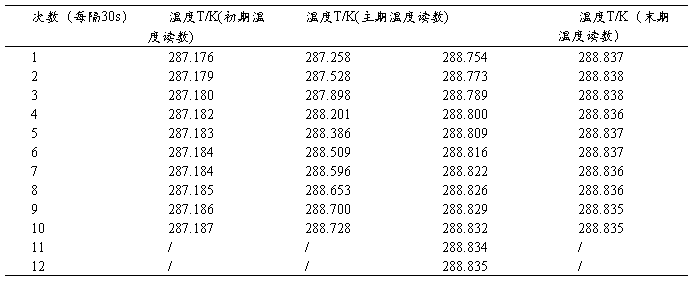
表2、测定萘在水夹套中的水浴温度
六、结果与讨论
1、苯甲酸温度变化图
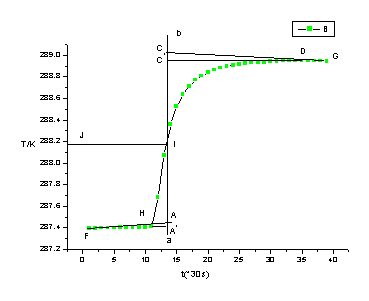
图2、苯甲酸的雷诺温度校正图
 △T = 1.575K, l:8.67cm, m(苯甲酸):0.8576g
△T = 1.575K, l:8.67cm, m(苯甲酸):0.8576g
C7H6O2(s)+ 17/2 O2(g)→ 7CO2(g)+3 H2O(l)
已知苯甲酸的△cHmθ=-3226.7kJ/mol,由ΔcHθm = ΔcUθm + RT B(g)
B(g)
可得:△cUm = -3226.7kJ/mol- 8.3145×10-3 kJ/(mol·K) ×298.15 K×(7-15/2)
=-3225.46kJ/mol,即Qv(B) 为-3225.46kJ/mol
根据式4得到:K=14.43K J/K
2、萘的温度变化图

图3、萘的雷诺温度校正图
此时测得△T=1.478K, l:11.19cm, m(萘)=0.6123g
C10H8(s)+ 12 O2(g)→ 10CO2(g)+4 H2O(l)
根据式4可得
Q(V,B)= -4471.04KJ/mol,即△cUm=-4471.04KJ/mol
由ΔcHθm = ΔcUθm + RT B(g)得:
B(g)得:
ΔcHθm=-4471.04KJ/mol + 8.3145×10-3 kJ/(mol·K) ×298.15K×(10-12)
=-4466.08KJ/mol
查手册得,萘的标准摩尔燃烧焓为-5153.9KJ/mol
误差=(5153.9-4466.08)/5153.9=12.96%
从实验结果来看,我们的实验误差很大,造成误差的原因可能有:
1、可能由仪器本身引起的;
2、没控制好氧弹式量热计夹层水和量热容器水之间的温度;
3、压片没压好;
