华 南 师 范 大 学 实 验 报 告
学生姓名 学 号
专 业 年级、班级
课程名称 实验项目 燃烧热的测定
实验类型 □验证 □设计 ■综合 实验时间 年 月 日
实验指导老师 实验评分
一、实验目的
1. 明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的区别与联系。
2. 掌握量热技术的基本原理,学会测定萘的燃烧热。
3. 了解氧弹卡计主要部件的作用,掌握氧弹卡计的实验技术。
4、学会雷诺图解法校正温度改变值。
二、实验原理
燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(Ov),恒容燃烧热这个过程的内能变化(ΔU)。在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),恒压燃烧热等于这个过程的热焓变化(ΔH)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:
DcHm = Qp=Qv +ΔnRT (1)
本实验采用氧弹式量热计测量蔗糖的燃烧热。测量的基本原理是将一定量待测物质样品在氧弹中完全燃烧,燃烧时放出的热量使卡计本身及氧弹周围介质(本实验用水)的温度升高。
氧弹是一个特制的不锈钢容器(如图)为了保证化妆品在若完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
但是,热量的散失仍然无法完全避免,这可以是同于环境向量热计辐射进热量而使其温度升高,也可以是由于量热计向环境辐射出热量而使量热计的温度降低。因此燃烧前后温度的变化值不能直接准确测量,而必须经过作图法进行校正。
放出热(样品+点火丝)=吸收热 (水、氧弹、量热计、温度计)
在盛有定水的容器中,样品物质的量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,即量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为:
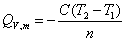 (2)
(2)
式中,Qvm为样品的恒容摩尔燃烧热(J·mol-1);n为样品的摩尔数(mol);C为仪器的总热容(J·K-1或J / oC)。上述公式是最理想、最简单的情况。
但是,由于(1):氧弹量热计不可能完全绝热,热漏在所难免。因此,燃烧前后温度的变化不能直接用测到的燃烧前后的温度差来计算,必须经过合理的雷诺校正才能得到准确的温差变化。(2)多数物质不能自燃,如本实验所用萘,必须借助电流引燃点火丝,再引起萘的燃烧,因此,等式(2)左边必须把点火丝燃烧所放热量考虑进去。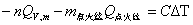 (3)
(3)
式中:m点火丝为点火丝的质量,Q点火丝为点火丝的燃烧热,为-6694.4 J / g,DT为校正后的温度升高值。仪器热容的求法是用已知燃烧焓的物质(如本实验用苯甲酸),放在量热计中燃烧,测其始、末温度,经雷诺校正后,按上式即可求出C。
雷诺校正:消除体系与环境间存在热交换造成的对体系温度变化的影响。
方法:将燃烧前后历次观察的贝氏温度计读数对时间作图,联成FHDG线如图2-1-2。图中H相当于开始燃烧之点,D点为观察到最高温度读数点,将H所对应的温度T1,D所对应的温度T2,计算其平均温度,过T点作横坐标的平行线,交FHDG线于一点,过该点作横坐标的垂线a,然后将FH线和GD线外延交a线于A、C两点,A点与C点所表示的温度差即为欲求温度的升高DT。图中AA’表示由环境辐射进来的热量和搅拌引进的能量而造成卡计温度的升高,必须扣除之。CC’表示卡计向环境辐射出热量和搅拌而造成卡计温度的降低,因此,需要加上,由此可见,AC两点的温度差是客观地表示了由于样品燃烧使卡计温度升高的数值
有时卡计的绝热情况良好,热漏小,而搅拌器功率大,不断稍微引进热量,使得燃烧后的最高点不出现,这种情况下DT仍可以按同法校正之。
三、仪器与试剂
1、仪器:
外槽恒温式氧弹卡计(一个);氧气钢瓶(一瓶);压片机 (2台);
数字式贝克曼温度计(1台);0~100℃温度计(一支);万用电表(一个);
2、试剂
标准物质:萘(A .R);苯甲酸(A.R或燃烧热专用);铁丝(10cm长);
四、实验步骤
1、测定氧氮卡计和水的总热容量C
(1)样品压片:压片前先检查压片用钢模,若发现钢模有铁锈油污或尘土等,必须擦净后,才能进行压片,用天平称取约0.5-0.6g苯甲酸,再用分析天平准确称取一根铁丝质量,从模具的上面倒入己称好的苯甲酸样品,徐徐旋紧
压片机的螺杆,直到将样品压成片状为止。抽出模底的托板,再继续向下压,使模底和样品一起脱落,然后在分析天平上准确称重。
分别准确称量记录好数据,即可供燃烧热测定用。
(2)装置氧弹、充氧气:拧开氧弹盖,将氧弹内壁擦净,特别是电极下端的不锈钢接线柱更应擦十净,将点火丝的两端分别绑紧在氧弹中的两根电极上,选紧氧弹盖,用万用表欧 姆档检查两电极是否通路,
使用高压钢瓶时必须严格遵守操作规则。将氧弹放在充氧仪台架上,拉动板乎充入氧气。
(3)燃烧温度的测定:将充好氧气后,再用万用表检查两电极间是否通路,若通路将氧弹放入量热计内简。用量筒称3L自来水,倒入水桶内,装好搅拌轴,盖好盖子,将贝克曼温度计探头插入水中,此时用普通温度计读出水外筒水温和水桶内的水温。接好电极,盖上盖了,打开搅拌开关。待温度温度稳定上升后,每个半分钟读取贝克曼温度计一次,连续记录5min,得到燃烧前的温度,此刻按下点火键,仍然半分钟读数记录一次,直到温度升到最高点开始下降后仍然记录5min作为燃烧结束后期温度,方可停止实验。
2、萘燃烧热Qv的测定
(1)称取0.5-0.6g的萘两份,同上实验操作进行两次,求平均值 (2)最后倒去自来水,擦干铜水桶待下次实验用
【注意】
1. 为避免腐蚀,必须清洗氧弹
2. 点火成败是实验关键。应仔细安装点火丝和坩埚。点火丝不应与弹体内壁接触,坩埚支持架不应与另一电极接触。
五、数据记录
1. 室温、样品质量和剩余燃烧丝质量
室温: 25.50°C 大气压: 101.200Kpa

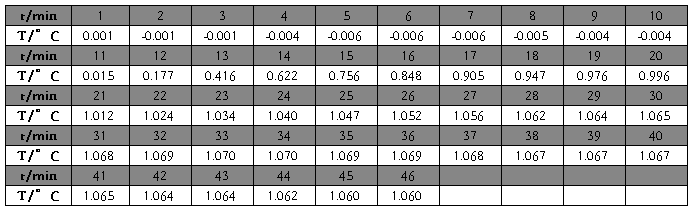
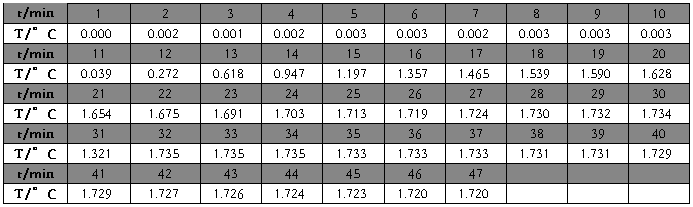
2. 温度随时间变化数据
苯甲酸(第一次)
萘
苯甲酸(第二次)

六、数据处理与计算
雷诺校正:
苯甲酸(第一次)△T=1.083533℃
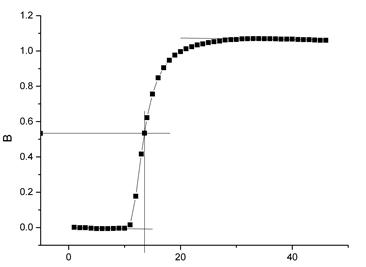
原始值
T始=-0.004℃ ;
T终=1.070℃
校正后
T’始=-8.1033e-3℃ ;
T’终=1.07543℃
△T=1.083533℃
萘 △T=1.74858℃
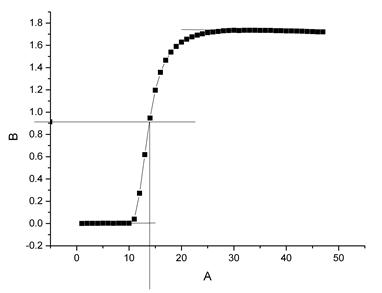
原始值
T始=0.003℃ ;
T终=1.735℃
校正后
T’始=-2.9824e-3℃ ;
T’终=1.7456℃
△T=1.74858℃
苯甲酸(第二次)△T=0.7907℃
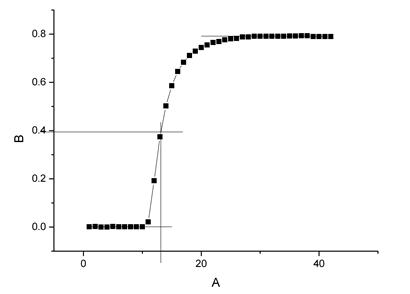
原始值
T始=0.001℃ ;
T终=0.793℃
校正后
T’始1e-3℃ ;
T’终=0.7919℃
△T=0.7907℃
2、 热计常数C计算
由图得:苯甲酸(1) △T=1.083533℃ 苯甲酸(2) △T=0.7907℃
苯甲酸恒容摩尔燃烧热为-3226.9kj/mol Δn=7-15/2=-0.5mol
由Qv=Qp-ΔnRT => Qv=-3.2256*10^3kJ/mol
再由 -nQv,m - m’点Q点 = CΔT =>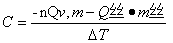
分别代入苯甲酸(1)及苯甲酸(2)的Δt解出C求出平均值
C1=15.68394845 C2=16.89593527
∴C= 16.28994186kJ/℃
3、 萘的恒容燃烧热Qv,m及恒压燃烧热Qp,m计算
同理由 -nQv,m - m’点Q点 = CΔT => Qv,m = -( CΔT - m’点Q点)/n
解得 Qv = -5190.669045 KJ/mol
由Qp = Qv +ΔnRT
Qp =-5195.644641 KJ/mol
文献值Qp = -5153.8 KJ/mol
故相对误差为: 0.812%
七、分析与讨论
1、本次实验中,氧弹卡计绝热性能一般,经过雷诺校正后校正值与测量值有较大差别。而雷诺校正使用的方法为图解法,很大部分的数值通过观察所得,因此即使保证较为准确的情况下依然存在较大误差。此为仪器造成的误差以及校正方法上的误差,难以消除。
2、在实验过程中,尤其在进行苯甲酸的压片过程,由于苯甲酸晶体结构较为难以压实,有相当部分脱落,导致称量实际样品质量相对不足。尤其第三组数据中,由于苯甲酸的量过少,反应中温度升高较少,导致进行水的热计常数C测量误差较大,也是本次实验误差较大的一个主要原因之一。在舍弃第三组数据后,热计常数误差相对变小,但仍然较大,出于实验的严谨性,故保留第三组数据。
3、本次实验测得恒压摩尔燃烧热(即反应焓)的数据偏高,主要因为测量前面提及的水的热计常数偏大(原因已在前面分析),导致最终结果偏高。
4、其它实验因素,如点火丝部分氧化、充气放气不充分等原因导致燃烧不充分,氧弹卡计密封性不足(在密闭之后浸泡入水中有漏气现象),导致测试结果中出现误差,由于原因过多且复杂,因此不逐一分析。
八、思考题
1、什么是燃烧热?它在化学计算中有何应用?
在101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol。反应热中ΔH为负,则为放热反应;为正,则为吸热反应,燃烧热为反应热的一种,其ΔH为负值含相同碳原子数的烷烃异构体中,直链烷烃的燃烧热最大,支链越多燃烧热越小。
2、什么是卡计和水的热当量?如何测得?
卡计和水当量就是量热仪内筒水温每升高一度所吸收的热量。单位是:焦耳/度 测法:用已知燃烧焓的物质,放在量热计中燃烧,测量其始、末温度,经雷诺校正后,按下式:
-nQv,m - m’点Q点 = CΔT即可求出。
3、测量燃烧热两个关键要求是什么?如何保证达到这两个要求?
实验关键:点火成功、试样完全燃烧是实验成败关键,
可以考虑以下几项技术措施:
(1) 试样应进行磨细、烘干、干燥器恒重等前处理,潮湿样品不易燃烧且有误差。 压片紧实度:一般硬到表面有较细密的光洁度,棱角无粗粒。
(2) 点火丝与电极接触电阻要尽可能小,注意电极松动和铁丝碰杯短路问题。
(3) 充足氧(1-1.5MPa)并保证氧弹不漏氧,保证充分燃烧。
(4) 注意点火前才将二电极插上氧弹再按点火钮,否则因仪器未设互锁功能,极易发生(按搅拌钮或置0时)误点火,样品先已燃烧的事故。
4、实验测量到的温度差值为何要雷诺作图法校正,还有哪些误差来源会影响测量的结果?
实际上,热量计与周围环境的热交换无法完全避免,它对温度测量值的影响可用雷诺温度校正图校正。
还可能带来误差的可能有:
(1) 实验过程中的系统误差;
(2) 可能与当天的温度和气压有关;
(3) 样品可能受潮使称量时产生误差;
(4) 样品可能中可能含有杂质。
九、参考文献
[1]傅献彩 ,沈文霞 ,姚天扬 .物理化学 第五版 上册 [M].北京 :高等教育出版社
[2]华南师范大学化学实验教学中心组织等编 .物理化学实验 [M].化学工业出版社
第二篇:华师物化实验报告 溶解热的测定
华 南 师 范 大 学 实 验 报 告
学生姓名 学 号
专 业 年级、班级
课程名称 实验项目 溶解热的测定
实验类型 □验证 □设计 ■综合 实验时间 年 月 日
实验指导老师 实验评分
一、实验目的
1、 设计简单量热计测定某物质在水中的积分溶解焓。
2、复习和掌握常用的量热技术与测温方法。
3、由作图法求出该物质在水中的摩尔稀释焓、微分溶解焓、微分稀释焓。
二、实验原理
溶解热,即为一定量的物质溶于一定量的溶剂中所产生的热效应。溶解热除了与溶剂量及溶质量有关外,还与体系所处的温度及压力有关。 溶解热分为积分溶解热和微分溶解热。
积分溶解热即在等温等压条件下,1mol溶质溶解在一定量的溶剂中形成某指定浓度的溶液时的焓变。也即为此溶解过程的热效应。它是溶液组成的函数,若形成溶液的浓度趋近于零,积分溶解热也趋近于一定值,称为无限稀释积分溶解热。积分溶解热是溶解时所产生的热量的总和,可由实验直接测定。
微分溶解热 即在等温等压下,在大量给定浓度的溶液里加入一摩尔溶质时所产生的热效应,它可表示为(ЭΔsolH/ЭnB)T、P、nA ,因溶液的量很大,所以尽管加入一摩尔溶质,浓度仍可视为不变。微分热难以直接测量,但可通过实验,用间接的方法求得。
溶解热的测量可通过绝热测温式量热计进行,它是在绝热恒压不作非体积功的条件下,通过测定量热系统的温度变化,而推算出该系统在等温等压下的热效应。
本实验采用标准物质法进行量热计能当量的标定。利用1molKCl溶于200mol水中的积分溶解热数据进行量热计的标定。当上述溶解过程在恒压绝热式量热计中进行时,可设计以下途径完成:
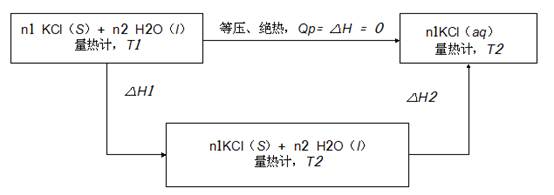
上述途径中:△H = △H1+△H2 = 0 →△H2 = -△H1
△H1 = [n1Cp,m (KCL,S)+ n2Cp,m(H2O,l)+ K ]×(T2- T1)
△H2 = n1ΔsolHm
K =-[n1Cp,m(KCL,S)+ n2Cp,m(H2O,l)+(n1ΔsolHm )/(T2- T1)]
= -[m1Cp(KCL,S)+ m2Cp(H2O,l)+(m1ΔsolHm )/(M1 △T) ]
式中m1 、m2 分别为溶解过程加入的KCl(S)和H2O(l)的质量;Cp,m为物质的恒压比热容,既单位质量的物质的等压热容,Cp(KCl,S)=0.699 kJ/(kg·K),Cp(H2O,l)= 4.184 kJ/(kg·K);M1为KCl的摩尔质量,△T =(T2- T1) 即为溶解前后系统温度的差值;ΔsolHm 为1molKCl溶解于200 molH2O的积分溶解热,其不同温度下的积分溶解热数值见附录。通过公式式可计算量热计的K值。
本实验测定1mol的KNO3溶于200mol的H2O的溶解过程的积分溶解热,途径如下
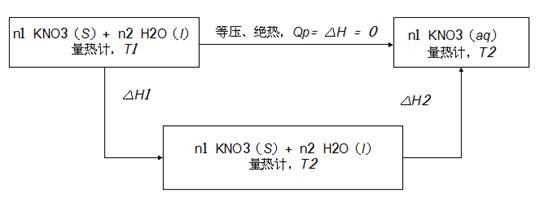
ΔsolH = -[n1Cp,m(KNO3,S)+ n2Cp,m(H2O,l)+ K ]×(T2- T1)
= -[ m1Cp(KNO3,S)+ m2Cp(H2O,l)+ K ]×(T2- T1)
摩尔溶解热 ΔsolH m = ΔsolH/n1
同理m1,m2 :分别为溶解过程加入的KNO3(S)和 H2O(l)的质量;Cp物质的恒压比热容,既单位质量的物质的等压热容,Cp(KNO3,S)=0.9522KJ.Kg-1.K-1,△T =(T2- T1 ):溶解前后系统温度的差值 (需经过雷诺校正) ;n1:所加入的KNO3摩尔数
通过公式,既可求得1mol的KNO3溶于200mol的H2O的溶解过程的积分溶解热。
三、仪器与试剂
1、仪器:
广口保温瓶(1个) 磁力搅拌器(1台) 贝克曼温度计(1台)
1/10℃温度计(1支) 容量瓶(200ml)(1个) 停表(1个)
2、试剂
氯化钾(分析纯) 硝酸钾(分析纯)
四、实验步骤
1.量热计的标定
(1)在称量瓶中准确称取4.1413克的KCl, 并记下装有KCL的称量瓶的总重量。
(2) 用容量瓶准确量取200mL室温下的 蒸馏水(密度为ρ=1Kg.dm-3),倒入广口保温杯中。
(3) 按图3-1所示,组装好简单绝热测温式量热计,并调节好贝克曼温度计。
(4) 开动磁力搅拌器,保持一定的搅拌速率,观察贝克曼温度计读数的变化,待温度变化率基本稳定后(既单位时间温度的变化值基本相同)后,每隔一分钟记录一次温度,连续记录六次,作为溶解的前期温度。
(5)打开量热计盖子,将称好的KCl迅速倒入量热计并盖好盖子,保持与溶解前相同的搅拌 速率,继续每分钟记录一次温度,直到温度不再变化时,再连续记录六个温度变化率稳定的点,此六个点作为溶解的后期温度。
(6)读取1/10℃温度计的读数,根据此温度从附表中查出相应的KCL的积分溶解热。
(7)称量已倒出KCl的空称量瓶质量,准确计算已溶解的KCL的质量。
2、 KNO3 积分溶解热的测定
(1)在称量瓶中准确称取5.6161克的KNO3 ,并记下装KNO3 的称量瓶的总重量。
(2) 用容量瓶准确量取200mL室温下的蒸馏水(密度ρ=1Kg.dm-3),倒如广口保温杯中,以下操作按上述中的(4)、(5)、(7)。
五、数据记录 室温: 22.20°C 大气压: 102.055Kpa
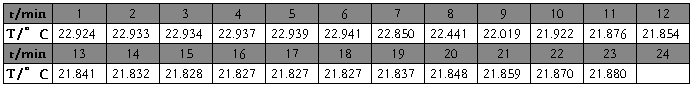
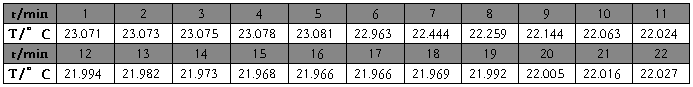
氯化钾(第一次) m=4.1610g t=22.5℃
氯化钾(第二次) m=3.7992g t=221.90℃
氯化钾(第三次) m=4.1791g t=22.80℃
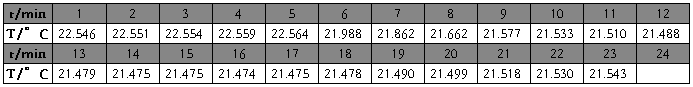
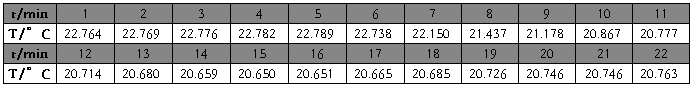
硝酸钾(第一次) m=5.6662g t=22.20℃
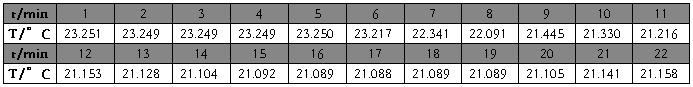
硝酸钾(第二次) m=5.6035g t=22.80℃
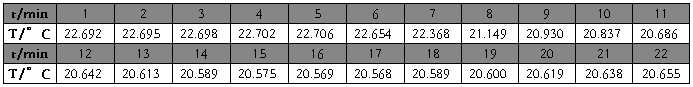
硝酸钾(第三次) m=5.6421g t=22.10℃
六、数据处理与计算
1、雷诺校正:
2、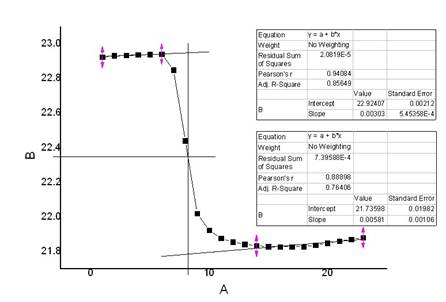
氯化钾(1)
m=4.1610g
t=22.5℃
校正后
△T=1.1655℃
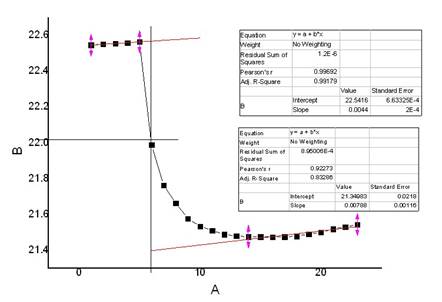
氯化钾(2)
m=3.7992g
t=221.90℃
校正后
△T=1.1712℃
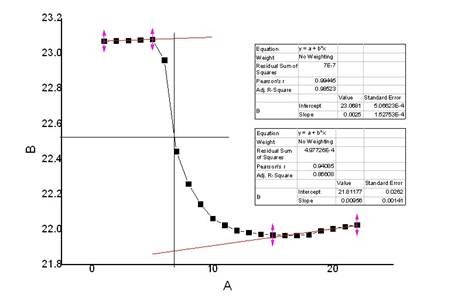
氯化钾(3)
m=4.1791g
t=22.80℃
校正后
△T=1.2079℃
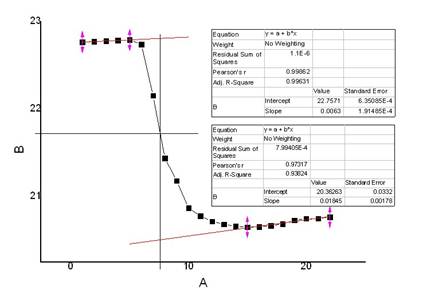
硝酸钾(1)
m=5.6662g
t=22.20℃
校正后
△T=2.3020℃

硝酸钾(2)
m=5.6035g
t=22.80℃
校正后
△T=2.2166℃

硝酸钾(3)
m=5.6421g
t=22.10℃
校正后
△T=2.2835℃
2、 量热计的K值计算
由图得:氯化钾(1)△T=1.1655℃
氯化钾(2)△T=1.1712℃
氯化钾(3)△T=1.2079℃
分别代入K = -[m1Cp(KCL,S)+ m2Cp(H2O,l)+(m1ΔsolHm )/(M1 △T]
求得:K1=0.014563364kJ/K K2=-0.056449269kJ/K K3=-0.019113618kJ/K
由于(2)中数据偏差较大,故舍去,取(1)(3)平均值K=-0.002275127
3、1mol的KNO3溶于200mol的H2O的溶解过程的积分溶解热
ΔsolH = -[n1Cp,m (KNO3,S)+ n2Cp,m(H2O,l)+ K ]×(T2- T1)
= -[ m1Cp(KNO3,S)+ m2Cp(H2O,l)+ K ]×(T2- T1)
ΔsolH m = ΔsolH/n1
分别代入求得Hm1=34.4987(kJ/mol)Hm2=33.5882(kJ/mol)Hm3=34.3667(kJ/mol)
取平均值得Hm=34.151(kJ/mol)参考文献值Hm=34.73(kJ/mol)
相对误差为: 0.666%
七、分析与讨论
1、本次实验中,在加入样品进行量热后,由于温度下降速度较快,温度读数往往来不及,导致部分读数点缺失或有偏差,在进行雷诺校正时难以做出平滑曲线,是误差来源之一。
2、由于单次实验的温度并不完全一致,在不同温度下样品的溶解速率有差别,因此是误差来源之一,但在温度差别范围之内影响不大,可以忽略。
3、在实验过程中,对应于第(2)组氯化钾,由于实验操作不当导致部分样品撒落,样品质量偏小,误差较大,故在数据处理中舍弃,未参与处理,故无影响。
4、实验仪器,保温瓶的绝热性能一般,兼之样品为开盖式加热,不可避免有较多的热交换,故,因此温度差值偏小,这是实验误差主要来源。与参考文献比对,与事实情况接近。
5、实验为了加速溶解充分,使用了磁子搅拌器,属于机械搅拌。在此过程中会时保温瓶内温度会不断升高,导致温度差值偏小,这也是主要误差来源。
九、参考文献
[1]傅献彩 ,沈文霞 ,姚天扬 .物理化学 第五版 上册 [M].北京 :高等教育出版社
[2]华南师范大学化学实验教学中心组织等编 .物理化学实验 [M].化学工业出版社
