实验报告 葡萄糖的杂志检验 名字: 学号: 1145039 20##年3月28日
检品名称: 葡萄糖 批号: 规格:__
一、目的要求
1. 掌握药物的一般杂质检查原理与实验方法。
2. 掌握杂质限度试验的概念及计算方法。
3. 熟悉一般杂质检查项目与意义。
二、主要仪器与药品
50mL纳氏比色管、坩埚、鼓风干燥箱、马弗炉、药物天平、葡萄糖、氯化钠原料药等。
三、原理:
葡萄糖是用淀粉以无机酸水解或在酶催化下经过水解得稀葡萄糖液,再经脱色、浓结晶制得。
1.国内生产方法有以下几种:
⑴酸水解法:以无机酸将淀粉水解为葡萄糖。
⑵双酶水解法:以生物酶为催化剂将淀粉水解为葡萄糖。
⑶酸酶水解法:以盐酸为液化剂,糖化酶为催化剂,将淀粉水解为葡萄糖。
根据葡萄糖生产工艺特点,应进行氯化物、重金属、砷盐等一般杂质检查,进行蛋白质、可溶性淀粉等特殊杂质检查。
四、实验方法
1. 酸度 取本品2.0g,加水20mL溶解后,加酚酞指示液3滴与氢氧化钠滴定液(0.02mol/L)0.20mL,应显粉红色。
2. 氯化物 取本品0.6g,加水溶解使成25mL,再加稀硝酸10mL;溶液如不澄清,应滤过;置50mL纳氏比色管中,加水使成约40mL,摇匀,即得供试溶液。另取标准氯化钠溶液6.0mL,置50mL纳氏比色管中,加稀硝酸10mL,加水使成40mL,摇匀,即得对照溶液。于供试溶液与对照溶液中,分别加入硝酸银试液1.0mL,用水稀释,使成50mL,摇匀,在暗处放置5分钟,同置黑色背景上,从比色管上方向下观察、比较(附录A)。供试溶液所显浑浊度不得较对照液更浓(0.01%)。
3. 硫酸盐 取本品2.0g,加水溶解使成约40mL;溶液如不澄清,应滤过;置50mL纳氏比色管中,加稀盐酸2mL,摇匀,即得供试溶液。另取标准硫酸钾溶液2.0mL,置50mL纳氏比色管中,加水使成约40mL,加稀盐酸2mL,摇匀,即得对照溶液。于供试溶液与对照溶液中,分别加入25%氯化钡溶液5mL,用水稀释至50mL,充分摇匀,放置10分钟,同置黑色背景上,从比色管上方向下观察、比较(附录B)。供试溶液所显浑浊度不得较对照液更浓(0.01%)。
4. 亚硫酸盐与可溶性淀粉 取本品1.0g,加水10mL溶解后,加碘试液1滴,应即显黄色。
5. 干燥失重 取本品,在105℃干燥至恒重,减失重量不得过9.5%(附录C)。
6. 炽灼残渣 不得过0.1%(附录D)。
7. 蛋白质 取本品1.0g,加水10mL溶解后,加磺基水杨酸溶液(1→5)3mL,不得发生沉淀。
8. 铁盐 取本品2.0g,加水20mL溶解后,加硝酸3滴,缓缓煮沸5分钟,放冷,加水稀释使成45mL,加硫氰酸铵溶液(30→100)3mL,摇匀,如显色,与标准铁溶液2.0mL用同一方法制成的对照液比较,不得更深(0.001%)。
9. 重金属 取25mL纳氏比色管两支,甲管中加标准铅溶液一定量与醋酸盐缓冲液(pH3.5)2mL后,加水稀释成25mL。取本品4.0g,置乙管中,加水适量溶解后,加醋酸盐缓冲液(pH3.5)2mL,加水使成25mL;若供试液带颜色,可在甲管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与乙管颜色一致。再在甲乙两管中分别加硫代乙酰胺试液各2mL,摇匀,放置2分钟,同置白纸上,自上向下透视,乙管中显出的颜色与甲管比较,不得更深(附录E),含重金属不得过百万分之五。
五、实验结果
1. 酸度
原理:检品中酸性杂质被碱中和,过量的碱使酚酞显粉红色。
实验现象:显粉红色。 见图一。
结论:符合规定。
2. 氯化物检查
 原理:Cl-+Ag+ HNO3 AgCl↓(白色)
原理:Cl-+Ag+ HNO3 AgCl↓(白色)
实验现象:样品管浑浊度浅于标准管。 见图二。
结论:符合规定(﹤0.01%)。
3. 硫酸盐
原理:SO4 2- 十Ba2+ —→ BaS04↓
实验现象:样品管浑浊度浅于标准管。见图三。
结论:符合规定(﹤0.01%)。
4. 亚硫酸盐与可溶性淀粉
原理:黄色为碘试液本身的颜色,证明无亚硫酸盐与可溶性淀粉存在。当有亚硫酸盐与可溶性淀粉存在时,淀粉遇碘遍蓝色,亚硫酸盐与碘发生氧化还原反应生成碘离子,变为无色。
实验现象:溶液显黄色。见图四。
结论:符合规定。
5. 干燥失重
原理:干燥失重是指药物在规定条件下经干燥后所减失的重量,根据所减失的重量和取样量计算供试品干燥失重的百分率。
实验现象:干燥失重8.0%
结论:符合规定(﹤9.5%)。
6. 炽灼残渣
实验现象:m0=20.0014g m1=22.7435g m2=22.7410g
残渣重=(m1-m2)/(m1-m0)*100% =0.09%
结论:符合规定(﹤0.1%)
7. 蛋白质
实验现象:没有发生沉淀。见图五。
结论:符合规定。
8. 铁盐
原理:Fe3++6SCN- —→ [Fe(SCN)6]3- 红色
实验现象:样品管颜色浅于标准管。见图六。
结论:符合规定。
9. 重金属
原理:硫代乙酰胺在弱酸性(pH约3.5)溶液中水解,产生硫化氢,可与重金属离子结合生成有色硫化物的均匀沉淀,可与对照标准液同法处理比较。
实验现象:样品管颜色浅于标准管。见图七。
结论:符合规定。
六、结果分析


图一 葡萄糖酸度 图二 葡萄糖氯化物
注:葡萄糖中酸性杂质被碱中和, 注:左为供试管,右为标准管
碱使酚酞显粉红色 左管浊度浅于右管


图三 葡萄糖硫酸盐 图四 亚硫酸盐与可溶性淀粉
注:左管为标准管,右管为供试管 注:溶液显黄色
左管浊度深于右管

图五 葡萄糖蛋白质实验 图六 葡萄糖铁盐实验
注:葡糖糖水溶液与磺基水杨酸 注:上管为标准管,下管为供试管
溶液不产生沉淀 上管溶液颜色深于下管

图七 葡萄糖重金属实验
注:左管为标准管,右管为供试管
左管颜色深于右管
七、讨论
1.观察实验结果时,比色方法一般是将两管同置于白色背景上,从侧面观察;比浊方法是将两管同置于黑色或白色背景上,自上而下地观察。
2.精密称定,选用的是精确度为千分之一的称量天平。
3.铁盐试验中,由于缓缓煮沸叫麻烦,可在温度80。C水中水浴约五分钟,实验结果也十分明显。
4.酸度实验中,氢氧化钠溶液可添加至0.4mL,若还不显粉色,可再滴加氢氧化钠溶液。
实验报告 葡萄糖注射液分析 名字:开德美 学号:1145039 20##年3月28日
检品名称:葡萄糖注射液 批号: 规格:
一、目的要求
1. 掌握pH值测定原理和pH计的正确操作。
2. 掌握比旋度的概念、求算方法和旋光法测定旋光性物质含量的原理与计算。
3. 熟悉紫外法检查杂质的原理与方法。
4. 了解注射液杂质检查的一般项目。
二、主要仪器与药品
WZZ-1自动指示旋光仪、pH酸度计、PH试纸、纳氏比色管、紫外分光光度仪、10%葡萄糖注射液。
三、原理

本品为无水葡萄糖的灭菌水溶液。含葡萄糖(C6H12O6·H2O)应为标示量的95.0%~105.0%。
[鉴别]取本品,缓缓滴入温热的碱性酒石酸铜试液中,即生成氧化亚铜的红色沉淀。
原理:
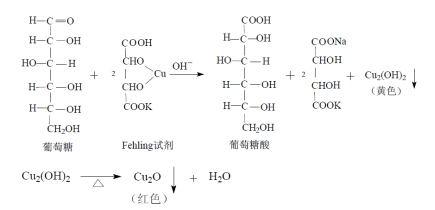
5-羟甲基糠醛
原理:葡萄糖注射液在高温加热灭菌时,易分解产生5-羟甲基糠醛: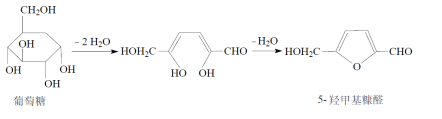
利用5-羟甲基糠醛在284nm的波长处有吸收,而葡萄糖无吸收,将样品配制成一定浓度的溶液,在284nm的波长处测定,规定吸收度不得大于0.32来控制5-羟甲基糠醛的量。
[含量测定]
旋光法(原理: 葡萄糖分子中含不对称碳原子,具有旋光性,在一定条件下,其水溶液的比旋度[α]tD为+52.5°~+53.0°,根据旋光度α与浓度C的比例关系可进行含量测定:

式中L为液层厚度(dm),C为溶液的百分浓度(g/mL,按干燥品或无水物计算)。所以:

四、实验方法
1.鉴别 取本品,缓缓滴入温热的碱性酒石酸铜试液中,即生成氧化亚铜的红色沉淀。
[检查] pH值 应为3.2~5.5。
2.精密量取本品适量(约相当于葡萄糖1.0g),置100mL量瓶中,加水稀释至刻度,摇匀,在284nm的波长处测定,吸收度不得大于0.32。
3.重金属 取本品30ml(约相当于葡萄糖3g),必要时,蒸发至约20mL,放冷,加醋酸盐缓冲液(pH3.5)2mL与水适量使成25mL,置25mL纳氏比色管中。另取标准铅溶液1ml与醋酸盐缓冲液(pH3.5)2mL后,加水稀释成25mL,置另一25mL纳氏比色管中。若供试液带颜色,可在标准管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与样品管颜色一致;再在两管中分别加硫代乙酰胺试液各2mL,摇匀,放置2分钟,同置白纸上,自上向下透视,样品管所显颜色与标准管比较,不得更深)。按葡萄糖含量计算,含重金属不得过百万分之五。
4.含量测定 精密量取本品100ml(约相当于葡萄糖10g),置100mL量瓶中,加氨试液0.2mL
(10%或10%以下规格的本品可直接取样测定),用水稀释至刻度,摇匀,静置10分钟,测定旋光度。用读数至0.01°并经过检定的旋光计,将测定管(长度为1dm)用供试液体冲洗数次,缓缓注入供试液体适量(注意勿使发生气泡),置于旋光计内检测读数,记录旋光度,同法读取旋光度3次,取3次的平均值作为样品的旋光度。与2.0852相乘,即得100mL供试液中含有C6H12O6·H2O的重量(g)。
测定前用水校正零点,测定后再用水核对零点,若零点变动,应重测。
五、实验结果
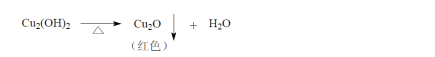 1. 鉴别
1. 鉴别
原理:
实验现象:生成红色沉淀。 见图一。
结论:符合规定。
2. 检查
实验现象:pH为
结论:符合规定。(3.2~5.5)
3. 吸光度
实验现象:吸光度为0.142
结论:符合规定(<0.32)
4. 重金属
实验现象:样品管颜色浅于标准管。见图二。
结论:符合规定。
4. 含量测定
实验现象:旋光度为5.35,100mL供试液中含有C6H12O6·H2O的重量(g)为11.16g。
结论:符合规定。
六、结果分析


图一 鉴别实验 图二 葡萄糖注射液重金属实验
注:葡萄糖注射液与碱性酒石酸铜溶液反应 注:左为样品管,右为标准管,
成红色,pH约为4.8。 左管颜色浅于右管。
七、讨论
1. pH值测定时,每次更换标准缓冲液或供试液前,应用纯化水充分洗涤电极,然后将水吸尽,也可用所换的标准缓冲液或供试液洗涤。配制标准缓冲液与溶解供试品的水,应是新沸过的冷蒸馏水,其pH值应为5.5~7.0。
2. 旋光仪接通电源后需预热5~20分钟。每次测定前后应用溶剂作空白校正。配制溶液及测定时,均应调节温度至20℃±0.5℃(除另有规定外)。供试溶液应澄清,如显浑浊或含有混悬的小粒,应预先滤过,并弃去初滤液。旋光管装样时应注意光路中不应有气泡,使用后应立即用水洗净晾干,切勿用刷子刷,也不能用高温烘烤。
3、用旋光度法测定葡萄糖的含量时,要加氨试液,是加速变旋作用,促进达到平衡,否则测得的旋光度数据不准。
第二篇:实验一 葡萄糖的一般杂质检查
实验一:葡萄糖杂质检查(教材P171)
一、目的要求:
1、葡萄糖的鉴别试验。
2、掌握一般杂质检查的目的和原理。
3、熟悉杂质检查的操作方法。
二、实验原理
1、鉴别试验:醛基或酮基有还原性,在碱性酒石酸铜(Fehling试液)中还原铜成氧化亚铜。无水葡萄糖、葡萄糖注射液、葡萄糖氯化钠注射液均用此法鉴别。
2、酸碱度检查:是用药典规定的方法对药物中的酸度、碱度及酸碱度等酸碱性杂质进行检查。检查时应以新沸并放冷至室温的水为溶剂。不溶于水的药物,可用中性乙醇等有机溶剂溶解。常用的方法有酸碱滴定法,指示剂法以及pH值测定法。
3、氯化物检查法:氯化物在硝酸溶液中与硝酸银作用,生成氯化银沉淀而显白色浑浊,与一定量的标准氯化钠溶液和硝酸银在同样条件下用同法处理生成的氯化银浑浊程度相比较,测定供试品中氯化物的限量。
反应离子方程式:Cl- + Ag+ → AgCl↓(白色)
4、铁盐检查法:三价铁盐在硝酸酸性溶液中与硫氰酸盐生成红色可溶性的硫氰酸铁络离子,与一定量标准铁溶液用同法处理后进行比色。
反应离子方程式:Fe3+ + 3SCN- → Fe(SCN)3(红棕色)
三、试剂与仪器
1、酚酞指示液 取酚酞1g,加乙醇100ml使溶解,即得。
2、氢氧化钠滴定液(0.02mol/L)
3、稀硝酸 取硝酸10.5 ml,加水稀释至100 ml,即得。本液含HNO3应为9.5%~10.5%
4、稀盐酸 取盐酸23.4 ml,加水稀释至100 ml,即得。本液含盐酸分数应为9.5%~10.5%
5、硝酸银溶液(0.1mol/L) 称取1.75 g硝酸银,溶于100 mL水中。
6、标准氯化钠溶液(10μgCl-/ml) 称取氯化钠0.165 g,置1000 ml量瓶中,加水适量使溶解并稀释至刻度,摇匀,作为贮备液。临用前,精密量取贮备液10ml,置100 ml量瓶中,加水稀释至刻度,摇匀,即得(每1ml相当于10 μg的Cl-)
7、碘试液1滴 取碘13.0g,加碘化钾36g与水50ml溶解后,加盐酸3滴与水适量使成1000ml,摇匀,用垂熔玻璃器滤过。
8、硫氰酸铵溶液 取硫氰酸铵30g,加水使溶解成100ml,即得。
9、标准铁溶液2.0ml 称取硫酸铁铵[FeNH4(S04)2·12H20]0.863g,置1000ml量瓶中,加水溶解后,加硫酸2.5ml,用水稀释至刻度,摇匀,作为贮备液。 临用前,精密量取贮备液10ml,置100ml量瓶中,加水稀释至刻度,摇匀,即得(每1ml相当于10μg的Fe)。
10、比色用原液
(1)比色用重铬酸钾液 取重铬酸钾,研细后,在120℃干燥至恒重,精密称取0.40g,置500ml量瓶中, 加适量水溶解并稀释至刻度,摇匀,即得。每1ml溶液中含0.800mg的K2Cr2O7。
(2)比色用硫酸铜液 取硫酸铜约32.5g,加适量的盐酸溶液(1→40)使溶解成500ml,精密量取10ml,置碘量瓶中,加水50ml、醋酸4ml与碘化钾2g,用硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失。每1ml硫代硫酸钠滴定液(0.1mol/L)相当于24.97mg的CuSO4?5H2O。根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每1ml溶液中适含62.4mg的CuSO4?5H2O,即得。
(3)比色用氯化钴液 取氯化钴约32.5g,加适量的盐酸溶液(1→40)使溶解成500ml,精密量取2ml,置锥形瓶中,加水200ml,摇匀,加氨试液至溶液由浅红色转变至绿色后,加醋酸-醋酸钠缓冲液(pH6.0)10ml,加热至60℃,再加二甲酚橙指示液5滴,用乙二胺四醋酸二钠滴定液(0.05mol/L)滴定至溶液显黄色.每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于11.90mg的CoCl2?6H2O。根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每1ml溶液中适含59.5mgCoCl2?6H2O,即得。
四、操作步骤
鉴别试验(1) 取本品约0.2g,加水5ml 溶解后,缓缓滴入温热的碱性酒石酸铜试液中,即生成氧化亚铜的红色沉淀。
2.1 酸度
取本品2.0g,加水20ml溶解后,加酚酞指示液3滴与氢氧化钠滴定液(0.02mol/L)0.20ml,应显粉红色。
2.2 溶液颜色
取本品5.0g,加热水溶解后,放冷,用水稀释至10mL,溶液应澄清无色;如显浑浊,与1号浊度标准液比较,不得再浓;如显色,与对照液(取比色用氯化钴液3.0mL、比色用铬酸钾液3.0mL与比色用硫酸铜液6.0mL,加水稀释成50mL)1.0mL加水稀释至10mL比较,不得更深。
2.3 氯化物
取本品0.60g,加水溶解使成25ml(如显碱性可滴加硝酸使遇石蕊试纸显中性反应),再加稀硝酸10ml,溶液如不澄清,虑过。置50ml纳氏比色管中,加水适量使成约40ml,摇匀,即得供试液。另取与标准氯化钠溶液一定量制成得对照液【取标准氯化钠溶液(10μgCl-/ml)6.0ml置50ml纳氏比色管中,加稀硝酸10ml,用水稀释使成约40ml】。向供试液与对照液中分别加入硝酸银试液1ml,再加水适量使成50ml,摇匀,在暗处放置5分钟,同置黑色背景上,比较浑浊,不得更浓(0.010%)
2.4 亚硫酸盐与可溶性淀粉
取本品1.0g,加水10ml溶解后,加碘试液1滴,应即显黄色(2)。
2.5 铁盐
取本品2.0g,加水20ml溶解后,加硝酸3滴,缓缓煮沸5分钟,放冷,加水稀释使成45ml,加硫氰酸铵溶液(30à100)3ml,摇匀,如显色,与标准铁溶液2.0ml用同一方法制成得对照溶液比较,不得更深(0.001%)。
五、实验现象记录

八、实验讨论
1、试验比浊方法是将两管同置于黑色背景上,从上向下垂直观察;比色方法是将两管同置于白色背景上,从侧面或自上而下观察;而且所用比色管刻度高度应一致。
2、亚硫酸盐与可溶性淀粉项,如存在亚硫酸盐时碘试液褪色,存在可溶性淀粉时溶液呈蓝色。
