电池电动势的测定以及其应用
摘要 本实验利用对消法以及电位差计测定可逆电池Ag-AgCl│KCl(m1)║AgNO3(m2)|Ag的电动势求AgCl的溶度积Ksp,并测量不同温度条件下的电池电动势E,得到E—T关系曲线,并得到有关的热力学函数。并由铜电极与银电极组成的电池测量铜电极的标准电极电势。
关键词 对消法 电位差计 电极电势 铜电极 银电极 AgCl的溶度积 前言
化学电池是由两个“半电池”即正负电极放在相应的电解质溶液中组成的。由不同的这样的电极可以组成若干个原电池。在电池反应过程中正极上起还原反应,负极上起氧化反应,而电池反应是这两个电极反应的总和。其电动势为组成该电池的两个半电池的电极电位的代数和。若知道了一个半电池的电极电位,通过测量这个电池电动势就可算出另外一个半电池的电极电位。所谓电极电位,它的真实含义是金属电极与接触溶液之间的电位差。它的绝对值至今也无法从实验上进行测定。在电化学中,电极电位是以一电极为标准而求出其他电极的相对值。本实验中则选用银—氯化银作为第二级参比电极。
通过对电池电动势的测量可求算某些反应的?H,?S,?G等热力学函数,电解质的平均活度系数,难溶盐的活度积和溶液的pH等物理化学参数。但用电动势的方法求如上数据时,必须是能够设计成一个可逆电池,该电池所构成的反应应该是所求的化学反应。
1. 实验部分
1.1 仪器与药品
UJ24型电位差计 1台, 银—氯化银参比电极 1支 铂电极 2支 铜电极 2支 恒温槽 1套 标准电池 1只 半电池管 2支 毫安表、电阻箱 各1只 U型管 2支 直流稳压电源 1台
检流计 1只 琼脂、KCl、KNO3(分析纯) 0.1mol·dm-3 AgNO3溶液 0.1000mAgNO3+0.1 m HNO3溶液 0.1 mol·dm-3 ZnSO4溶液 0.1000mZnSO4溶液
饱和Hg2(NO3)2溶液 导线若干 滤纸若干
1.2 实验步骤
1、制备银电极:将铂丝电极放在浓HNO3中浸泡15分钟,取出用蒸馏水冲洗,如表面仍不干净,用细晶相砂纸打磨光亮,再用蒸馏水冲洗干净插入盛0.1 mol·dm-3AgNO3溶液的小烧杯中,按图7-(1)接好线路,调节可变电阻,使电流在3mA、直流稳压源电压控制在6V镀20分钟。取出后用0.1 mol·dm-3的HNO3溶液冲洗,用滤纸吸干,并迅速放入盛有0.1000mAgNO3+0.1 mHNO3溶液的半电池管中(如图7-2)

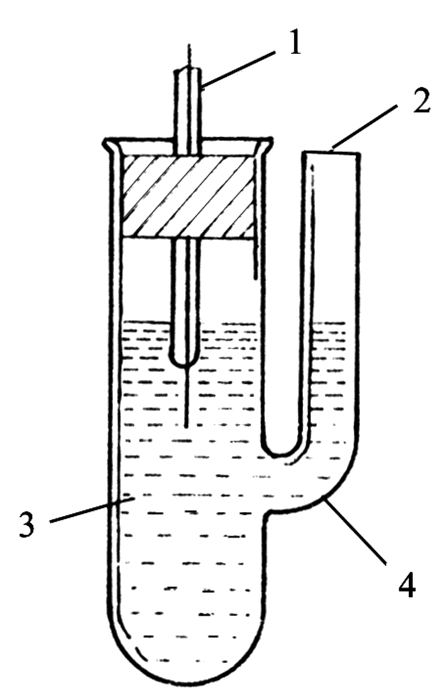
图7-1 电极制备装置图 图7-2 半电池管
1—电池 2—辅助电极 1—电极 2—盐桥插孔 3—被镀电极 4—镀银溶液 3—电解质溶液 4—玻璃管
2、制备铜电极;(因为锌电极稳定性较差,所以改用铜电极)将两支铜电极在稀硫酸中浸洗,取出后用蒸馏水淋洗,放入镀铜溶液中,控制I=3mA,V<10V,电镀20分钟,取出后再用蒸馏水淋洗,放入测量用的铜溶液中;
3、制备盐桥:量取约100ml的饱和KNO3溶液,放入三角锥型瓶中;再往三角
锥型瓶中加入少量的KNO3晶体使之处于饱和状态即可;在天平上称取约3g琼脂粉,倒入三角锥型瓶中;三角锥型瓶放入热水浴中加热,使琼脂粉溶解;不能直接加热!!!将U型玻璃管洗净;手持U型玻璃管口向上,将玻璃管外壁在热水浴预热(防止热琼脂-KNO3饱和溶液在冷玻璃管中快速冷凝造成气泡断路);用滴管吸取热琼脂-KNO3饱和溶液缓慢加入到热U型玻璃管中直至完全充满,不能有气泡!!!玻璃管口朝上放置自然冷却;冷却后的胶凝饱和溶液因体积收缩在管口呈现凹面,再滴上一滴热溶液,使管口呈凸面,以放置盐桥倒置在电极管中使用时在管口产生气泡。盐桥如果长时间不使用时,要将盐桥管口倒置放入饱和溶液中,放置水挥发后管内结晶导电能力减弱,影响电动势数据测量。
4、测量电池电动势:将银电极和铜电极组合成电池,在25℃条件下,用对消法测量器电动势,并计算铜电极的标准电极电势。
5、测量氯化银的溶度积,以及各热力学函数:在25℃条件下测量银电极与参比电极组成的电池的电动势所构成电池的电动势,计算Ksp,AgCl;从25℃开始,每5℃测一次银电极与参比电极组成的电池电动势,一直到40℃,计算该电池反应的ΔrSm,ΔrGm,和ΔrHm。
1.3注意事项:
1、电镀:为了防止发生触电现象,请注意:电镀时,电泳仪的电压设置不要超过10V;电镀前安装电极时,要先夹上夹子,后插入红、黑插头;电镀后拔电极时,要先拔掉红、黑插头,后取下夹子。
2、铂电极使用注意:铂电极属于贵重物品, 使用过程中铂金丝容易折断,所以在使用时要轻取轻放, 避免与容器底部相碰时折断; 用金相砂纸打磨光亮时,也要用力轻柔。
2. 结果与讨论
2.1 铜电极电势的测量
实验中将铜电极与银电极组合成的电池电势为0.427889V,其中铜电极为负极,银电极为正极。测得铜电极电势为
?Cu2+/Cu= 1.121566V
表达为误差表示形式为
?Cu2+/Cu=( 1.121566 ± 0.000159)V
2.2 氯化银的溶度积
在25℃时,氯化银的溶度积为
Ksp,AgCl =4.719339 * 10-11 mol 2*L-2
P Ksp,AgCl =10.33
查表可以得知,氯化银在25℃的溶度积为
Ksp =1.8 *10 -10
P Ksp= 9.74
Ksp相对误差为 73.83%
PKsp相对误差为 6.06%
通过测量电动势来确定氯化银的溶度积,误差很大,主要是电极电势由于各种原因而测量不准。在实验中我们选用饱和KNO3盐桥,而盐桥的制备的好坏都会影响电动势数据测量。制备盐桥时,要保证盐桥中不能有气泡,也不能有结晶。而实验过程中调节电位差计时,并不能完全调零,数值一直在0附近波动,而且在测量电动势时也是的,但是可以通过多次测量减小此误差,还有就是对消法本身的系统误差。
2.3 有关热力学函数的计算
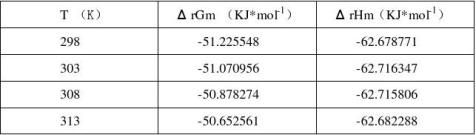
下表列出了实验中各个温度下电池Ag-AgCl│KCl(m1)║AgNO3(m2)|Ag各个热力学函数的值:
首先测得 ΔrSm = -38.433634 J*mol-1*K-1
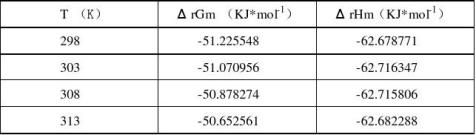
查表可以得到298K时该电池反应的各个热力学函数的值为:
ΔrSm = -32.98 J*mol-1*K-1
ΔrGm =-55.668 KJ*mol-1
ΔrHm = -65.488 KJ*mol-1
相对误差分别为ΔrSm 15.76%
ΔrGm 7.97%
ΔrHm 4.29%
3. 结论
通过对消法并且利用电位差计可以比较准确、简便的测量电池电动势,而通过对于电极电动势的测量又可以得到物质其他的性质如溶度积,电池反应的各有关热力学函数等。
实验中测得铜电极电势为 ( 1.121566 ± 0.000159)V, AgCl的溶度积为4.719339 * 10-11 mol 2*L-2,在298K 是银—氯化银电池反应的各热力学函数为 ΔrSm = 38.433634 J*mol-1*K-1 ,ΔrGm = -51.225548 KJ*mol-1 ,ΔrHm =-39.765907 KJ*mol-1 。
参考文献
【1】李龙泉,林长山,朱玉瑞,吕敬慈,江万权. 定量化学分析, 中国科学技术大学出版社, 2007
【2】南京大学物理化学教研室 傅献彩,沈文霞,姚天扬. 物理化学, 第四版(上,下册). 高等教育出版社, 2008.
【3】崔献英,柯燕雄,单绍纯. 物理化学实验 , 中国科学技术大学出版社, 2000 Electromotive force of determination and its application Junling Zhou PB07206109 of Science and Technology University of Chemical Abstract In this study, cancellation method, and potential difference measured reversible cell Ag-AgCl │ KCl (m1) ║ AgNO3 (m2) | Ag in the EMF requirements AgCl in solubility product Ksp, and under different temperatures were measured electromotive force E, by E-T curve, and by the thermodynamic functions. By the copper electrode and silver electrode measurement of copper electrode cell consisting of a standard electrode potential.
Keywords cancellation method; potentiometer ; electrode potential electrode AgCl solubility ; silver electrode ; copper electrode
【附录】 原始数据及数据处理
1 、测量铜电极的电动势
室温:24.03℃ 恒温槽温度: 25.12℃ 标准电极电势:E标= 1.01862V 负极:铜电极 正极:银电极
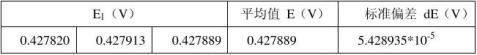
负极 :参比电极
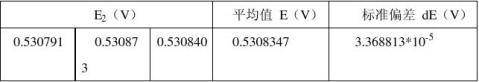
正极:银电极
所以铜电极的电动势为: ?Cu2+/Cu=E2 +E标— E1=1.121566V 有误差传递可得:
(?Cu2+/Cu / d?Cu2+/Cu)2 =(E2/dE2)2 +(E1/dE1)2
所以可以得到 d?Cu2+/Cu = 0.000159
所以铜电极电动势的误差表示形式为:
?Cu2+/Cu=( 1.121566 ± 0.000159)V 2 、AgCl的溶度积
由上可知在298K时银电极与标准电极组合成的电池的电动势为 E2 = 0.5308347V
有公式 E=
以及 CARTFlnaAg??aCl?Ksp?RTFln??Ag?CAg???Cl?CCl????Ksp(C)??2 gN3O=0.1000m, ??=0.734,
??=0.606。 CKCl=1.000m时,
可得 Ksp =4.719339 * 10-11 mol 2*L-2
3 、有关热力学函数的计算
负极: 参比电极 正极: 银电极 环境温度: 24.03℃

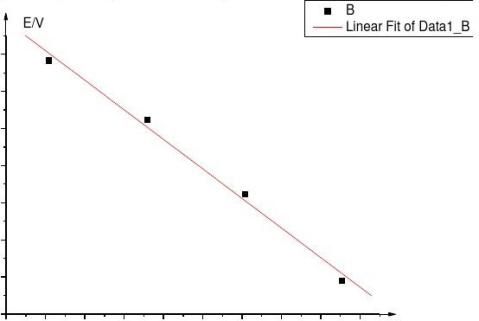
作出E—T (横轴单位为K)图像,可得到
0.5310.5300.5290.5280.5270.5260.5250.524
E-T图像
E=0.64978— 3.98276*10-4T R=0.99626
由上可以得到 (
?E?T
)P = - 3.98276*10
-4
所以可以得到 ?rSm??(
??rGm
?T
)P?nF(
?E?T
)P= - 38.433634 J*mol
-1
*K-1
由 ?rGm=-nFE
和 ?rHm??nFE?nFT(可以得到
标准热力学函数的计算 ?E?T
)P
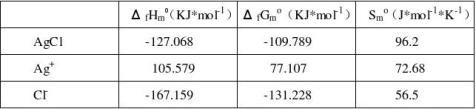
电池总反应方程式为 Ag+ + Cl-1 =AgCl 所以反应热力学函数为:
ΔrHm = -127.068 -105.579+167.159= -65.488 KJ*mol-1 ΔrGm = -109.789 -77.107+ 131.228= -55.668 KJ*mol-1 ΔrSm =96.2-72.68-56.5= 32.98 J*mol-1*K-1
第二篇:实验6 电池电动势的测定及其应用
实验六 电池电动势的测定及其应用
【摘 要】
本实验使用电位差计利用对消法测量不同电池的电动势,同时展示测定电池电动势的几种应用---如计算标准电极电势,电解质的平均活度系数,难溶盐的溶度积以及电池反应的重要热力学函数△rGm,△rSm,△rHm等。
【Abstract】
In this experiment ,we use and apply the compensation method to measure the electromotive force of different cells, and show some purposes---- calculate the standard electrode potential, the mean activity coefficient of electrolyte, the solubility product of indissoluble salt,the important thermodynamic function △rGm,△rSm,△rHm and so on.
【关 键 词】
可逆电池 电池电动势 标准电极电势
平均活度系数 热力学函数 难溶盐溶度积
【Keywords】
reversible cell
electromotive force of cell
standard electrode potential
mean activity coefficient
thermodynamic function
solubility product of indissoluble salt
【前 言】
化学电池是由正负电极放在相应的电解质溶液中组成的,其电动势为组成该电池的正负电极的电极电势的代数和。通过对电池电动势的测量可求算某些反应的△G,△S,△H等热力学函数,电解质的平均活度系数,难溶盐的溶度积和溶液的PH等物理化学参数.因而将一些化学反应转换成电池,测定电动势应用广泛。但用电动势法求上述数据时,必须是能够设计成一个可逆电池,且该电池所构成的反应是所求的化学反应。
电池的电动势不能直接用伏特计来测量。因为当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中就发生化学反应,溶液的浓度不断改变,因而电动势也不断改变,这时电池已不是可逆电池。另外,电池本身有电阻,用伏特计所量出的只是两电极间的电势差而不是可逆电池的电动势。所以测量可逆电池的电动势必须在几乎没有电流的情况下进行。电位差计是利用对消法测电动势的一种仪器,基本可以达到这一要求。本实验就是通过电位差计来测电势的。
一、实验目的与要求
1、通过实验加深对可逆电池、可逆电极概念的理解。
2、掌握对消法测定电池电动势的原理及电位差计的使用方法。
3、学会一些电极和盐桥的制备。
4、通过测量电池Ag-AgCl│KCl(m1)║AgNO3(m2)|Ag的电动势求AgCl的溶度积Ksp。
-5、测量电池Zn│ZnSO4(m1)║Cl(m2)│AgCl-Ag的电动势随温度的变化,并计算有关的
热力学函数。
二、预习要求:
1、 明确可逆电池、可逆电极的概念。
2、 了解电位差计、标准电池和检流计的使用及注意事项。
3、 掌握对消法原理和测定电池电动势的线路和操作步骤。
4、 掌握用电池电动势法测定化学反应热力学函数的原理和方法。
5、 了解不同盐桥的使用条件。
三、实验原理
化学电池是由两个“半电池”即正负电极放在相应的电解质溶液中组成的。由不同的这样的电极可以组成若干个原电池。在电池反应过程中正极上起还原反应,负极上起氧化反应,而电池反应是这两个电极反应的总和。其电动势为组成该电池的两个半电池的电极电位的代数和。若知道了一个半电池的电极电位,通过测量这个电池电动势就可算出另外一个半电池的电极电位。所谓电极电位,它的真实含义是金属电极与接触溶液之间的电位差。它的绝对值至今也无法从实验上进行测定。在电化学中,电极电位是以一电极为标准而求出其他电极的相对值。现在国际上采用的标准电极是标准氢电极,即在aH??1时,PH2=1atm时被氢
气所饱和的铂电极,它的电极电位规定为0,然后将其他待测的电极与其组成电池,这样测得电池的电动势即为被测电极的电极电位。由于氢电极使用起来比较麻烦,人们常把具有稳定电位的电极,如甘汞电极,银—氯化银电极作为第二级参比电极。
通过对电池电动势的测量可求算某些反应的?H,?S,?G等热力学函数,电解质的平均活度系数,难溶盐的活度积和溶液的pH等物理化学参数。但用电动势的方法求如上数据时,必须是能够设计成一个可逆电池,该电池所构成的反应应该是所求的化学反应。 例如用电动势法求AgCl的Ksp需设计成如下的电池:
Ag-AgCl?KCl(m1)║AgNO3(m2)│Ag
该电池的电极反应为:
-负极反应:Ag(s)+Cl(m1) ? AgCl(s)+e-
+正极反应:Ag(m2)+e- ? Ag(s)
+-电池总反应:Ag(m2)+Cl(m1) ? AgCl(s)
电池电动势:E=?右-?左
=[?Ag?/Ag??RTRT1?lnaAg?]?[?Ag?ln] /AgClFFaCl?
=E??RT1 (7-1) lnFaAg?aCl?
1RT1ln (该反应n=1),E°= (7-2) KspFKsp又因为?G°=-nFE°=?RTln
整理后得(将(2)式代入(1)式): E?
RT1RT
ln?lnaAg??aCl? FKspF
RTaAg??aCl?RT??Ag??CAg????Cl??CCl?
=ln?ln(C?)?2 (7-3)
FKspFKsp
所以只要测得该电池的电动势就可根据上式求得AgCl的Ksp。其中??Ag?为AgNO3
??Cl?为KCl溶液的平均活度系数。溶液的平均活度系数,当CAgNO3=0.1000m时,??=0.734,
CKCl=1.000m时,??=0.606。
化学反应的热效应可以用量热计直接度量,也可以用电化学方法来测量。由于电池的电
动势可以准确测量,所得的数据常常较热化学方法所得的可靠。
在恒温恒压条件下,可逆电池所做的电功是最大非体积功W′,而W′等于体系自由能的降低即为-?rGm,而根据热力学与电化学的关系,我们可得
?rGm =-nFE (7-4) 由此可见利用对消法测定电池的电动势即可获得相应的电池反应的自由能的改变。式中的n是电池反应中得失电子的数目,F为法拉第常数。 根据吉布斯——亥姆霍茨公式
?rGm=?rHm-T?rSm (7-5)
??rGm?E
?rSm??()P?nF()P (7-6)
?T?T
将(4)和(6)式代入(5)式即得: ?rHm??nFE?nFT(
?E
) (7-7) ?TP
由实验可测得不同温度时的E值,以E对T作图,从曲线的斜率可求出任一温度下的
(
?E
(6)(7)式可求出该反应的势力学函数?rGm 、?rSm、?rHm。 )值,根据(4)
?TP
本实验测定下列电池的电动势,并由不同温度下电动势的测量求算该电池反应的热力学函数。
-
电池为:Zn│ZnSO4(0.1000m)║Cl(1.000mKCl)│AgCl-Ag (饱和KCl盐桥)
-
该电池的正极反应为:2AgCl(s)+2e=2Ag(s)+2Cl 负极反应为:Zn (s)══Zn2++2e
-
总电池反应为:2AgCl(s)+Zn(s) ══ 2Ag(s)+Zn2++2Cl 各电极电位为: ?右??
?
Ag,AgCl,Cl?
RTaAgClRT1??ln2??Ag,AgCl,Clln2 (7-8) ??2FaCl?2FaCl-
? 左???
Zn2?,Zn
RTaZn2?RT??ln??Zn?lnaZn2? (7-9) 2?
,Zn
2FaZn2F
实验中可以准确测量不同温度的E值,便可计算不同温度下该电池反应的?rGm。以E对T作图求出某任一温度的(?E)便可计算该温度下的?rSm,由?rGm和?rSm可求出该反应?TP
的?rHm。
四、仪器与药品:
UJ24型电位差计 1台, 银—氯化银参比电极 1支
铂电极 2支 铜电极 2支
恒温槽 1套 标准电池 1只
半电池管 2支 毫安表、电阻箱 各1只
U型管 2支 直流稳压电源 1台
检流计 1只 琼脂、KCl、KNO3(分析纯)
0.1mol·dm-3 AgNO3溶液 0.1000mAgNO3+0.1 m HNO3溶液 0.1 mol·dm-3 ZnSO4溶液 0.1000mZnSO4溶液
饱和Hg2(NO3)2溶液
导线若干 滤纸若干
五、实验步骤:
1、银电极的制备:将铂丝电极放在浓HNO3中浸泡15分钟,取出用蒸馏水冲洗,如表面仍不干净,用细晶相砂纸打磨光亮,再用蒸馏水冲洗干净插入盛0.1 mol·dm-3AgNO3溶液的小烧杯中,按图7-(1)接好线路,调节可变电阻,使电流在3mA、直流稳压源电压控制在6V镀20分钟。取出后用0.1 mol·dm-3的HNO3溶液冲洗,用滤纸吸干,并迅速放入盛有0.1000mAgNO3+0.1 mHNO3溶液的半电池管中(如图7-2)
将两只铜电极在稀 HNO3 溶液中浸泡,取出用蒸馏水冲洗,如表面不干净,用细晶相砂纸打磨光亮,放入镀铜溶液中,控制I=3mA,V<10v,电镀 20 分,取出后冲洗。
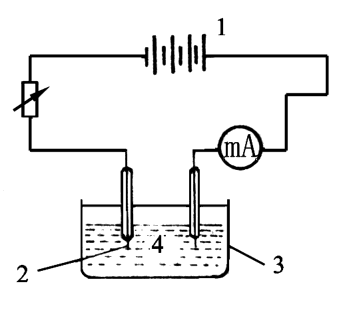
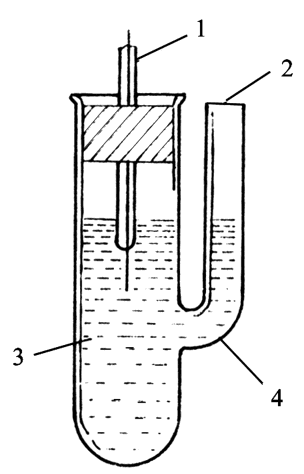
图7-1 电极制备装置图 图7-2 半电池管
1—电池 2—被镀电极 1—电极 2—盐桥插孔 3—辅助电极 4—镀银溶液 3—电解质溶液 4—玻璃管 2、制备盐桥:
为了消除液接电位,必须使用盐桥。参见附录的方法,制备KNO3盐桥和KCl盐桥。分别放入饱和的KNO3溶液和KCl溶液中待用。
3、测量电池的电动势:
(1)将镀好银的电极插入装有AgNO3溶液的半电管中,将镀好铜的电极插入装有CuCl2溶液的半电池管中,并将两管用盐桥连接,用恒温槽在25℃恒温10分钟,用数字式电位差计测其电势,记录数据。
(1) 将参比电极插入装有KCl的半电池管中,用盐桥连接参比电极与银电极,组成电池,置于恒温槽中,25℃时恒温10-15分钟,用数字式电位差计测该电池的电动势。
(2) 改变恒温槽温度,分别在30℃、35℃、40℃稳定温度下测量该电池的电动势。(注意温度要持续恒温10分钟后再测量。)
七、数据记录及处理:
室温:
标准电池电动势:1251.264 恒温槽温度:25.00℃
1、氯化银的溶度积
Ksp=1.02×10-10
查文献得,Ksp=1.76×10,
相对误差η=42.0%
故此次实验误差较大
2、测量电池2的电动势 -10 ??Cu2?/Cu(25℃)=0.337V.
电动势测温度(℃) 量值(mV)
25 461.436
30 458.165
35 453.947
40 451.235
(1) 根据不同温度下测得的E在坐标纸上对T作图,求出斜率(?E)的值。 ?Tp
由于是求斜率,温度单位是℃和温度单位是K结果一样
用origin软件作图知:
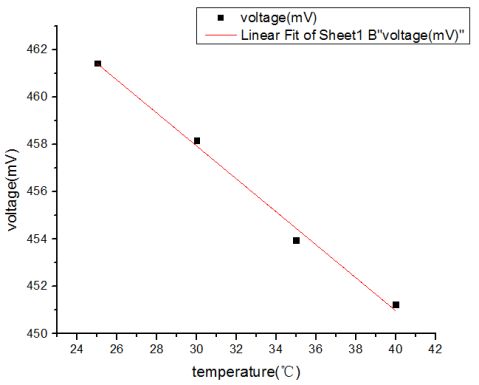
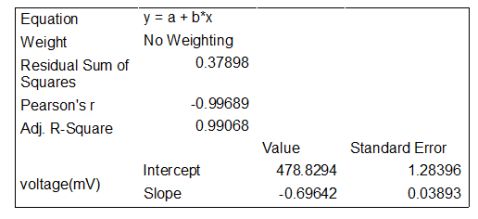
故(?E)=—0.69642mV/K ?Tp
(2) 根据7-6式求出该电池反应的?rSm,并根据公式7-5与7-7求该反应的?rGm与?rHm。
?rSm??(??rGm?E)P?nF()P=1×96484.5C/mol×﹣0.69642mV/K×V/1000mV= ?T?T
﹣67.2045J·mol-1·K-1
298K时?rGm=—nEF=﹣1×0.461436V×96484.5C/mol=﹣44521.4217J/mol
?rHm??nFE?nFT(
?E)=﹣44521.421J/mol+1×96484.5C/mol×298K×﹣?TP0.69642mV/K×V/1000mV=﹣64545.15J·mol-1
(3) 将实验测得的298K下的?rSm、?rGm和?rHm与手册上查到的?rSm、?rGm、?rHm值相比较,求相对误差。
查得反应物以及生成物热力学函数如下:
物质
AgCl (s)
Ag+ (aq)
Cl- (aq) 0-10?fHm(kJ·mol-1) ?fGm(kJ·mol) ?fS0m(J·K-1·mol-1) -127.07 105.58 -167.08 -109.80 77.12 -131.29 96.23 72.68 56.73 计算电池反应的标准热力学函数:
??-??G?rG?m=??i?fGmm (反应物) (生成物)?if
=-109.80–77.12-(-131.29)=-55.63KJ·mol
??-??H?rH?m=??i?fHm?ifm (反应物) (生成物)?1
=-127.07–105.85–(-167.08)=-65.84 KJ·mol ?1
?rS?m=????S-??S?ifm(生成物)?ifm (反应物)
?1?1 =96.23–56.73–72.68=-33.18J·mol·K
在本实验中, Ag+和Cl的活度值并非标准情况下的值, -
因为△rGm=?rGm-RTln (aAg+·aCl-)= -47.96 kJ·mol-1
△rSm=?rSm-Rln (aAg+·aCl-)= -7.42J·K-1·mol-1
△rHm=△rGm +T△rSm = -50.16kJ·mol-1
所以,可得在实验条件下电池反应的理论值:
△rGm= -47.96 kJ·mol-1
△rSm= -7.42J·K-1·mol-1
△rHm= -50.16 kJ·mol-1
八、误差分析
从实验结果可以看出,本次实验的误差很大,分析误差产生原因,有以下几点: ??
A) 随机误差
随机误差来源于实验次数的有限性,理论上,当平行实验次数大无穷多次时,随机误差回趋近于零,由于本次实验,对所测物理量都只进行了一次测量,因而偶然因素产生的误差会较大,实验得到的数据的不确定度也就很大。
B) 仪器误差
本实验是采用对消法,当计算机上显示数据为零或非常接近于零时,读取电阻箱上数值,得到电池电动势。由于计算机上显示的数据经常变化,因此准确读取零点比较困难,可能因此使得实验结果产生一定偏差。
C) 系统误差
根据实验原理中要求,要设计成可逆电池,因此在测量电动势时不能有电流通过,而实际上,在调节至零点平衡之前,不断有电流通过,因此发生了电池反应,使得溶液浓度下降,因而会对实验结果产生很大影响,尤其是测量电池反应的热力学函数时,熵对溶液浓度敏感,因而测得的值与理论值相比偏差较大。并且,由于使用计算机调节零点时,显示的总是与零点有少许差距,因此实际测得的结果与真实值之间存在一定的差距。 如果两个半电池直接相连在界面上会有液接电势,产生浓差扩散,是不可逆的,因此使
用了盐桥,但实际上,由于盐桥只能减小液接电势,而不可能消除液接电势,因此会对实验的精确性产生影响。
本实验用UJ25型电位差计测量原电池的电动势。而测量过程中若按下细调按钮时间过长,则会使原电池产生极化,影响测量的精确度。
D) 其他因素
由于恒温槽本身控温机制的限制,不可能达到绝对“恒温”,但是电池电动势随温度变化而不同,因此会对实验结果产生影响。
在计算电池反应的热力学函数时,对E—T曲线斜率的确定会对结果产生一定影响。 综上几点因素,使得实验值与真实值之间有一定差距,但是,用测定电池电动势法来确定电机标准电势,电解质的平均活度系数,难溶盐的溶度积以及电池反应的重要热力学函数△rGm,△rSm,△rHm等的方法简单易行,如果实验仪器精密度达到一定程度,实验操作足够准确,电动势法测得的数据比起其他一般方法还是比较准确的。
九、实验感想
1、测量完一组电池后,盐桥务必要用蒸馏水洗净用滤纸擦干,以便继续用于下一组电池的测量。否则,容易使盐桥变质,并且影响下一组电池的测试结果。
2、锌电极、铜电极打磨洗净后尽快插入相应的电解质溶液中,组成相应电池进行测定,以免氧化物薄膜生成影响测试结果。除被打磨部位浸入电解质溶液外,其余如金属夹子等不应接触电解质溶液。
3、接电路时,勿将正负极接反。
4、使用甘汞电极时,电极内应充满饱和KCl溶液,电极封帽要取下。
5、电动势测量在物理化学研究工作中具有重要的实际意义,通过电池电动势测量,可以获得氧化还原体系的许多热力学数据,如平衡常数、活度和活度系数、离解常数、溶解度、酸碱度以及一些热力学函数改变量。
6、电动势测量是平衡测量,测量过程中要尽可能做到在可逆条件下进行。
7、实验前,应先将半电池管中的液体恒温后,在测定电动势。
8、操作时间应尽可能的快,而且电极在电路中接通以后要尽快读数,否则电极通电时间过长则溶液中离子浓度变化较大,而且电极也会失效,就会给实验带来较大的误差。
9、通过本实验,我基本掌握了通过电动势的测定来确定其他一些物理化学参数的方法,加深了对电池反应及其应用的原理的理解。
10、本实验误差较大,结果仅供参考。
十、参考资料
《物理化学实验》 崔献英等编著 中国科学技术大学出版社(2000.4)
《物理化学》 傅献彩 等编 高等教育出版社(2005.7)
