宁波工程学院
物理化学实验报告
专业班级 姓名 序号 实验日期
同组姓名 指导老师
实验名称 电动势的测定及应用
一、 实验目的
1、通过实验加深对可逆电池、可逆电极、盐桥等概念的理解。
2、掌握对消法测定电池电动势的原理及电位差计的使用方法。
3、通过电池Ag | AgNO3(b1) || KCl(b2) | Ag-AgCl |Ag的电动势求AgCl的溶度积Ksp。
4、了解标准电池的使用和不同盐桥的使用条件。
二、 实验原理
1、可逆电池的电动势:
电池的书写习惯是左方为负极,右方为正极。如果电池反应是自发的,则电池电动势为正。符号“|”表示两相界面,“||”表示盐桥。在电池中,电极都具有一定的电极电势。当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电极电势。规定电池的电动势等于正负电极的电极电势之差,即:
E = ψ+-ψ-
可逆电池必须具备的条件为:
1、电极上的化学反应可向正反两个方向进行,即反应可逆;
2、电池在工作(充放电)时,所通过的电流必须无限小,此时电池可在接近平衡状态下工作,即能量可逆;
3、电池中所进行的其它过程可逆。如溶液间无扩散、无液体接界电势;
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量时,常用正负离子迁移数比较接近的盐类构成“盐桥”来减小液体接界电势。要达到工作电流零的条件,必须使电池在接近热力学平衡条件下工作。测量可逆电池的电动势不能直接用伏特计来测量。所以要准确测定电池的电动势,只有在电流无限小的情况下进行,所采用的对消法就是根据这个要求设计的。
2、对消法测定原电池电动势原理
在待测电池上并联一个大小相等,方向相反的外加电势差,这样待测电池中没有电流通过,外加电动势的大小即等于待测电池的电动势。装置如下:

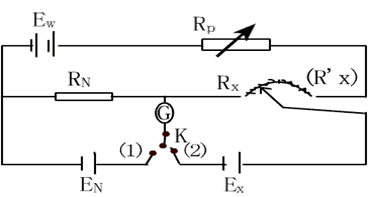
Ew -工作电源,EN -标准电池,Ex -待测电池;
R-调节电阻,Rx-待测电池电动势补偿电阻,RN -标准电池电动势补偿电阻;
K -转换电键,G -检流计。
3、电极:
1、标准氢电极:电极电势的绝对值无法测定,手册上所列的电极电势均为相对电极电势,即以标准氢电极作为标准(标准氢电极是氢气压力为101325Pa,溶液中H+为1,其电极电动势规定为零)。将标准氢电极与待测氢电极与待测电极组成电池,所测电池电动势就是待测电极的电极电势。
2、参比电极:由于氢电极使用不便,常用另外一些易制备、电极电势稳定的电极作为参比电极。常用的参比电极有甘汞电极、银-氯化银电极等。这些电极与标准氢电极比较而得的电极电动势已精确测出。
4、电池:
电池(1):(-)Hg(s) | Hg2Cl2(s) | KCl(饱和) || AgNO3(c) | Ag(s) (+)
电池(2):(-)Hg(s)|Hg2Cl2(s)|KCl(饱和)||KCl(c)|AgCl(s),Ag(s) (+)
三、 实验仪器、试剂
1、仪器:EM-3C数字式电子电位差计,检流计,标准电极,银电极1支,银-氯化银1支,饱和甘汞电极1支,50ml烧杯2个,导线、滤纸若干;
2、试剂:(0.01、0.03、0.05、0.07、0.09 moL/dm3) KCl溶液,(0.01、0.03、0.05、0.07、0.09 mol/dm3) AgNO3溶液,饱和KCl溶液。
四、 实验步骤
1、读室温,利用韦斯顿标准电池电动势温度校正公式,计算标准电池在室温时的电动势Es 。
Es=1.01845-4.05×10-5 (T/K-293.15)-9.5×10-7(T/K-293.15)2
2、将电位差计面板右侧的拨位开关拨到“外标”位置,调节左侧拨位开关至标准电池的实际Es值。用导线把标准电极正负极和电位差计面板右侧的“外标”测量孔的正负极相连接。按一下校准按钮,观察右边平衡指示LED显示值是否为零,为零时校准完毕;
3、测量待测电池I的电动势
取1个干燥、洁净的50mL烧杯,倒入约25ml 0.01mol/dm3AgNO3溶液,将银电 极用细砂纸打磨光亮,再用蒸馏水冲洗干净并擦干后插入该AgNO3溶液中;另取饱和 甘汞电极1支并将其插入装有饱和KCl溶液的容器内;将KNO3盐桥的两个支脚插入 上述两个容器中;如此构成了电池I;
将电位差计面板右侧的拨位开关拨到“外标”位置。用导线把待测电池的甘汞电极 和电位差计面板右侧的“测量”测量孔的负极相连接;银电极和正极相连接。在测量前 粗略估计一下所测电池的电动势的数值,将左侧拨位开关调节至粗估值附近。然后将 拨位开关拨到“测量”位置,再仔细调节左侧旋钮,观察右边平衡指示LED显示值,当 平衡指示值在正负20以内时,测量完毕,记下测量数据。将拨位开关拨回“外标”位置;
重复前面实验步骤,依次测量0.03,0.05,0.07,0.09 mol/dm3 AgNO3溶液至 全部待测溶液测量完毕;
4、测量待测电池II的电动势
取1个干燥、洁净的50mL烧杯,倒入约25mL 0.01mol /dm3KCl溶液,将银- 化银电极从避光容器中取出,用蒸馏水淋洗并用滤纸轻轻吸干,插入该KCl溶液中; 另取饱和甘汞电极1支并将其插入装有饱和KCl溶液的容器内;将KCl盐桥的两个支 脚插入上述两个容器中;如此构成了电池II;
将电位差计面板右侧的拨位开关拨到“外标”位置。用导线把待测电池的甘汞电极 和电位差计面板右侧的“测量”测量孔的负极相连接;银—氯化银电极和正负极相连接。 在测量前粗略估计一下所测电池的电动势的数值,将左侧拨位开关调节至粗略值附近。 然后将拨位开关拨到“测量”位置,再仔细调节左侧旋钮,观察右边平衡指示LED显示 值,当平衡指示值在正负20以内时,测量完毕,记下测量数据。将拨位开关拨回“外 标”位置;
重复前面实验步骤,依次测量0.03,0.05,0.07,0.09 mol/dm3 KCl溶液至全部待测溶液测量完毕;
5、测量完毕后,将所有电极放回原处;废弃溶液倒入指定的回收瓶中;KCl盐桥放回饱和KCl溶液中,AgNO3盐桥放入指定的回收瓶中,洗净所有小烧杯并放入烘箱中干燥。
五、 数据记录与处理
实验温度:25.9 ℃;标准电池温度:23.76 ℃;Es :1.01676 V;E甘汞:0.240816 V 。
电池I
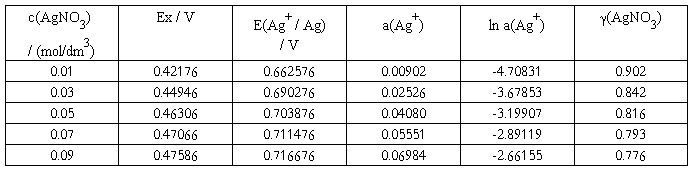
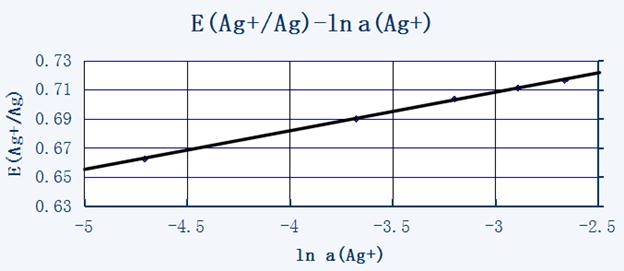
图中直线的斜率为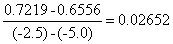
∴当 ln a(Ag+) = 0 时,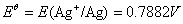
电池II

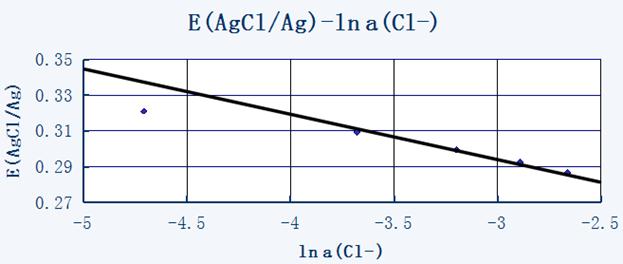
图中直线的斜率为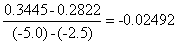
∴当 ln a(Ag+) = 0 时,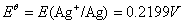
Ksp(AgCl)的计算
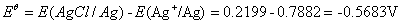


六、 注意事项
1、连接线路时,切勿将标准电池、待测电池的正负极接错。
2、实验前,应先根据附录中的公式计算出实验温度下标准电池的电动势。
3、使用测量时,要不断切换拨位开关位置,拨位开关在“测量”位置的时间要短,以防止过多的电量通过被测电池,造成严重的极化现象,破坏被测电池的可逆状态。
七、 结果与讨论
实验过程中测量电动势的动作偏慢,使实验所测的数据存在一定的误差;
实验计算所得的Ksp(AgCl)明显大于标准值,说明实验操作有待熟练。
八、 思考题
1、为什么在测量原电池电动势时,要用对消法进行测量?而不能使用伏特计来测量?
答:电池内部存在电阻,用伏特表测量时,会耗掉一部分电动势,用对消法测得话,内部无电流,可以忽略内部电阻,使得测量结果更加精确。
2、在原电池电动势测量过程中,需要使用标准电池,标准电池的一个重要特点是什么?
答:标准电池的电动势比较稳定。
3、测量双液电池的电动势时为什么要使用盐桥?
答:对于双液电池电动势的测定需用盐桥消除液体接界电势。
4、参比电极应具备什么条件?有什么功用?
答:参比电极一般用电势值已知且较恒定的电极,它在测量中可作标准电极使用,在实验中我们测出未知电极和参比电极的电势差后就可以直接知道未知电极的电势。
第二篇:华师物化实验-原电池电动势的测定与应用
华 南 师 范 大 学 实 验 报 告
学生姓名:dxh 学号:
专业:化学师范 年级、班级:20##级化教六班
课程名称:物理化学实验 实验项目:原电池电动势的测定与应用
指导老师:蔡跃鹏 实验评分:
【实验目的】
1. 掌握电位差计的测量原理和测量电池电动势的方法;
2. 掌握电动势法测定化学反应热力学函数变化值的有关原理和方法;
3. 加深对可逆电池,可逆电极、盐桥等概念的理解;
4. 测定电池(1)的电动势;
5. 了解可逆电池电动势测定的应用;
6. 根据可逆热力学体系的要求设计可逆电池,测定其在不同温度下的电动势值,计算电池反应的热力学函数△G、△S、△H。
【实验原理】
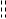 可设计成原电池的化学反应,发生失去电子进行氧化反应的部分可作为阳极,发生获得电子进行还原反应的部分可作为阴极,两个半点池组成一个原电池。电池的书写习惯是左方为负极,即阳极,右方为正极,即阴极。符号“|”表示两相界面,液相与液相之间一般加上盐桥,以符号“ ”表示,。如电池反应是自发的,则其电动势为正,等于阴极电极电势
可设计成原电池的化学反应,发生失去电子进行氧化反应的部分可作为阳极,发生获得电子进行还原反应的部分可作为阴极,两个半点池组成一个原电池。电池的书写习惯是左方为负极,即阳极,右方为正极,即阴极。符号“|”表示两相界面,液相与液相之间一般加上盐桥,以符号“ ”表示,。如电池反应是自发的,则其电动势为正,等于阴极电极电势 与阳极电极电势
与阳极电极电势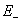 之差,即
之差,即
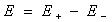
以铜-锌电池为例。铜-锌电池又称丹尼尔电池(Daniell cell),是一种典型的原电池。此电池可用图示表示如下:
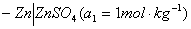
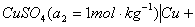
左边为阳极,起氧化反应

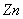
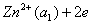
其电极电势为
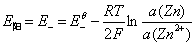
右边为阴极,起还原反应

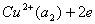
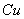
其电极电势
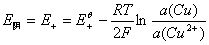
总的电池反应

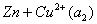
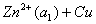
原电池电动势
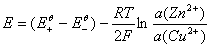 =
=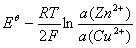

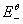 、
、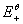 分别为锌电极和铜电极的标准还原电极电势,
分别为锌电极和铜电极的标准还原电极电势,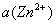 和
和 分别为
分别为  和
和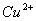 的离子活度。
的离子活度。
本实验所测定的三个电池为:
 1.原电池
1.原电池 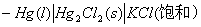
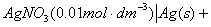
阳极电极电势 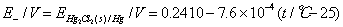
阴极电极电势 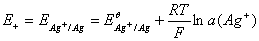
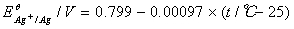
原电池电动势 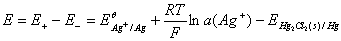
 2.原电池
2.原电池 
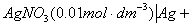
阳极电极电势 
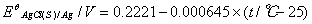
阴极电极电势 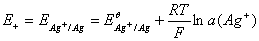
原电池电动势 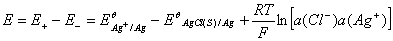
其中 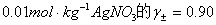
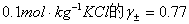
稀水溶液中 浓度可近似取
浓度可近似取 浓度的数值。
浓度的数值。
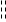 3. 原电池
3. 原电池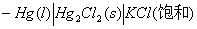

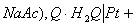
阳极电极电势 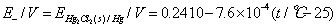
阴极电极电势 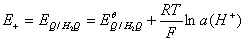

原电池电动势 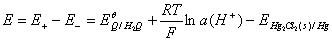
= 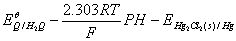
即 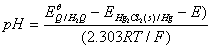
由此可知,只要测出原电池3的电动势,就可计算出待测溶液(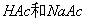 缓冲溶液)的pH值。
缓冲溶液)的pH值。
测定可逆原电池的电动势常采用对消法(又称补偿法),其原理和方法在附录1、2、3中作了详细的介绍。通过原电池电动势的测定,还可以得到许多有用的数据,如离子活度等。特别是通过测定不同温度下原电池的电动势,得到原电池电动势的温度系数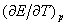 ,由此可求出许多热力学函数,如计算相应电池反应的摩尔反应吉尔斯函数变
,由此可求出许多热力学函数,如计算相应电池反应的摩尔反应吉尔斯函数变 ,摩尔反应焓
,摩尔反应焓
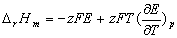 及摩尔反应熵
及摩尔反应熵  等。
等。
如果电池反应中,反应物和生成物的活度均为1,温度为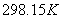 ,则所测定的电动势和热力学函数即为相应电池反应的标准
,则所测定的电动势和热力学函数即为相应电池反应的标准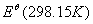 、
、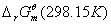 、和
、和 。
。
利用对消法可以很准确的测量出原电池的电动势,因此用电化学方法求出的化学反应的热力学函数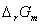 、
、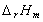 、
、 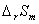 等比用量热法或化学平衡常数法求得的热力学数据更为准确可靠。原电池设计与制造的难度主要是电极的制备,所以对一些常用电极的制备方法作一些了解还是很有必要的(详见附录5)。
等比用量热法或化学平衡常数法求得的热力学数据更为准确可靠。原电池设计与制造的难度主要是电极的制备,所以对一些常用电极的制备方法作一些了解还是很有必要的(详见附录5)。
【仪器和药品】


图11.1 ZD-WC数字电位差计; 左图为全图,右图为操作面板
【实验步骤 】
1.制备盐桥
3%琼脂-饱和硝酸钾盐桥的制备方法:在250mL烧杯中,加入100mL蒸馏水和3g琼脂,盖上表面皿,放在石棉网上用小火加热至近沸,继续加热至琼脂完全溶解。然后加入40g硝酸钾,充分搅拌使硝酸钾完全溶解后,趁热用滴管将它灌入干净的U形管中,两端要装满,中间不能有气泡,静置待琼脂凝固后便可使用。制备好的盐桥不使用时应浸入饱和硝酸钾溶液中,防止盐桥干涸。
2.组合电池
将饱和甘汞电极插入装有饱和硝酸钾溶液的广口瓶中。将一个20mL小烧杯洗净后,用数毫升0.02mol/L的硝酸银溶液连同银电极一起淌洗,然后装此溶液至烧杯的2/3处,插入银电极,用硝酸钾盐桥不饱和甘汞电极连接构成电池。
3.测定电池的电动势
①根据Nernst公式计算实验温度下电池(I)的电动势理论值。
②正确接好测量电池(I)的线路。电池与电位差计连接时应注意极性。盐桥的两支管应标号,让标负号的一端始终不含氯离子的溶液接触。仪器要注意摆布合理并便于操作。
③用SDC数字电位差计测量电池(I)的电动势。每隔2min测一次,共测三次。
④接通恒温槽电源进行恒温,使其分别达到21.5℃25.2℃、30.1℃,温度波动范围要求控制在正负0.2℃之内。把被测电池放入恒温槽中恒温15min,同时将原电池引出线连接到SDC型数字式电位差计的待测接线柱上(注意正负极的连接),测定其电动势,每5分钟测1次,直至电位差计读书稳定为止。
5然后调节恒温槽,令恒温升温5℃,重复上述操作,然后再升温并进行测定。
6测量完毕后,倒去两个小烧杯的溶液,洗净烧杯的溶液。盐桥两端淋洗后,浸入硝酸钾溶液中保存。
【实验记录及数据处理】
室温:23.7℃ 气压:101.37kPa

测量温度:35.0℃

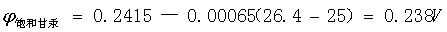
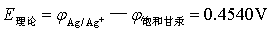
室温:23.7℃ 气压:101.37kPa

E-T图
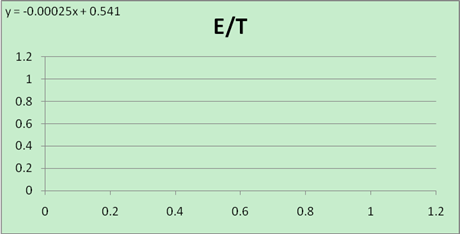
回归方程: E = -0.00025t + 0.541
故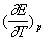 = -0.00025
= -0.00025
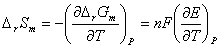

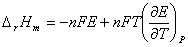
n=1,F = 96500 C/mol,E=0.45818V
得:
ΔrSm =1×96500×(-0.00025)= -24.125J/(mol?K)
ΔrGm =-1×96500×0.45818=-44.21kJ/mol
ΔrHm =-44.21 + (-24.125)×299.6×10-3=-44.13kJ/mol
电池总反应:
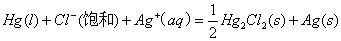
查参考文献得Ag+(aq)、Cl-(aq)、AgCl(c) 各自的的标准生成焓变ΔfHºm、标准生成自由能变ΔfGºm及标准熵Sºm,由此计算出电池反应的ΔfHºm、ΔfGºm、ΔfSºm如下所示.
Table A4. Ag+(aq)、Cl-(aq)、AgCl(c) 的ΔfHºm、ΔfGºm及Sºm

ΔrGºm= -51.31 kJ/mol
ΔrSºm= -69.35 J/(mol·K)
ΔrHºm= -71.07 kJ/mol
ΔrSºm 相对误差:(24.125-69.35)/ 69.35 =-65.21%
ΔrGºm 相对误差:(44.21-51.31)/ 51.31 =-13.84%
ΔrHºm 相对误差:(44.13-71.07)/71.07 =-37.90%
【结果讨论】
从以上的实验结果可以看出本次的实验误差较大,分析其可能原因有如下几点:
1)只有在电流无限小的情况下测量,才能达到可逆电池的要求,但在实验过程中电流无法达到无限小仍存在一定值的电流,于是产生的极化作用破坏了电池的可逆性,使电动势偏离可逆值。
2)仪器的不稳定带来较大误差,电极上较长时间的有电流通过,会发生电池反应使得溶液浓度下降、电极表面极化,这样可逆电极变成不可逆的,会给实验带来较大误差。而实验中所用仪器不稳定,需要较长的时间才能大致调节到平衡,即使是同一个电动势值,在很短的时间内测得的数据都有较大波动,所以不能很快调节到平衡是实验的误差主要来源。
3)恒温槽温度存在波动,电流不均匀,会造成不稳定,此外实验中采用盐桥来消除液接电位,但实际实验中不能保证盐桥能够完全消除液接电位。
4)本实验的理论参考数据是在标准状况下的数值,而实验过程中的温度和大气压都有变化,所以计算的误差也较大。
【思考题】
1.为何测电动势要用对消法?对消法的原理是什么?
答:电池电动势不能用伏特计直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生极化,结果使电极偏离平衡状态。另外,电池本身有内阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流通过电池的情况下进行,因此,采用对消法。对消法是在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。
2.电位差计、标准电池、检流计及工作电池各有什么作用?
答:电位差计:利用补偿法测定被测电极电动势;标准电池:提供稳定的已知数值的电动势,以此电动势来计算未知电池电动势。检流计:指示通过电路的电流是否为零;
工作电池:为整个电路提供电源,其值不应小于标准电池或待测电池的值。
3.测电动势为何要用盐桥?如何选用盐桥以适合不同的体系?
答:(1)对于双液电池电动势的测定需用盐桥消除液体接界电势。
(2)选择盐桥中电解质的要求是:①高浓度(通常是饱和溶液);②电解质正、负离子的迁移速率接近相等;③不与电池中的溶液发生反应。具体选择时应防止盐桥中离子与原电池溶液中的物质发生反应,如原电池溶液中含有能与Cl-作用而产生沉淀的Ag+、Hg离子或含有能不K+离子作用的ClO-离子,则不可使用KCl盐桥,应选用KNO3或NH4NO3盐桥。
4.在测定电动势过程中,若检流计的指针总往一个方向偏转,可能是何原因?
答:若调不到零点,可能的原因有:
(1)电池(包括工作电池、标准电池和待测电池)的正负极接反了;
(2)电路中的某处有断路;
(3)标准电池或待测电池的电动势大于工作电池的电动势,超出测量范围。
5.若电池极性接反了有什么后果?
解:电位差计的电源电动势与原电池提供的电源电动势方向相同,形成电路短路。
6. 本实验中,甘汞电极如果采用0.1或1.0 mol.dm-3的KCl溶液,对原电池电动势的测量有否影响?为什么?
答:有。根据Nernest方程,电解质浓度对电池电动势有影响。
7. 标准电池有什么用途?
答:工作电流标准化。
8. 参比电池应具备什么样的条件?
答:电动势稳定,在大电流下也不任意极化。
【参考文献】
[1] ]何广平,南俊民,孙艳辉等.《物理化学实验》[M].华南师范大学化学实验教学中心,化学工业出版社,2007.
[2] 物理化学·下册.傅献彩.北京:高等教育出版社,2006,1
