丙酮碘化反应
物理化学实验报告 20##-05-09 18:29:22 阅读70 评论0 字号:大中小 订阅
一、实验目的
1.利用分光光度计测定酸催化时丙酮碘化反应的反应级数、速度常数;
2.掌握分光光度计的使用方法;
二、实验原理
丙酮碘化反应是一复杂反应,反应方程式为:

H+是反应的催化剂,因丙酮碘化反应本身有H+生成,所以,这是一个自动催化反应,又因为反应并不停留在生成一元碘化丙酮上,反应还继续下去。所以应选择适当的反应条件,测定初始阶段的反应。因碘溶液在可见光区有宽的吸收带,而在此吸收带中盐酸、丙酮、碘化丙酮和碘化钾溶液则没有明显的吸收,所以可采用分光光度计法直接观察碘浓度的变化,从而测量反应的进程。
根据公式:al=(lg100-lgT)/CI2 求得比色皿的al值
该反应的速率方程可表示为:
v=dCE /dt = -dCA/dt = -dCI 2/dt = kCpA CqI 2 CrH+
式中CE,CA,CI2,CH+ 分别为碘化丙酮,丙酮,碘,盐酸的浓度;k为速度常数;指数p,q,r分别为丙酮,碘和氢离子的反应级数。
实验证实在本实验条件下,丙酮碘化反应对碘是零级反应,即q为零。所以,
v= dCE /dt = kCpA CrH+
对上式积分后可得:
CE = kCpA CrH+ t + C
又由于 dCE /dt = -dCA/dt = -dCI 2/dt
A = alCI2 ( 比尔-兰伯定理:A为吸光度;T为透光度)
A = -lg T
al=(lg100-lgT)/CI2
得: lg T = k(al) CpA CrH+ t + B
由lgT对t做图,通过其斜率m可求得反应速度,即:m=k(al) CpA CrH+
又有:v =m/(al)
为了确定反应级数P,至少进行两次实验,用脚注数字分别表示各次实验。当丙酮初始浓度不同,而氢离子、碘的初始浓度分别相同时,即:
cA2 = u cA1,cH+2 = cH+1,CI22 = CI21
则有:v2/v1=kcpA2 crH+2 cqI2 2/kcpA1crH+1 cqI2 1=up
lg(v2/v1)=plgu
p=lg(v2/v1)/lgu=(lgm2/m1)/lgu
同理:当丙酮、碘的初始浓度分别相同,而酸的浓度不同时,即:
cA3 = cA1 cI2 3= cI21 cH+3 = ωcH+1
这样便可得出:r=(lgv3/v1)/lgω
又因为:cA4 = cA1 cH+4 = cH+1 cI2 4= xcI21
则有:q=(lgv4v1)/lgx
从而做四次实验,可求得反应级数p、r、q。
三、实验仪器及药品
仪器:unico 2000型分光光度计、秒表、6个容量瓶(50ml)、移液管(5ml、10ml)
药品:标准碘溶液(0.01095mol·L-1)、标准盐酸溶液(1.0254mol·L-1) 、标准丙酮溶液(2mol·L-1)
四、实验步骤
1.将分光光度计的波长调到520纳米处。用蒸馏水调节分光光度计,使其处于透光率“100”的位置上。
2.求al值。取5ml 标准碘溶液(0.01095mol.L-1)在50ml的容量瓶中配制 0.001095mol.L-1 碘溶液,测其透光率,更换碘溶液再重复测两次,取其平均值,求al值。

3.丙酮碘化反应的速度常数的测定。用移液管分别吸取标准碘溶液(0.01095mol.L-1)10ml、10ml、10ml、5ml,注入1到4号的4只干燥的50ml容量瓶中,另取一只移液管分别向1到4号容量瓶中加入标准盐酸溶液(1.0254mol.L-1)5ml、5ml、10ml、5ml。往1号瓶中加入标准丙酮溶液(2mol.L-1)10ml,当丙酮溶液加入一半时开始计时 ,然后加入蒸馏水迅速定容到50ml ,摇匀, 用其中的溶液清洗比色皿二次,测其透光率,每隔一分钟记录一次数据,直到取10到12个数据为止。
分别向2、3、4号瓶中加入5ml、10ml、10ml,用同样的方法测定不同时间的透光率。
五、思考题
1.动力学实验中,正确计算时间是很重要的实验关键。本实验中,从反应物开始混合,到开始读数,中间有一段不很短的操作时间 ,这对实验结果有无影响?
答:无影响。因为测得的透光率仍是该时刻本来的透光率,作出的曲线仍与原来曲线斜率一样,所以这样做对实验结果无影响。
2.影响本实验结果精确度的主要因素有哪些?
答:主要因素有:
(1)准确量取和配制溶液;
(2)测量之前混合液要充分地摇匀;
(3)保持比色皿的清洁;
(4)在测定过程中用蒸馏水多次校正透光率“0”点和“100”点;
(5)读数时要迅速准确。
六、数据处理
1.求al
CI2=0.002000mol/L al=(lg100-lgT)/CI2

2.混合溶液的时间-透光率 温度:22.2℃

3.混合溶液的丙酮、盐酸、碘的浓度
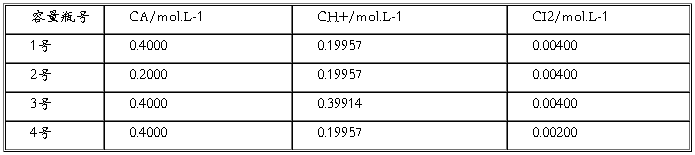
4.用表中数据,以lgT对t作图,求出斜率m。
1号:lgT与t的关系曲线图 : 拟合曲线:y = 0.02855x + 1.39375

2号:lgT与t的关系曲线图 : 拟合曲线:y = 0.01553x + 1.25896
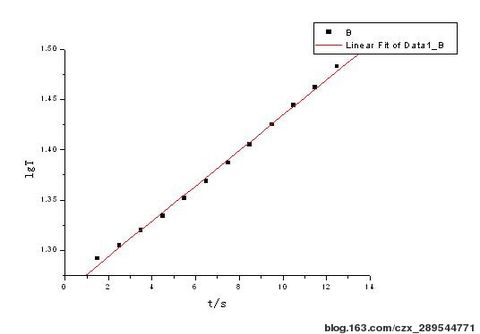
3号:lgT与t的关系曲线图 : 拟合曲线:y = 0.06049x + 1.4654
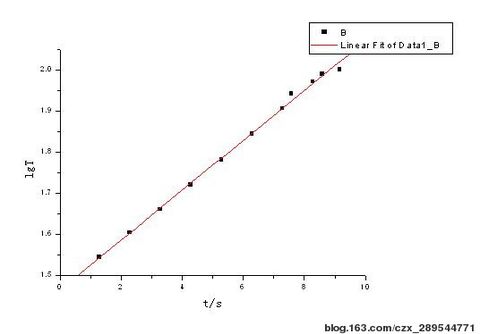
4号:lgT与t的关系曲线图 : 拟合曲线:y = 0.0324x + 1.60162
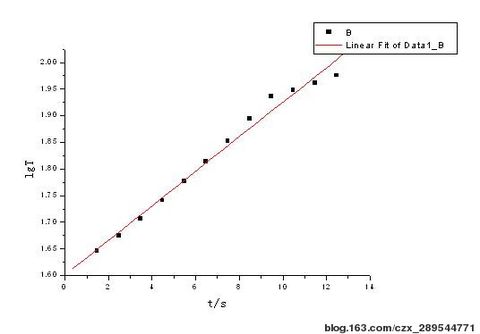
由上得出它们的斜率分别为:
1号:y = 0.02855x + 1.39375 m1=0.02855
2号:y = 0.01753x + 1.25896 m2=0.01753
3号:y = 0.06049x + 1.4654 m3=0.06049
4号:y = 0.0324x + 1.60162 m4=0.0324
5.计算反应级数(p,r,q)
① 因为: v =m/(al) 所以:ν2/ν1= m2 /m1
又因为:u cA1 = cA2
所以:u = cA2 /cA1 = 0.2000/0.4000=0.500
lgu = lg0.500 = -0.301
而lg(ν2/ν1)=lg(m2 /m1)=lg(0.01753/0.02855)= -0.212
由于lg(ν2/ν1)=plgu ,p=lg(ν2/ν1)/lgu = -0.212/(-0.301)=0.704≈1
② 因为: cH+3 = ωcH+1 ω=cH+3/cH+1 =0.39914/0.19957=2.00
而lg(ν3/ν1)=lg(m3 /m1)=lg(0.06049/0.02855)= 0.326
r=(lgν3/ν1)/lgω=0.326/lg2.00=1.083≈1
③ 因为: cI2 4= xcI21 X = cI2 4/cI21 =0.00200/0.00400=0.500
而lg(ν4/ν1)=lg(m4 /m1)=lg(0.0324/0.02855)=0.0549
q=(lgν4/ν1)/lgx=0.0549/lg0.5=-0.1825≈0
6、计算速度常数k值(令p=r=1,q=0)(测量时温度:22.2℃)[mol.L-1]-1[min]-1
因为: m=k(al)cpAcrH+ 所以,k = m/(al)CACH+
k1=m1/(al)cA1cH+1 =0.02855/(183.27*0.4*0.19957)=1.951*10-3 [mol.L-1]-1[min]-1
k2=m2/(al)cA2cH+2 =0.01753/(183.27*0.2*0.19957)= 2.396*10-3 [mol.L-1]-1[min]-1
k3=m3/(al)cA3cH+3 =0.06049/(183.27*0.4*0.39914)= 2.067*10-3 [mol.L-1]-1[min]-1
k4=m4/(al)cA4cH+4 =0.0324/(183.27*0.4*0.19957)= 2.215*10-3 [mol.L-1]-1[min]-1
k=1/4(k1+k2+k3+k4)=1/4*(1.951+2.396+2.067+2.215)*10-3
=2.157*10-3 [mol·L-1]-1[min]-1
第二篇:丙酮碘化反应
物理化学实验 丙酮碘化反应动力学 C202 2010-03-29
T=286.15K P=85.02kPa
一、实验目的
1.根据实验原理由同学设计实验方案,包括仪器、药品、实验步骤等
2.测定反应常数k、反应级数n、活化能Ea
3.通过实验加深对复杂反应的理解
二、实验原理
丙酮碘化反应是一个复杂反应,其反应式为:
实验测定表明,反应速率在酸性溶液中随氢离子浓度的增大而增大。反应式中包含产物,故本反应是自催化反应,其动力学方程式为:
-dCA/dt=-dCI/dt=kCAα CH+βCIγ 22
式中C为各物质浓度(mol/L),k为反应速率常数或反应比速,指数为反应级数n。
丙酮碘化反应的反应机理可分为两步:
第一步为丙酮烯醇化反应,其速率常数较小,第二部是烯醇碘化反应,它是一个快速的且能进行到底的反应。 用稳态近似法处理,可以推导证明,当k2CH+>>k3CI时,反应机理与实验证明的反应级数相符。 2
丙酮碘化反应对碘的反应级数是零级,级碘的浓度对反应速率没有影响,原来的速率方程可写成
-d CI/dt=kCAαCH+β 2
为了测定α和r,在CA>> CI、CH>>CI2及反应进程不大的条件下进行实验,则反应过程中,CA和 CH可近2++似视为常数,积分上式的:
CI=- kCAαCH+βt+A’ 2
CI以对t作图应为直线。与直线的斜率可求得反应速率常数k及反应级数n。 2
在某一指定的温度下,进行两次实验,固定氢离子的浓度不变,改变丙酮的浓度,使其为CA=mCA,根据21-d CI/dt=kCAαCH+β得: nB=(lg(ri/rj))/lgm 2
若测得两次反应的反应速率,即求得反应级数p。用同样的方法,改变氢离子的浓度,固定丙酮的浓度不变,也可以得到对氢离子的反应级数r。
若已经证明:p=r=1,q=0,反应速率方程可写为:-dCI/dt=kCACH+在大量外加酸存在下及反应进程不大的条件2
下,反应过程的氢离子可视为不变,因此,反应表现为准一级反应或假一级反应:-dCI/dt=k'CA式中k'=k CH+,2
k'为与氢离子浓度有关的准反应比速。
设丙酮及碘的初始浓度为CA0、CI0.侧有:CA= CI0-(CI0- CI)由数学推导最终可得: 2222
CI= - CA0 k't+ CA0C'+ CI0 22
若在不同的时刻t,测得一系列CI,将其对t作图,得一直线,斜率为- CA0 k',即可求得k'的值。在不同的氢离2
子浓度下,k’值不同。
分光光度法,在550 nm跟踪I2随时间变化率来确定反应速率。
三、仪器及药品
721分光光度计 1套 丙酮标准液 (2.000mol*L-1)
秒表 1块 HCl标准液 (1.000mol*L-1)
碘瓶(50ml) 6个 I2标准液 (0.01mol*L-1)
刻度移液管(20ml)5支
四、实验步骤
1.仪器准备:实验前先打开光度计预热。
2.标准曲线法测定摩尔吸光系数。(每组配一种浓度,共5个浓度,在一台仪器上测出吸光度,数据共享)
3. 丙酮碘化过程中吸光度的测定:迅速混合,每隔1分钟记录光度计读数,记录至少15 分钟。记住先加丙酮、碘,最后加盐酸!
注意事项:比色皿的拿法和清洗;测量碘溶液标准曲线由低到高;移液管的使用:不要吹掉最后一滴;标准曲线法测定摩尔吸光系数,(每组配一种浓度,共5个浓度,在一台仪器上测出吸光度,数据共享);锥形瓶上的体积是粗刻度,要以移液管所取的体积为准;溶液数目多,制备溶液时防止加错体积。
1
五、实验数据处理
摩尔吸光系数的测定
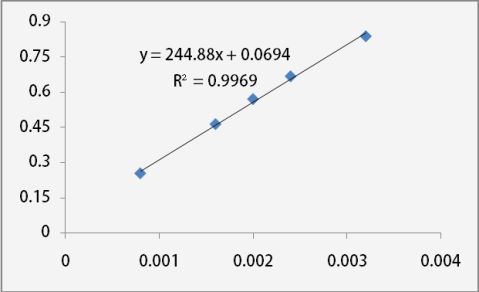
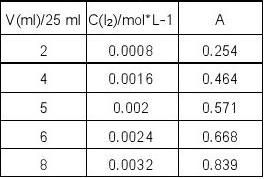
1.做标准曲线,求出碘溶液摩尔吸光系数。 A=εbc b=3cm ε= A/bc=81.63L* mol-1 *cm-1
2.利用丙酮碘化过程中吸光度的测定数据,以A对时间作图,求得四条直线,由各直线斜率分别计算反应速率r1,r2,r3,r4,由公式计算r=-(dA/dt)/ εb计算得:
ε= A/bc=81.63L* mol-1 *cm-1
r1=3.226e-5mol*L-1*min-1,r2=2.899 e-5 mol*L-1*min-1 r3=5.840e-5mol*L-1*min-1,r4=2.940e-5 mol*L-1*min-1
2
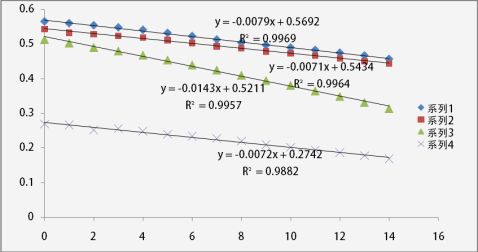
3.由nB=(lg(ri/rj))/lgm式计算丙酮,酸和碘的分级数,建立丙酮碘化反应速率方程式; α=(lg(r3/r2))/lg2=1.013 β=(lg(r3/r1))/lg2=0.860 γ=(lg(r4/r2))/lg2-1=0.020
r=-dCA/dt=-dCI/dt=kCA1.013 CI0.86CH+0.02
2
2
4.分别计算1、2、3、和4号瓶中丙酮和酸的初始浓度,再根据-dCA/dt=-dCI/dt= kCAα CH+βCIγ式计算四种不
2
2
同初始浓度的反应速率常数,求其平均值
α=1.013≈1 β= 0.860≈1 γ=0.020≈0 r =kCA CI
2
k1= 8.065 e-4dm3*mol-1*min-1 ,k2=7.248e-4dm3*mol-1*min-1 k3=7.300e-4dm3*mol-1*min-1 ,k4=7.35 e-4dm3*mol-1*min-1 k(average)=7.491 e-4dm3*mol-1*min-1
六、思考题
1.动力学实验中,正确计算时间是很重要的实验关键。本实验中,将丙酮溶液加入盛有I2和HCl溶液的碘瓶中时,反应即开始,而反应时间却以溶液混合均匀并注入比色皿中才开始计时,这样做对实验结果有无影响,为什么?
理论上有影响,但实际上几乎没有影响,理论系统误差小于千分之一。而且反应刚开始会有很多不确定因素—反应液是否完全混匀、生成中间体浓度需要多长时间达到稳态近似法处理的条件d[M]/dt= 0 等。
2.本实验对于丙酮溶液和HCl的初始浓度相对于I2的初始浓度有何要求?为什么?
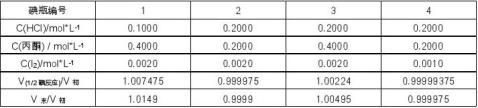
丙酮酸催化碘化反应的显著特点是,反应生成H+,而H+的反应级数β=1,反应进度增加H+增加,另一反应级数α=1的丙酮的浓度下降,由a+b值一定在a=b时,a*b有最大值。即理论上碘瓶2、4中的反应一开始速度就是最大的,反应速度随反应进度ξ增大而减小,而碘瓶1、3中的反应是加速的。由上表可知在CA>> CI、
2
CH>>CI2及反应进程不大的条件下进行实验,可认为CA、CI是不变的,反应速率恒定,I2浓度过高可能发生多
+
2
元碘化。
3.本实验结果表明碘的浓度对反应速率有何影响?据此推测反应机理。
在碘的浓度不是低到不能发生反应或高到引起其他效应的的情况下,碘的浓度对反应速率影响可以忽略, 酸催化反应机理:
3
七、实验讨论
1.反应产物对反应速率有加快作用的反应称为自催化反应。在自催化反应中,反应速率既受反应物浓度的影响,又受反应产物浓度的影响。在此反应中酸是反应的催化剂,通常不加酸,因为只要反应一开始,就产生酸HI,此酸就可自动发生催化反应,因此反应还没有开始时,有一个诱导阶段,一但有一点酸产生,反应就很快进行。
自催化作用的特点是:1>反应开始进行得很慢(称诱导期),随着起催化作用的产物的积累反应速度迅速加快,而后因反应物的消耗反应速度下降;2>自催化反应必须加入微量产物才能启动;3>自催化反应必然会有一个最大反应速率出现。
2.反应第一步为丙酮烯醇化反应,其速率常数较小,第二步是烯醇碘化反应,它是一个快速的且能进行到底的反应。烯醇碘化反应是整个反应的驱动力,使得反应可以顺利进行到底,而丙酮的烯醇化反应是决速步骤。
3.丙酮一元碘化后,由于引入的I的-I效应,使羰基氧上电子云密度降低,在质子化形成烯醇比未碘化时要困难一些,在CA>> CI及反应不是太快的条件下反应只会生成一元碘代丙酮。若是碱催化反应,一元碘化后,2
丙酮α-H的酸性会更强,更易被OH-夺取并进行碘化,最终生成三碘丙酮,OH-进攻羰基碳经加成消除机制生成黄色沉淀碘仿。实验中当碘浓度较高时,丙酮可能会发生多元取代反应。因此,应记录反应开始一段时间的反应速率,以减小实验误差。
碱催化反应机理:
4.在链反应或其它连续反应中,由于自由基等中间产物极活泼,浓度低,寿命又短,可以近似地认为在反应达到稳定状态后,它们的浓度基本上不随时间而变化,即d[M]/dt= 0 (M表示中间产物),这样的处理方法叫做稳态近似法,实验中反应的中间体为烯醇负离子。
5.温度对反应速度有一定的影响,本实验在开始测定透光率后未考虑温度的影响。如选择较大的比色皿和在不太低的气温条件下进行实验,在数分钟之内溶液的温度变化不大。选择带有恒温夹套的分光光度计,并与超级恒温槽相连,保持反应温度,可降低温度变化对实验速率的影响,反应ΔS>0、ΔH<0。
反应速率常数与温度的依赖关系为k = Aexp ( - Ea/ RT),由Arrhenius公式可近似计算实验温度下的反应活化能Ea。
k(13℃)= 7.491 e-4dm3*mol-1*min-1 根据经验温度上升10℃反应速率约增加一倍1,k(23℃) ≈
1.49e-3dm3*mol-1*min-1 由ln(k1/k2)=Ea(T2-T1)/T1T2R可以粗算得Ea≈100KJ*mol-1
6.从实验中测得的吸光度第一个值在碘浓度一样的情况下的下降趋势说明,丙酮和碘在不加酸的条件下就开始反应,粗算得未加酸时的反应速率r=5.6e-6 mol*L-1*min-1 ,约为加酸后反应速率的十分之一。
7.通过简单计算可得碘在水中的溶解度是1.123e-3mol/L,实验中用的碘水是加入了KI以得到浓度较大的碘水,体系中存在着一个次要反应,即在溶液中存在着I2、I-和I3-的平衡: 其中I2和I3-都吸收可见光。因此反应体系的吸光度不仅取决于I2的浓度而且与I3-的浓度有关。根据朗伯-比尔定律知,在含有I3-和I2的溶液的总消光度ε可以表示为I3-和I2两部分消光度之和。其中I2和I3-都吸收可见光。因此反应体系的吸光度不仅取决于I2的浓度而且与I3-的浓度有关。根据朗伯-比尔定律知,在含有I3-和I2的溶液的总消光度ε可以表示为I3-和I2两部分消光度之和
而摩尔消光系数εI2和εI3-是入射光波长的函数。在565nm这一特定的波长条件下,溶液的消光度E与总碘量(I2+I3-)成正比。因此常数εd就可以由测定已知浓度碘溶液的总消光度E来求出了。所以本实验应选择工作波长为565nm。
8.丙酮酸催化碘化反应可用于研究有机化学反应动力学的原因是,1.实验的系统误差很小,用最小二乘法对实验数据进行线性拟合,实验的系统误差会小于万分子一。2.反应主要是熵驱动的ΔS>0, I-I、C-H键减去C-I键能和I-、H+水合热后ΔH<0的数值不大,反应的热效应小;还有水的比热是最大的,反应热效应对体系的温度影响不大。3.丙酮在水中的溶解度是无穷大,可以用水做溶剂,实验条件简单, 若丙酮不溶于水,实验中要用有机溶剂,不能用无机酸等,实验就麻烦多了。
9.本实验的理论系统误差很小,可以忽略不计,导致实验结果偏离理论值的原因主要是实验的偶然误差: 分光光度计没有恒温装置,实验时间近一小时,无法消除环境温度变化对反应速率的影响;仪器不稳定等。
4
